- דילוג לתוכן הדף
- הגדלת טקסט
- הקטנת טקסט
- פונט קריא
- הדגשת כותרות
- הדגשת קישורים
- ניגודיות גבוהה
- שחור לבן
- איפוס
- סגירה

חלק הצמח | איכויות | רכיבים פעילים | פעילות רפואית | התוויות | מינונים | ספיגה | רגישות | תופעות לוואי | מינון יתר | אזהרות | התוויות נגד | רעילות | אינטראקציות | הריוֹן | הנקה | מחקרים ומנגנונים | נספח – פורמולות פטנט להגברת זמינות ביולוגית | מקורות
כורכום נפוץ במטבח הביתי כתבלין, ובתעשיית המזון הוא משמש כצבע מאכל טבעי (E100).
כורכום הינו צמח רב-שנתי, מוצאו בהודו ודרום-מזרח אסיה.
שמו הלטיני curcuma נגזר מהשם הערבי כורכום שיוחס לצמח התבלין זעפרן. הכינוי longa מתייחס לצורתו המוארכת של קנה השורש.
שמות נוספים: curcuma domestica, זעפרן הודי (Indian Saffron).
לכורכום היסטוריה רפואית בת כ-5000 שנה; ברפואה ההודית, שם השתמשו בו כתרופה עיקרית להגלדת פצעים, לטיהור דם ולטיפול בחוליי קיבה ומחלות כבד, וברפואה הסינית המסורתית בה שימש הכורכום לחיזוק צ'י ודם ולהנעת דם. במזרח הקרוב ובמערב הוא הוזכר לראשונה בכתבים אשוריים משנת 600 לפני הספירה ושוב בכתביו של הרופא והבוטנאי דיוסקורידס מימי רומא העתיקה כטוניק למערכת העיכול וכטיפול בצהבת.
סגולותיו הרפואיות הרבות והמחקרים הרבים אשר הדגימו את יעילותו במצבי בריאות שונים הפכו אותו לצמח המרפא הנמכר והנפוץ ביותר.
כורכום מותר לשיווק בישראל, ונחשב לצמח עדין ובטוח לשימוש.
חלק הצמח בשימוש
קנה השורש.
איכויות
טמפרטורה: ניטראלי.
לחות: יבש.
טעם: מריר, פיקנטי, ארומטי.
רכיבים פעילים עיקריים
פניל פרופאנואידים (3%-6%, ידועים בתור כורכומינואידים), פנולים פשוטים, פלבונואידים, קרוטנואידים, שמן נדיף (0.3%-5% הכולל 65% לקטונים ססקוויטרפניים ו-25% zingiberene).
פעילות רפואית
להלן פעילויות רפואיות שהצמח ורכיביו הדגימו בשלל מחקרים (קליניים, בע"ח או מעבדה)*:
נוגד סרטן, נוגד דלקת, נוגד חמצון, מווסת חיסון, מעודד התחדשות רקמות, מפיג גזים, מגן כבד, ממריץ מרה והפרשתה, מוריד רמות שומנים/כולסטרול בדם, משפר תפקוד כלי דם, מווסת לחץ דם, משפר זרימת דם היקפית, מגן/מחזק לב, משקם ותומך במערכת העצבים, נוגד דיכאון, מגן כליות, מטפל בפציעות, אנטי מיקרוביאלי.
*העדויות לגבי הפעילויות הרפואיות מוצגות בסעיפי מנגנוני פעולה, כאן.
התוויות
התוויות מגובות במחקרים קליניים*:
סרטן, דלקת מפרקים ניוונית, דלקת מפרקים שגרונית, מחלות מעיים דלקתיות, קרוהן, קוליטיס, כיב פפטי, תסמונת המעי הרגיש, כבד שומני, עודף שומנים בדם, סוכרת, טרשת עורקים, דיכאון, נוירופתיה, הפרעות זיכרון, אלצהיימר, דלקת בשריר, דלקת בערמונית, זיהומים ודלקות במערכת הרבייה הגברית, דלקת חניכיים, דלקת עיניים, אי ספיקת כליות, פסוריאזיס, תסמונת קדם וסתית (PMS), בטא תלסמיה, אלרגיה.
התוויות המגובות במחקרי מעבדה ובעלי חיים*:
מחלות זיהומיות, דלקת ריאות, אסתמה, מחלת ריאות חסימתית כרונית, אנדומטריוזיס, מחלות אוטואימוניות, זאבת, טרשת נפוצה, דלקת כבד, דלקת בכיס המרה.
התוויות נוספות אשר עדיין לא קיימות להן ראיות מחקריות:
אבנים בכיס המרה, דלקת לבלב, דלקת גידים, דלקת באגן, גאוט (שיגדון), פצעים/ חתכים/ שריטות, סיסטיק פיברוזיס.
*סיכום המחקרים נמצא כאן.
מינונים
תמצית נוזלית בריכוז 1:3, 45% אלכוהול – 15-40 מ"ל ביום.
תמצית יבשה תקנית בריכוז 95-97% curcumin במינון של 500-5000 מ"ג ביום.
מרתח/ צמח טחון – 4-10 גרם ביום.
בפורמולה – 25%-30%.
ספיגה
הזמינות הביולוגית של כורכומין היא נמוכה למדי. הסיבות לכך הן חוסר מסיסות במים, הרס מוגבר בסביבה בסיסית, ספיגה נמוכה במעי, חשיפה גבוהה לתהליכי פירוק במעי ובכבד (על ידי אנזימי הציטוכרוֹם שהופכים את הכורכומין הפעיל לנגזרות בלתי פעילות) ולתהליכי קוניונגציה בכבד (על ידי אנזימי הפאזה השניה שהופכים אותו למסיס ומזרזים את הפרשתו מן הגוף), ופיזור נמוך לאיברי המטרה, בייחוד במעבר דרך מחסום דם המוח(1-4).
על מנת להתגבר על בעיה זו, קיימות מספר דרכים לשיפור ולהגברת הזמינות הביולוגית של הכורכומין.
הדרכים הנפוצות ביותר כוללות שילוב של פוספטדיל כוֹלין(5-8) או פיפרין(9-10) (הרכיב הפעיל בפלפל שחור – Piper nigrum) במינון נמוך.
דרכים נוספות כוללות תערובות ותרכובות פוספוליפידיות בצורת מיצלות, ליפוזומים ופיטוזומים, שילוב כורכומין עם שמנים אתריים מצמח הכורכום, שילובו עם רכיבים צמחיים נוספים, פיתוחי נאנו-טכנולוגיה, מיקרו-אמולסיות ופיזור חלקיקי על נשאים הידרופיליים.
לפירוט נוסף על האמצעים השונים להגברת ספיגת כורכומין, ראו כאן.
לסקירה מלאה של סוגי פורמולות הפטנט הקיימות לשיפור הזמינות הביולוגית של כורכומין, תכונותיהן ומנגנוני פעולתן ראו כאן.
רגישות
קיימים דיווחים (בשכיחות נמוכה) על מקרים של תגובה אלרגית לכורכום(11-13).
תופעות לוואי
קיימים דיווחים בודדים על תופעות לוואי נדירות בשימוש פנימי שכללו עצירות,שלשולים, בחילה, אי נוחות בטנית ורטיגו וגרד(14-15).
בחלק מהמקרים לא ברור אם תופעות הלוואי נבעו מהצמח או מהמצב שהוביל לנטילתו.
קיים דיווח בודד נוסף על גרד מקומי לאחר שימוש חיצוני בכורכום(16).
בקרב 11 מתנדבים בריאים, נצפתה עלייה משמעותית ברמות האוקסלט בשתן לאחר ארבעה שבועות של צריכת כורכום, לעומת צריכת קינמון ולעומת קבוצת ביקורת(17).
כורכום גרם לנשירת שיער בחולדות, כשנצרך בשיעור של 10% מתזונתן(18). לא ברור אם השפעה זו רלוונטית גם לבני אדם.
מינון יתר
מינונים גבוהים (מעל 4 גרם תמצית יבשה ביום) עלולים לגרום לתופעות במערכת העיכול (פריסטלטיקה מוגברת ואי נוחות בטנית)(19-20).
אזהרות וצעדי מנע
הליכים כירורגיים – מוטב להפסיק את השימוש בכורכום כ-14 יום לפני הליכים כירורגיים, עקב השפעה נוגדת קרישה(21-25).
אבנים בכיס המרה – יש לנקוט זהירות רבה במתן כורכום לאנשים הסובלים מאבנים בכיס המרה, ולעשות כן תחת פיקוח מקצועי בלבד(26-30).
אבנים בכליות – יש לנקוט זהירות במתן כורכום לאנשים הסובלים מאבנים בכליות; צריכת כורכום העלתה את רמות האוקסלט בשתן של מתנדבים בריאים(17).
חשיפה לשמש – בשימוש חיצוני מוטב להימנע מחשיפה מוגברת לשמש, כיוון שכורכומין הדגים השפעה פוטוטוקסית בתנאי מעבדה(27,30).
נשירת שיער – יש לנקוט זהירות במתן כורכום למטופלים הסובלים מנשירת שיער.
בכורכום נעשה שימוש חיצוני מסורתי כמסיר שיער(31-32), ונשירה דווחה בניסויי האכלת חולדות(18).
לא ברורה מידת הרלוונטיות של ממצא זה לבני אדם.
התוויות נגד
כורכום אסור לשימוש במצבים של חסימות בדרכי המרה(27-29,33-35), עקב השפּעתו הממריצה ייצור והפרשה של מיצי מרה(36-37).
רעילות
במחקר בטיחות (38) שנערך בקרב 25 נבדקים בסיכון לפתח סרטן או עם נגעים טרום סרטניים, כורכומין ניטל בהדרגה במינון הולך ועולה החל מ-500 מ"ג ליום ועד 12 גרם ליום. הנבדקים התקשו ליטול כורכומין במינון גבוה מ-8 גרם ליום. נמצא כי כורכומין שניטל עד מינון של 8 גרם ליום במשך שלושה חודשים לא הדגים השפעות רעילות.
קיים דיווח מקרה יחיד(39) אודות אישה בת 71 שפיתחה מחלת כבד אוטואימונית (עליית אנזימי כבד ALT ו-AST, לקטאט דהידרוגנאז, בדיקת נוגדנים P-ANCA חיובית וביופסיה אבחנתית של הכבד) בעקבות נטילה של תוסף כורכום (סוג התוסף והרכבו אינם ידועים). עם הפסקת הנטילה של התוסף חלה ירידה באנזימי הכבד. עם זאת, לאישה היתה היסטוריה רפואית עתירת מחלות וביניהם ככל הנראה מחלה אוטואימונית של בלוטת התריס. כמו כן, האישה נטלה מספר רב של תרופות ותוספים, אך לא שינתה את צריכתם או מינונים בשנה-שנתיים שקדמו להופעת התסמינים, מלבד תוסף כורכום שהחלה ליטול שמונה חודשים קודם לכן. לאור ההיסטוריה הרפואית של האישה וריבוי התרופות והתוספים שנטלה, כמו גם ראיות דווקא להגנה של כורכום על הכבד, לא ניתן לקבוע קשר חד משמעי בין נטילת כורכום ובין התפתחות המחלה.
במבחני רעילות אקוטית, בטווח מינונים שנע בין 0.3-5 גרם לכל ק"ג משקל גוף, לא נצפתה כל השפעה רעילה על מגוון בעלי חיים(40-44),
כמו גם במבחני רעילות כרונית במינונים 0.1-800 מ"ג לכל ק"ג משקל גוף(40,45-49).
מדד רעילות LD50: נטילה פומית בחולדות ובעכברים; מעל ל-10 גרם לכל ק"ג משקל(45,47).
תגובות הדדיות עם תרופות / צמחי מרפא / תוספי תזונה
השפעה על חילוף חומרים תרופתי
בשנים האחרונות כורכום הוא אחד הצמחים הנחקרים ביותר, ונעשו מחקרים קליניים רבים המשלבים כורכום עם תרופות שונות, ללא דיווח על פגיעה בריכוז התרופות בדם או ביעילותן.
להלן פירוט האנזימים והמחקרים הקליניים אשר מצאו השפעה של כורכום עליהם:
יש לציין כי מחקרים קליניים אחרים לא מצאו כל השפעה על CYP2C9(51), CYP3A4/5(51,106), SUL(51) ו- UGT(51).
CYP1A2
כורכום עשוי לעכב את פעילות האנזים CYP1A2.
במחקר פרמקוקינטי קליני(52) שנערך בקרב 16 גברים בריאים המשתמשים במטבוליטים של קפאין כתרופות בדיקה, נמצא כי כורכומין במינון של 1 גרם ליום למשך 14 ימים עיכב באופן משמעותי את פעילות CYP1A2 ב-28.6% (p<0.000).
סקירה(66) מדווחת על מחקר בחולדות(99) שבו נטילה משולבת של 100 מ"ג/לק"ג כורכומין עם התרופה קומדין (אשר עוברת חילוף חומרים באמצעות(CYP1A2 או נטילה של כורכומין לבד לתקופה של שבעה ימים הגבירה באופן משמעותי את ריכוז התרופה (AUC) פי 1.6 ועיכבה את הפרשתה מהגוף בכ-57%. עם זאת, במינונים נמוכים יותר של כורכומין (25 ו-50 מ"ג/לק"ג), לא נצפה שינוי משמעותי בריכוז התרופה בדם.
מחקרי מעבדה(57,64) הראו עיכוב מתון של פעילות CYP1A2. עם זאת, הרלוונטיות הקלינית של ממצאים אלה אינה ברורה.
CYP2A6
כורכום עשוי להגביר את פעילות האנזים CYP2A6.
במחקר פרמקוקינטי קליני(52) שנערך בקרב 16 גברים בריאים אשר השתמשו במטבוליטים של קפאין כתרופת בדיקה, נמצא כי כורכומין במינון של 1 גרם ליום למשך 14 ימים הגביר באופן משמעותי את פעילות CYP2A6 ב-48.9% (p<0.000).
CYP2D6
כורכום וכורכומין עשוים לעכב את פעילות האנזים CYP2D6.
מחקר קליני(50) שנערך על שישה נבדקים בריאים מצא כי נטילת אבקת כורכום במינון של 3 גרם ליום למשך שבעה ימים עיכבה באופן משמעותי את פעילות CYP2D6 ואת חילוף החומרים של דקסטרומתורפן (Dextromethorphan) באמצעות אנזים זה (p<0.005), שהוביל להפחתה של 70% בכמות הדקסטרופאן (dextrorphan-מטבוליט של התרופה).
במחקר קליני אחר(576) שבדק חולות סרטן שד, מתן של 1200 מ"ג 3 פעמים ביום של כורכומין ± פיפרין (10 מ"ג 3 פעמים ביום) במקביל לנטילת טמוקסיפן (תרופה אשר עוברת חילוף חומרים בעיקר על ידי CYP2D6), נטילת הכורכומין גרמה לירידה משמעותית של 7.7% (p=0.07) בריכוז האנדוקסיפן (המטבוליט הפעיל של טמוקסיפן) וירידה של 12.4% (p=0.02) בנטילה של הכורכומין והפיפרין יחדיו, מכך ניתן להסיק על פעילות מעכבת על האנזים CYP2D6.
בנוסף, במחקר על עכברים(123-124), נטילה חד פעמית של כורכומין בשילוב עם התרופה פלוקסטין (שעוברת חילוף החומרים באמצעות האנזים CYP2D6) שיפרה את ההשפעה האנטי דיכאונית של התרופה מבלי להשפיע על ריכוזה בסרום ובמוח.
סקירה(62) ומחקרי מעבדה(57,64) הראו עיכוב מתון לאחר נטילת כורכום וכורכומין על פעילות CYP2D6.
עם זאת, הרלוונטיות הקלינית של ממצאים אלה אינה ברורה.
P-gp
כורכום עשוי להגביר את פעילות האנזים P-gp.
במחקר קליני(104) שנערך על 12 מתנדבים בריאים, מתן 300 מ"ג כורכום מדי יום במשך שישה ימים הפחית את הזמינות הביולוגית של מנה אחת של התרופה טלינולול (talinolol) (substrate of CYP2D6, P-gp and MRP2) בכ-30% (p<0.05) והגדיל את פינויו פי 1.5 (p<0.05), כנראה באמצעות המרצת פעילות P-gp.
עם זאת, במחקר קליני אקראי, כפול סמיות, מבוקר(106) שנערך בקרב 10 נבדקים בריאים, מתן מנה אחת של כורכום (סטנדרטי המכיל 480 מ"ג כורכומינואידים) בשילוב עם ניפדיפין (nifedipine) (העובר חילוף חומרים באמצעות CYP3A4 ו-P-gp) לא השפיע באופן משמעותי על ריכוז התרופות בדם.
בסקירה(66) החוקרים הגיעו למסקנה כי לא ניתן להסיק מסקנה חותכת בנוגע לבטיחות של נטילה משולבת, בשל גודל המדגם הקטן והמינון היחיד שנבדק. על פי סקירות(66,151-152) המדווחות על מחקרי בעלי חיים(56,99,107,142,153,185,187,217,543) ומחקרי מעבדה(54,58,60) כורכום וכורכומין הדגימו פעילות מעכבת על אנזים P-gp במעי אשר הובילה לעלייה בריכוז התרופות בדם ולהגברת הזמינות הביולוגית של תרופות שונות in vivo או להגברת הספיגה התאית והפחתת עמידות התרופות in-vitro.
יש לציין כי במחקר מעבדה(55) נטילת כורכום הגבירה את פעילות ה-P-gp על ידי הגברת ויסות ביטוי חלבון P-gp ורמות ה-mDR1 mRNA, אך הכורכומין עיכב את פעילות ה-P-gp בירידה ברמות ביטוי mRNA של חלבון P-gp ו-MDR1.
עם זאת, הרלוונטיות הקלינית של ממצאים אלה אינה ברורה.
OATP-B
כורכום עשוי לעכב את פעילות האנזים OATP2B1.
סקירה(67) מדווחת על מחקר קליני(68) שנערך בקרב שמונה נבדקים בריאים, בהם הודגם כי כורכומין מעלה את רמות הסולפזאלאזין (sulfasalazine, ממשפחת 5-ASA) בדם (השטח מתחת לעקומה הפרמקוקינטית גדל פי 3.2) על ידי עיכוב פעילות OATP2B1 במעיים. ABCC2 כורכום עשוי להגביר את פעילות האנזים MRP2. במחקר קליני(104) שנערך על 12 מתנדבים בריאים, מתן 300 מ"ג כורכום מדי יום במשך שישה ימים הפחית את הזמינות הביולוגית של מנה אחת של התרופה טלינולול (talinolol) (substrate of CYP2D6, P-gp and MRP2) בכ-30% (p<0.05) והגדיל את פינויו פי 1.5 (p<0.05), כנראה באמצעות המרצת פעילות MRP2.
במחקר מעבדה(69) נצפתה השפעה מעכבת של כורכומין על פעילות MRP2 בתאים סרטניים. השפעה כזו עשויה להפחית את עמידות התאים הסרטניים לתרופות כימותרפיות.
עם זאת, הרלוונטיות הקלינית של ממצא זה אינה ברורה.
ABCC2
כורכום עשוי להגביר את פעילות האנזים MRP2.
במחקר קליני(104) שנערך על 12 מתנדבים בריאים, מתן 300 מ"ג כורכום מדי יום במשך שישה ימים הפחית את הזמינות הביולוגית של מנה אחת של התרופה טלינולול (talinolol) (substrate of CYP2D6, P-gp and MRP2) בכ-30% (p<0.05) והגדיל את פינויו פי 1.5 (p<0.05), כנראה באמצעות המרצת פעילות MRP2.
במחקר מעבדה(69) נצפתה השפעה מעכבת של כורכומין על פעילות MRP2 בתאים סרטניים. השפעה כזו עשויה להפחית את עמידות התאים הסרטניים לתרופות כימותרפיות. עם זאת, הרלוונטיות הקלינית של ממצא זה אינה ברורה.
השְפעת פיפרין על חילוף חומרים תרופתי
פיפרין, כאשר ניטל לבדו במינון של 20 מ"ג, מגביר ספיגה של תרופות מסויימות(70).
במספר מחקרים קליניים(71-75) בהם נבדקה השפּעת 20 מ"ג פיפרין (לבד) על ריכוז תרופות בדם, נמצא בכולם כי אכן פיפרין הגביר את ריכוז התרופה בדם ואת זמן מחצית החיים.
לעומת זאת, במחקר קליני יחיד, שילוב של פיפרין (24 מ"ג) עם כורכומין (4 גרם) לא הביא לתוצאות דומות.
במחקר(51) זה לא נמצאה השפעה מהותית על רמת התרופות בדם או על זמן מחצית החיים.
חשוב גם לזכור כי בעוד שבמחקרים אשר הראו השפעה של פיפרין על חילוף חומרים תרופתי נעשה שימוש במינון של 20 מ"ג, בתוספי הכורכום הנפוצים מינון הפיפרין עומד על 5 מ"ג בלבד. כמו כן, פלפל שחור(76) זכה לסטטוס בטיחות גבוה (GRAS - Generally recognised as safe) על-ידי ה-FDA.
ליתר ביטחון, במידה ונדרש שילוב בין כורכום ופיפרין לבין תרופות נוספות, רצוי להפריד בין זמני הנטילה (שעתיים הפרש).
תרופות נוגדות דלקת
ניתן ואף מומלץ לשלב כורכום יחד עם תרופות אלו.
בסקירות שיטתיות(289,292,293,594-599) ובמחקרים קליניים מרובים כורכום הודגם כבעל השפעה נוגדת דלקת בטיפול במחלות דלקתיות שונות כגון דלקת מפרקים שגרונית, דלקת מפרקים ניוונית, קרוהן וקוליטיס. מחקרים קליניים מראים כי נטילה משולבת של כורכום יחד עם מגוון תרופות נוגדות דלקתיות עשויה להוביל לשיפור הסימפטומים ולהפחתת מינון התרופות במחלות שונות ביניהן: מחלות מעי דלקתיות(79,77,78,318,564,149,287), נטילה של כורכום יחד עם sulfasalazine, prednisone, azathioprine, budesonide ו-mesalamine בדלקת מפרקים ניוונית(80,81,86,303), נטילה של כורכום יחד עם NSAIDs (diclofenac), ואצטמינופן, בדלקת מפרקים שגרונית(83), נטילה של כורכום(82) יחד עם diclofenac בדלקת ענביה קדמית כרונית (Chronic anterior uveitis), ונטילה של כורכום במשלב עם פוספטידילכולין (phosphatidylcholine).
יש לציין כי מחקר קליני קטן אחד(68) מצא שכורכומין הגביר את רמות הסולפזאלאזין (sulfasalazine, ממשפחת 5-ASA) בדם (השטח מתחת לעקומה הפרמקוקינטית גדל פי 3.2) על ידי עיכוב אנזים OATP2B1 במעיים. מחקרים בבעלי חיים מראים עלייה בהשפעה משככת הכאבים במשלב הכורכום(85,87) יחד עם diclofenac, מניעת רעילות כבד(88) הנגרמת על ידי diclofenac, מניעת סטרס חמצוני המושרה על ידי אצטמינופן ומוות של אבוביות בכליות בעקבות רעילות תרופתית(90), ופעילות סינרגטית(89) עם אספירין ורופקוקסיב (rofecoxib).
בנוסף, מחקר מעבדה(91), מצא כי אצטמינופן, אספירין ואיבופרופן ייצבו את הכורכומין והגדילו את מחצית החיים והפעילות הציטוטוקסית שלו.
פירוט המחקרים:
במחקר קליני ישראלי(79), כפול-סמיות ומבוקר פלסבו, השתתפו 50 חולי קוליטיס במצב קל עד בינוני אשר נטלו טיפול תרופתי אנטי-דלקתי (Mesalamine) , שהיה מוגבל ביעילותו. בנוסף לטיפול התרופתי, מחצית מהמשתתפים נטלו כמוסות כורכומין במינון של 3 גרם ליום, או מינון זהה של פלסבו, למשך חודש. מהתוצאות עולה כי לאחר חודש, אף אחד מהחולים בקבוצת הפלסבו לא הגיע לרמיסיה קלינית או אנדוסקופית ורק בקרב 13% חלה הקלה בתסמינים. לעומת זאת, 54% מהחולים בקבוצת הכורכומין הגיעו לרמיסיה קלינית (38% רמיסיה אנדוסקופית) ובקרב 65% נצפתה הקלה בתסמינים. תופעות הלוואי היו זניחות ודומות בשתי קבוצות המחקר.
במחקר קליני(77) בקרב קבוצות מצומצמות של חולי קרוהן וחולי דלקת חלחולת כיבית (ulcerative proctitis) שטופלו בתרופות נוגדות דלקת קונבנציונאליות (5-asa, sulfasalazine, prednisone, azathioprine) אוBudesonide , ניתן במקביל כורכומין במינון 1080-1650 מ"ג ליום, במשך 2-3 חודשים. כל המטופלים חוו הטבה במצבם, חלקם הפחיתו ממינוני התרופות נוגדות הדלקת וחלקם אף הפסיקו את השימוש בהן.
במחקר נוסף(78) על קבוצה של 43 חולי קוליטיס שטופלו בתרופות Sulfasalazine אוMesalamine הודגמה הטבה משמעותית בנטילה פומית של 2 גרם כורכומין ביום למשך שישה חודשים. שיעור ההתקפים בקבוצה זו עמד על 4.65% לעומת 20.51% בקבוצת הביקורת, שנטלה תרופות קונבנציונאליות בלבד.
מחקרים קליניים מבוקרים נוספים(80-81) נערכו על נטילת כורכומין יחד עם פוספטדילכוֹלין בקרב חולי דלקת מפרקים ניוונית (OA) שנטלו NSAID's או Acetaminophen במקביל למשך 3-8 חודשים. נצפו שיפורים משמעותיים בתסמיני המחלה ובתוצאות הבדיקות. המשלב הביא להפחתה משמעותית בצריכת התרופות (הפחתה של 63% בנטילת NSAID's בהשוואה ל-12% בקבוצת הביקורת) ולהפחתה בתופעות הלוואי של התרופות.
מחקר קליני אקראי חד-סמיות ומבוקר פלסבו(303) בחן את יעילות ובטיחות הנגזרת הפוליסכרידית שמוצתה מצמח הכורכום (™Turmacin) לטיפול בכאבים הנובעים מדלקת מפרקים ניוונית בברכיים. 120 נבדקים (בני 40 ומעלה) הסובלים מ-OA למשך תקופה של חצי שנה לפחות חולקו אקראית לקבלת פלסבו במינון 800 מ"ג ליום, תמצית תקנית של כורכום (מתוקננת להכיל %12.6 פוליסכרידים) במינון 1000 מ"ג ליום, או גלוקוזאמִין סולפט במינון 1500 מ"ג ליום, לבד או בשילוב עם מיצוי הכורכום, כל זאת למשך 42 יום. המחקר הראה כי השימוש בכורכום הראה הפחתה מובהקת ברמות הכאב ממנו סבלו המטופלים (p<0.05).
במחקר אחר(83), 45 חולי דלקת מפרקים שגרונית (RA) נטלו 500 מ"ג כורכומין, 50 מ"ג מהתרופה Diclofenac או משלב של השניים, למשך 8 שבועות; בקבוצה שנטלה משלב של כורכומין והתרופה נצפה השיפור הגדול ביותר, ואילו בקבוצה שנטלה את התרופה בלבד נצפו יותר תופעות לוואי תרופתיות.
מחקר נוסף(82) שנערך בקרב 106 חולים מצא כי נטילת 240 מ"ג כורכומין ליום במשך 12-18 חודשים יחד עם פוספטדיל-כולין, לצד טיפול קונבנציונאלי בדלקת ענביה קדמית כרונית (chronic anterior uveitis), הביאה לירידה משמעותית במספר אירועי הדלקת, מ-275 בשנה שעברה (ללא כורכומין) ל-36 בלבד בשילוב הכורכומין.
במחקר קליני(68) שנערך על שמונה נבדקים בריאים, שבו כורכומין העלה את רמות התרופה Sulphasalazine (ממשפחת 5-ASA) בסרום (הגדיל את השטח מתחת לעקומה הפרמקוקינטית של התרופה פי 3.2) על ידי עיכוב נשאי OATP2B1 במעי.
מחקרים שנערכו בחולדות שהושרה בהן כאב(85,87), כורכומין שניתן במינון כורכומין של 25, 50, 100, 200, 400 ו -600 מ"ג/ק"ג הניתן אל תוך חלל הצפק (פריטניאום) הוביל לתגובה משככת כאבים תלויית-מינון והמינון 25 מ"ג/ק"ג משקל גוף בשילוב עם Diclofenac הגביר את ההשפעה משככת הכאב של התרופה.
כמו כן, במחקר נוסף שנערך בחולדות(88), כורכום שניתן במינון 1 גרם לק"ג משקל גוף במשך 30 ימים לפני מתן מינון גבוה של Diclofenac מנע את הרעילות הכבדית של התרופה.
במחקר שנערך בעכברים(90), מתן תמצית כורכום במינון 400-1000 מ"ג/ק"ג משקל גוף בשילוב עם Acetaminophen , מנע עקה חמצונית ומוות של תאי אבובית הכליה בעקבות רעילות התרופה ושיפר את המדדים ההיסטולוגיים והתפקודיים של הכליות.
במחקר שנערך בחולדות(89) שהושרתה בהן דלקת המחקה דלקת תת כרונית במבוגרים, 240 מ"ג/ק"ג של כורכומין הוזרקו תוך אל חלל הצפק (פריטנאום) והראו פעילות אנטי דלקתית משמעותית. מינון תת קליני של 12 מ"ג/ק"ג במקביל למינון תת קליני של אספירין (80 מ"ג/ק"ג) או רופקוקסיב (2.5 מ"ג/ק"ג) הראה אפקט סינרגיסטי של כורכומין עם כל תרופה, וגרם לירידה נוספת ברמות TNF-alpha. החוקרים קובעים כי כורכומין יכול להיות שימושי כטיפול משלים לתרופות אנטי דלקתיות סטנדרטיות.
קיימת אזהרה (סלואן קטרינג) לגבי שילוב כורכום עם תרופה זו. אזהרה זו מבוססת על מחקר מעבדה(91) שנערך על שורות תאי מעי גס בריאים וסרטניים, לפיו היציבות הכימית של הכורכום, ספיגתו בתאים וההשפעה הציטוטוקסית שלו על כל סוגי התאים מתעצמת בנוכחות אצטמינופן. יש לציין כי במחקר המצוטט הממצאים ביחס לשילוב כורכום עם אצטמינופן תקפים גם לגבי שילוב כורכום עם אספירין ועם איבופרופן. אך כפי שראינו לגבי כל אחת מהתרופות, אין עדויות קליניות להשפעה ציטוטוקסית של שילובן עם כורכום.
אקמול (אצטמינופן)
אין מניעה לשלב כורכום עם תרופה זו. לכורכום פעילות נוגדת דלקת אשר עשויה להגביר את ההשפעה התרופתית לצד צמצום תופעות הלוואי.
סקירה(66) מדווחת על מחקר קליני אקראי מבוקר(51) שנערך על 8 נבדקים בריאים וכלל נטילת 8 גרם תמצית כורכומינואידים תקנית עם פיפרין ביום בו לא נצפתה תגובה הדדית על חילוף החומרים של תרופות (Midazolam, Paracetamol ו-Flurbiprofen) העוברות פירוק דרך אנזימי CYP3A ו-CYP2C9 בשימוש קצר-מועד (יומיים). במחקר לא נצפו שינויים משמעותיים בריכוז התרופות בדם, פינוי, זמן מחצית חיים או רמות מטבוליטים של התרופות, לעומת נטילת פלסבו.
מחקרים קליניים מבוקרים נוספים נערכו על נטילת כורכומין יחד עם פוספטדילכוֹלין בקרב חולי דלקת מפרקים ניוונית (OA) שנטלו NSAID's או Acetaminophen במקביל במשך 3-8 חודשים. נצפו שיפורים משמעותיים בתסמיני המחלה ובתוצאות הבדיקות. המשלב הביא להפחתה משמעותית בצריכת התרופות (הפחתה של 63% בנטילת NSAID's בהשוואה ל-12% בקבוצת הביקורת) ולהפחתה בתופעות הלוואי של התרופות(80-81).
כמו כן, במחקר שנערך בעכברים(90), מתן תמצית כורכום במינון 400-1000 מ"ג/ק"ג משקל גוף בשילוב עם Acetaminophen, מנע עקה חמצונית ומוות של תאי אבובית הכליה בעקבות רעילות התרופה ושיפר את המדדים ההיסטולוגיים והתפקודיים של הכליות.
קיימת אזהרה (סלואן קטרינג) לגבי שילוב כורכום עם תרופה זו. אזהרה זו מבוססת על מחקר מעבדה(91) שנערך על שורות תאי מעי גס בריאים וסרטניים, לפיו היציבות הכימית של הכורכום, ספיגתו בתאים וההשפעה הציטוטוקסית שלו על כל סוגי התאים מתעצמת בנוכחות אצטמינופן.
יש לציין כי במחקר המצוטט הממצאים ביחס לשילוב כורכום עם אצטמינופן תקפים גם לגבי שילוב כורכום עם אספירין ועם איבופרופן. אך כפי שראינו לגבי כל אחת מהתרופות, אין עדויות קליניות להשפעה ציטוטוקסית של שילובן עם כורכום.
תרופות נוגדות קרישה ונוגדות צימות טסיות
יש לנקוט בזהירות במשלב כורכום יחד עם תרופות מסוג זה.
במקרה של נטילה משולבת, יש לנטר אחר מדדי קרישת הדם. מומלץ להימנע משימוש במינונים גבוהים של כורכום (יותר מ-15 גרם מדי יום) בעת הטיפול במקביל, ולהפסיק את הנטילה כשבוע לפני ניתוח.
ההשפעה המעכבת של כורכומין על מדדי הקרישה וצימות הטסיות הודגמה(21-25,94-97) במחקרי מעבדה ומבחנה.
במחקר קליני(544), נטילה משולבת של כורכומין ®Meriva עם תרופות מעכבות צימות טסיות או נוגדות קרישה במשך 10 ימים לא גרמה לשינוי משמעותי בזמן הדימום או בערכי INR. עם זאת, ישנם שני תיאורי מקרה בהם נטילה משולבת של כורכומין יחד עם clopidogrel (קלופידוגרל)(98) או Fluindione (פלוינדיון)(93),הובילה לדימום במערכת העיכול ולעלייה ברמות INR בהתאמה.
סקירה(66) מדווחת על מחקר בחולדות(99) בו טיפול משותף של כורכומין עם קומדין וכורכומין עם קלופידוגרל השפיע השפעה פרמקוקינטית והעלה באופן משמעותי את רמות הדם של התרופות ועיכב את הפרשתן, אך באופן פרמקודינמי לא השפיע על הפעולה נוגדת הקרישה של התרופות.
פירוט המחקרים:
מחקר קליני(544), בדק את האינטראקציה בין כורכום לתרופות מעכבות צימות טסיות או נוגדות קרישה. החוקרים מדדו את זמן הדימום (BT) בחולים שנטלו לפחות שנתיים אחת מהתרופות הבאות: חומצה אצטילסליצילית (acetylsalicylic acid, שמונה עשר חולים), טיקלופידין (ticlopidine, שישה עשר חולים), קלופידוגרל (clopidogrel, עשרה חולים). כמו כן נבדקה רמת ה-INR בקרב מטופלים אשר השתמשו בקומדין (warfarin, ארבעה עשר חולים) או דביגטרן (dabigatran ,שישה עשר חולים) עבור פקקת ורידים קודמת. שתי הבדיקות בוצעו לפני ואחרי 10 ימי של נטילת 1 גרם ליום של כורכומין ®Meriva (המקביל ל-200 מ"ג כורכומין ליום). נטילה משולבת לא גרמה לשינוי משמעותי בזמן הדימום או בערכי ה-INR. מסקנת החוקרים הייתה שכורכומין אינו משפיע על פעילות מעכבת הטסיות של התרופות הנפוצות ביותר לעיכוב צימות טסיות.
במחקר חתך(98) שנערך בקרב 947 נבדקים המאושפזים ב-12 מחלקות בבית חולים בני ציון בחיפה בין השנים 2009-2014 נצפה מקרה יחיד של אינטראקציה שלילית בין תוסף כורכום ובין התרופה (clopidogrel (Plavix שגרם לדימום במערכת העיכול. הסיבה המשוערת היא עיכוב צימות טסיות על ידי כורכום שהתווסף לפעילות התרופה.
ישנו דיווח(93) בנוגע למקרה אחד של נטילה משולבת של כורכום עם התרופהFluindione (אנטיגוניסטית לויטמין K שאינה שייכת למשפחת הקומרינים) בו נצפתה עלייה בערכי INR. (סוג התמצית הניתנת, המינון, ופרטים אחרים של המקרה אינם ידועים לנו).
סקירה(66) מדווחת על מחקר שנערך בחולדות(99) ובו מתן משולב של כורכומין במינון 100 מ"ג/ק"ג משקל גוף וקומדין (העוברת חילוף חומרים דרך CYP2C9, CYP1A1, CYP1A2 ו-CYP3A4) במשך שבעה ימים העלה במובהק את ריכוז התרופה בדם (עליה פי 1.6 בשטח העקומה הפרמקוקינטית (p<0.05) ועיכב את פינויה ב-57.14% (p<0.05). עם זאת לא חל שינוי בפעילות נוגדת הקרישה של התרופה. באותו מחקר, שילוב של כורכומין באותו מינון והתרופה clopidogrel (העוברת חילוף חומרים דרך CYP2C19 ו-P-gp) במשך שבעה ימים העלה במובהק את ריכוז התרופה בדם (עליה פי 1.81 בשטח העקומה הפרמקוקינטית, p<0.05) ועיכב את פינויה ב-58.33% (p<0.05) במינונים נמוכים יותר של כורכומין (25 ו-50 מ"ג/ק"ג משקל גוף) לא נצפה שינוי מובהק בריכוזי התרופות בדם.
תרופות להורדת סוכר
נטילה פומית של כורכום יחד עם תרופות מסוג זה אפשרית ואף מומלצת.
הראיות על השְפעתו של כורכום על רמות הסוכר בדם מעורבות. שתי סקירות(548,551) ו-8 מחקרים קליניים(549,550,552,553,554,555,556) הראו כי מתן תמציות שונות של כורכומין הפחית משמעותית את רמת הסוכר בדם ו/או רמות הסוכר שעתיים לאחר ארוחה (postprandial glucose) ו/או רמת HbA1C בחולים עם סוכרת. תוצאות דומות נמצאו גם במחקרים עם בעלי חיים סוּכרתיים(557-558).
עם זאת, במחקרים קליניים אחרים(545,546,547,105) כורכום לא השפיע על רמות הסוכר בדם בחולי סוכרת.
שני מחקרים קליניים(559,554) בדקו נטילה משולבת של כורוכום יחד עם תרופות נוגדות סוכרת (Glyburide ו-Glibenclamide) ומצאו כי השילוב בטוח וסינרגטי (מעניק שליטה גליקמית טובה יותר, מפחית את רמות הסוכר בדם ואת רמות ה-HbA1C). בנוסף, מחקר בבעלי חיים(560) הראה כי כורכומין הינו סינרגטי עם התרופה מטפורמין בסיוע ובמניעת התפתחות קרדיומיופתיה סוּכרתית. כורכום וכורכומין נמצאו גם יעילים במניעת סוכרת בקרב נבדקים טרום סוּכרתיים על ידי הגדלת הפרשת אינסולין מתאי הלבלב, הפחתת עמידות לאינסולין והעלאת רמת האדיפונקטין (14,363,561).
יתר על כן, סקירה(100) הראתה כי טיפול בכורכום עשוי לסייע במניעת סיבוכים משניים של מחלת הסכרת: נוירופתיה סוּכרתית, כבד שומני, השמנת יתר, נפרופתיה ומחלות כלי דם.
מחקרים קליניים מצאו כי כורכום לבד או בשילוב עם צמחי מרפא אחרים יעיל בהפחתת סיבוכי סוכרת כולל נוירופתיה סוּכרתית(556,105), נפרופתיה(105), כבד שומני(562), מחלות כלי דם קטנים(101) וטרשת עורקים(364). יתרונות אלה מיוחסים לפעילות האנטי דלקתית והנוגדת חמצון של הצמח(362).
לפירוט המחקרים:
במחקר מבוקר אקראי כפול סמיות(549) אשר כלל 100 חולי סוכרת מסוג 2 בגילאי 18-65, נטילה של 500 מ"ג ליום של כורכומינואידים ו-5 מ"ג פיפרין ליום למשך 3 חודשים, הפחיתה באופן משמעותי את רמות הסוכר בדם (-9 ± 16 מ"ג/דצ"ל לעומת -3 ± 11 בקבוצת הפלסבו, p=0.048) כמו כן, הנטילה הפחיתה את רמות C-peptide (-0.6 ± 0.8 ng/mL לעומת 0.02 ± 0.6, p<0.001) ואת רמות ה-HbA1c (המוגלובין מסוכרר) (ng/mL -0.9% ± 1.1 לעומת −0.2 ± 0.5%, p<0.001).
במחקר קליני(550) בקרב 100 חולי סוכרת מסוג 2 שמנים, נטילת 300 מ"ג ליום של כורכומינואידים הפחיתה באופן משמעותי את רמת הסוכר בדם בצום (p<0.01), רמות המוגלובין מסוכרר, HgbA1C (במובהקות p=0.031) ורמות HOMA-IR (במובהקות p<0.01). כמו כן נצפתה הפחתה משמעותית ברמות חומצות השומן החופשיות FFAs וטריגליצרידים. מסקנת החוקרים הייתה שההשפעות ההיפוגליקמיות של התמצית נובעות לפחות באופן חלקי מניצול חומצות השומן.
במחקר אקראי מבוקר כפול סמיות(552) אשר כלל 53 חולי סוכרת מסוג 2, נטילה של 500 מ"ג כורכומין (שהוכן באופן מסחרי על ידי חברת ארג'ונה, כאשר כל כמוסה הכילה 440 מ"ג כורכומינואידים וכללה 347 מ"ג כורכומין, 84 מ"ג דסתמתוקסיקורקומין, 9 מ"ג ביס-דסמטוקסיכורכום ו-38 מ"ג שמן כורכום) 3 פעמים ביום במשך 10 שבועות הובילה לירידה משמעותית ברמת הסוכר בדם בצום (-7 ± 2 מול 3 ± 0.2,p<0.05 ) ובמשקל הגוף הממוצע (p=0.01), אך לא הייתה השפעה על מדדי ה-HbA1C, אינסולין, MDA, רמות HOMA-IR, רמות HOMA-B, ועקה חמצונית.
במחקר קליני אקראי כפול סמיות(553) אשר כלל 32 חולי סוכרת סוג 2 ודיסליפידמיה (בגילאי 35-70 שנים) נבדק מתן 200 מ"ג של תמצית אתנולית של כורכום ו-200 מ"ג תמצית מימית של שום לכל כמוסה למשך 3 חודשים. המינונים שניתנו היו 1.2 גרם, 1.6 גרם ו-2.4 גרם. הנטילה הפחיתה את רמות הסוכר בדם בצום בכל הקבוצות אך לא נראתה משמעות סטטיסטית. הקבוצה שטופלה במינון הגבוה ביותר (2.4 גרם) הראתה ירידה משמעותית ברמת הסוכר בדם שעתיים לאחר הארוחה ב-22.68% (p=0.032) ,ברמות ה-HbA1C (במובהקות p=0.025) וברמות השומנים. בין 3 המינונים, המינון של 2.4 גרם הוביל גם לירידה ברמת הגלוקוז בצום, רמת גלוקוז שעתיים לאחר הארוחה, רמת HbA1C, כולסטרול כללי, ליפופרוטאין בצפיפות נמוכה, טריגליצרידים ומדד מסת הגוף, במידה משמעותית יותר משני המינונים האחרים. בנוסף, רמת מינון זו הגדילה את הליפופרוטאין בצפיפות גבוהה יותר משני המינונים האחרים. במהלך המחקר לא נצפו תופעת לוואי משמעותית, והטיפול לא הראה שינויים לרעה על תפקודי הכליות והכבד וכן על הרכב הדם של כל הנבדקים.
במחקר קליני אקראי כפול סמיות(555) שכלל חולי סוכרת מסוג 2, נמצא כי מתן כורכומין ננו-מיצל (Nanomicelle) (ננו-כורכומין; 80 מ"ג ליום) למשך 3 חודשים הפחית באופן משמעותי את רמת הסוכר בדם בצום, רמת HbA1c, רמת טריגליצרידים ורמת LDL. ניתן להסיק מכך שמתן ננו-כורכומין לחולי סוכרת מסוג 2 עשוי לשפר את מאזן הסוכר ואת פרופיל השומנים.
במחקר אקראי כפול סמיות אקראי(556) שכלל 80 חולי סוכרת, נמצא כי מתן 80 מ"ג ננו-כורכומין למשך 8 שבועות הפחית באופן משמעותי את רמת הסוכר בדם בצום (p=0.04) ורמת HbA1C (במובהקות p<0.001) כמו כן נצפתה הפחתה משמעותית בציון הנוירופתיה (p<0.001) וציון הרפלקס הכולל (p=0.04).
במחקר קליני אקראי כפול סמיות(545) שכלל 80 חולי סוכרת סוג 2 והיפרליפידמיה נמצא כי נטילה של 2100 מ"ג אבקת שורש כורכום ליום במשך 8 שבועות הובילה לירידה משמעותית במשקל הגוף, במדדי הטריגליצרידים וה-LDL (במובהקות p<0.05). לטיפול לא הייתה השפעה משמעותית על המצב הגליקמי, על רמת ה-hs-CRP ועל יכולת נוגדת החמצון הכוללת בחולים אלה.
במחקר אקראי(546), כפול סמיות ומבוקר פלסבו, 64 חולי סוכרת מסוג 2 קיבלו פלסבו או 2 כמוסות של 500 מ"ג כורכומין (®Meriva, במינון של 180 מ"ג כורכומין) פעמיים ביום, או 2 כמוסות של 1000 מ"ג שמן דגים (המכיל 1.2 גרם EPA + DHA) פעמיים ביום, או שילוב של כורכומין ושמן דגים למשך 12 שבועות. לא נראה שינוי ברמות הסוכר בדם בצום או ברמת HbA1C בכל הקבוצות, אולם הרגישות לאינסולין השתפרה באופן משמעותי בקבוצת הכורכומין, וכל קבוצות הטיפול הדגימו ירידה במדד הטריגליצרידים. מסקנת החוקרים הייתה שלכורכומין, או לשילוב של כורכומין וחומצות שומן אומגה 3 אין השפעה על השליטה הגליקמית, אך הם יכולים להוריד את הסיכון לפתח סוכרת מסוג 2.
במחקר אקראי כפול סמיות,מבוקר פלסבו(547) שכלל חולי סוכרת עם טרום סוכרת מבוקרת, נמצא כי מתן של 3.79 גרם Jiangtang Xiaozh המכיל 13% כורכומין, 3 פעמים ביום למשך 16 שבועות, הפחית באופן משמעותי את רמת האינסולין בדם כמו גם את מדד ה-HOMA-IR. בעקבות כך נצפתה ירידה בעמידות לאינסולין ועליה ברמת ה-HDL. עם זאת, הטיפול לא השפיע על רמות הסוכר.
במחקר בקרה אקראי(559) אשר כלל 8 חולים שטופלו בגליבוריד (Glyburide), מתן של 475 מ"ג ליום כורכומין למשך 10 ימים במקביל לתרופה הוביל לירידה ברמות הסוכר מבלי שאף לא מטופל אחד חווה היפוגליקמיה. כמו כן נראתה ירידה משמעותית במדדי LDL, VLDL והטריגליצרידים. מסקנת החוקרים הייתה שלנטילה משולבת של כורכומין עם גליבוריד יש פוטנציאל לספק שליטה גליקמית טובה יותר.
במחקר מבוקר אקראי כפול סמיות(554) אשר כלל 35 חולי סוכרת מסוג 2, מתן משולב של 200 מ"ג כורכום ותמצית שום 200 מ"ג 2 כמוסות 3 פעמים ביום למשך 14 שבועות, במקביל ל-5 מ"ג גליבנקלאמיד (Glibenclamide), הפחית באופן משמעותי את רמת הסוכר בצום בצום (192.76 עד 141.71 מ"ג/ד"ל), רמות הסוכר שעתיים לאחר ארוחה (295.35 עד 204.35 מ"ג/ד"ל) ואת מדד ה-HbA1C (מ-10.41 ל-8.09). כמו כן, הטיפול הפחית את מדדי הכולסטרול הכולל, LDL וטריגליצרידים והגביר את מדד ה-HDL.
מחקר קליני כפול-סמיות מצומצם(363), בדק האם לכורכום וקינמון השפעה על התפקוד הקוגניטיבי בקרב משתתפים במצב טרום סוכרת שאינם מקבלים טיפול תרופתי. 48 משתתפים בגילאי 60 ומעלה שאובחנו זה לא מכבר בטרום סוכרת (BMI=18.5-30, סוכר בצום 100-125) חולקו באופן אקראי לאחר צום לילה לקבלת פלסבו, 1 גרם כורכום, 2 גרם קינמון או כורכום+קינמון. התפקוד הקוגניטיבי של הנבדקים נבדק לפני הנטילה ושש שעות אחריה. בעקבות נטילת התוספים לא נצפו שינויים מובהקים ברמות הגלוקוז והאינסולין בדמם של הנבדקים לאחר הארוחה. החוקרים מצאו כי תוספת הכורכום הובילה לשיפור זיכרון העבודה (p=0.05), וכן לשיפור העמידות לאינסולין (p<0.01). אך לא לשינוי במרקרים של מחלת האלצהיימר (APP, PS1, PS2, GSK-3β). לא נצפתה תרומה מובהקת של קינמון לשינוי המדדים.
במחקר אקראי כפול סמיות מקביל מבוקר פלסבו(561), שכלל מטופלים עם רמות גבוהות של סוכר בדם בצום, מתן תוסף משולב המכיל כורכום (125 מ"ג), תמצית Lagerstroemia speciose (250 מ"ג), תמצית Arberate Berberis (155 מ"ג), חומצה אלפא-ליפואית (110 מ"ג), כרום פיקולינט (1.3 מ"ג) וחומצה פולית (0.15 מ"ג), פעמיים ביום במשך 8 שבועות, הדגים נטייה להפחתת רמות הסוכר בדם וירידה משמעותית ברמות האינסולין בדם בצום, כמו גם ירידה במדד ה-HOMA-IR המצביע על ירידה בעמידות לאינסולין. בנוסף, התוסף הפחית משמעותית את הטריגליצרידים בדם והגביר את רמות ה-HDL. הממצאים מראים כי מתן כורכומין לחולי סוכרת עשוי לסייע בהפחתת סיבוכים קרדיווסקולריים וסיבוכי סוכרת אחרים.
במחקר קליני מבוקר(101) בחן את השְפעת הטיפול באמצעות תוסף כורכומין פוספוליפידי (®Meriva) במחלת כלי דם קטנים בסוכרת (diabetic microangiopathy). במחקר, 25 נבדקים סוּכרתיים הסובלים ממחלת כלי הדם הקטנים לפחות חמש שנים ומקבלים טיפול תרופתי להפחתת רמת הסוכר בדם (לא מפורט במאמר) אך אינם מטופלים באינסולין נטלו תוסף כורכומין עטוף בפוספוליפיד במבנה פיטוזומלי (כורכומין ופוספטידיל כולין ביחס 1:2 (במינון 1 גרם ליום בנוסף לטיפול הקונבנציונאלי (תרופות לטיפול בסוכרת) במשך ארבעה שבועות. קבוצה דומה של נבדקים סוּכרתיים ששימשה כקבוצת ביקורת טופלה באמצעים קונבנציונאליים. בתום ההתערבות בקבוצת הכורכומין בהשוואה לקבוצת הביקורת נצפו שיפור במוליכות העור הכף הרגל (skin flux)p<0.05, שיפור ברפלקס כיווץ כלי הדם הפריפריים בעמידה (venoarteriolar response) p<0.05, הפחתה בבצקתיות (edema) p<0.05, ועליה בלחץ החמצן ברקמה התת עורית (PO2) p<0.05. לא נצפו תופעות לוואי או אינטראקציות עם התרופות.
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו(364), בחן את השְפעת תוסף כורכומין על גורמי סיכון להתפתחות טרשת עורקים בקרב חולי סוכרת. 240 נבדקים חולי סוכרת (בני 35 ומעלה, גלוקוז בצום ≥126, גלוקוז ≥200 מ"ג לדציליטר שעתיים לאחר מבחן סבילות לגלוקוז, HbA1c ≥6.5) שאינם נוטלים תרופות חולקו אקראית לקבלת מיצוי כורכומין (תמצית יבשה עם תכולת כורכומנואידים של 75-85%) במינון 250 מ"ג או פלסבו במשך שישה חודשים. בתום ההתערבות נמצא כי בהשוואה לפלסבו, מיצוי הכורכומין הפחית במובהק את מהירות גל הדופק (Pulse wave velocity) שהינו מדד לקשיון העורקים (במובהקות p<0.01), את מדד התנגודת לאינסולין HOMA-IR (במובהקות p<0.01), את רמות הלפטין (במובהקות p<0.01), הטריגליצרידים (במובהקות p<0.01),חומצת השתן (p<0.01), השומן הבטני (p<0.05),השומן הכללי (במובהקות p<0.01) והעלה במובהק את רמות האדיפונקטין (במובהקות p<0.01). עוד נצפתה מגמה לא מובהקת של הפחתה ב-BMI וביחס ההשמנה הבטנית להיקף המותניים, ברמות ה-LDL, הכולסטרול הכללי והאנזים הכבדי ALT, ועליה לא מובהקת ברמת ה-HDL. מסקנת החוקרים היתה שהטיפול באמצעות כורכומין יעיל לשיפור מדדים מטבוליים ולהפחתת גורמי סיכון להתפתחות טרשת עורקים בקרב חולי סוכרת.
תרופות להורדת רמות שומנים (סטטינים)
ניתן לשלב כורכום יחד עם תרופות מסוג זה.
בחלק מהמחקרים הקלינים(555,553,550), אך לא בכולם(105,369), הודגם כי כורכומין שיפר באופן מתון את פרופילי השומנים ובכך עשוי לשפר את יעילות התרופה ולהוביל להפחתת מינון התרופות. בשניים מהמחקרים(105,369), כורכום ניתן בבטחה יחד עם מגוון תרופות הכוללות סטטינים, מעכבי ACE, חוסמי קולטן אנגיוטנסין, חוסמי בטא, אספירין, סולפונילוריאה, מטפורמין ואינסולין.
מחקר קליני(370) השווה בין נטילה של אטורבסטטין (atorvastatin) לנטילה של תמצית כורכום ומצא השפעה דומה על תפקוד האנדותל בהקשר לירידה בציטוקינים דלקתיים וסמני עקה חמצונית. בנוסף, מחקר בחולדות(499) מצא השפעות אנטי סרטניות סינרגטיות עם סימבסטטין (simvastatin).
על פי סקירה(102) ישנם מספר מנגנוני פעולה שבאמצעותם כורכום עשוי אף להפחית כאבי שרירים ולמנוע התנוונות שרירים הנובעת לעיתים ממתן סטטינים. בין המנגנונים שהוזכרו: הפחתת תהליכים דלקתיים על ידי עיכוב מסלול NF-kB, פעילות נוגדת חמצון, הפחתת ניוון השרירים, המרצת התחדשות סיבי השריר לאחר פגיעה על ידי שיפור ניצול האנרגיה בתאי השריר, הגדלת קצב שכפול המיטוכונדריה ופעילות משככת כאב.
ישנה סקירה נוספת(293) ומחקרים קליניים התומכים במנגנוני הפעולה הללו: פעילות נוגדת חמצון ועיכוב של NF-kB ומסלולים דלקתיים אחרים(563), פעילות משככת כאב(80-81) בעקבות עיכוב אנזימי COX-2 ו-PgE2, יצירת גירוי לשחרור הקורטיזול והידלדלותsubstance P מוגברת מקצות העצבים(84).
פירוט המחקרים:
במחקר קליני אקראי כפול סמיות(555) שכלל חולי סוכרת מסוג 2, נמצא כי מתן כורכומין ננו-מיצל (Nanomicelle) (ננו-כורכומין; 80 מ"ג ליום) למשך 3 חודשים הפחית באופן משמעותי את רמת הסוכר בדם בצום, רמת HbA1c, רמת טריגליצרידים ורמת LDL. ניתן להסיק מכך שמתן ננו-כורכומין לחולי סוכרת מסוג 2 עשוי לשפר את מאזן הסוכר ואת פרופיל השומנים.
במחקר אקראי כפול סמיות אקראי(556) שכלל 80 חולי סוכרת, נמצא כי מתן 80 מ"ג ננו-כורכומין למשך 8 שבועות הפחית באופן משמעותי את רמת הסוכר בדם בצום (p=0.04) ו-HbA1C (במובהקות p<0.001). כמו כן נצפתה הפחתה משמעותית בציון הנוירופתיה (p<0.001) וציון הרפלקס הכולל (p=0.04).
במחקר קליני אקראי כפול סמיות(545) שכלל 80 חולי סוכרת סוג 2 והיפרליפידמיה נמצא כי נטילה של 2100 מ"ג אבקת שורש כורכום ליום במשך 8 שבועות הובילה לירידה משמעותית במשקל הגוף, במדדי הטריגליצרידים וה-LDL (p<0.05). לטיפול לא הייתה השפעה משמעותית על המצב הגליקמי, רמת ה-hs-CRP ועל היכולת נוגדת החמצון הכוללת בחולים אלה.
במחקר קליני אקראי כפול סמיות(553) אשר כלל 32 חולי סוכרת סוג 2 ודיסליפידמיה (בגילאי 35-70 שנים) נבדק מתן 200 מ"ג של תמצית אתנולית של כורכום ו-200 מ"ג תמצית מימית של שום לכל כמוסה למשך 3 חודשים. המינונים שניתנו היו 1.2 גרם, 1.6 גרם ו-2.4 גרם. הנטילה הפחיתה את רמות הסוכר בדם בצום בכל הקבוצות אך לא נראתה משמעות סטטיסטית. הקבוצה שטופלה במינון הגבוה ביותר (2.4 גרם) הראתה ירידה משמעותית ברמת הסוכר בדם שעתיים לאחר הארוחה ב-22.68% (p=0.032) ,ברמות ה-HbA1C (במובהקות p=0.025) וברמות השומנים. בין 3 המינונים, המינון של 2.4 גרם הוביל גם לירידה ברמת הגלוקוז בצום, רמת גלוקוז שעתיים לאחר הארוחה, רמת HbA1C, כולסטרול כללי, ליפופרוטאין בצפיפות נמוכה, טריגליצרידים ומדד מסת הגוף, במידה משמעותית יותר משני המינונים האחרים. בנוסף, רמת מינון זו הגדילה את הליפופרוטאין בצפיפות גבוהה יותר משני המינונים האחרים. במהלך המחקר לא נצפו תופעת לוואי משמעותית, והטיפול לא הראה שינויים לרעה על תפקודי הכליות והכבד וכן על הרכב הדם של כל הנבדקים.
במחקר קליני(550) בקרב 100 חולי סוכרת מסוג 2 שמנים, נטילת 300 מ"ג ליום של כורכומינואידים הפחיתה באופן משמעותי את רמת הסוכר בדם בצום (p<0.01), רמות המוגלובין מסוכרר HgbA1C (במובהקות p=0.031), ורמות HOMA-IR (במובהקות p<0.01). כמו כן נצפתה הפחתה משמעותית ברמות חומצות השומן החופשיות FFAs וטריגליצרידים. מסקנת החוקרים הייתה שההשפעות ההיפוגליקמיות של התמצית נובעות לפחות באופן חלקי מניצול חומצות השומן.
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו(105) בחן את ההשפעה של כורכום על הסובלים מתסמונת כלייתית בעקבות מחלת הזאבת (Lupus nephritis). עשרים וארבעה נבדקים שאובחנו בתסמונת כלייתית בהתקף חוזר או במצב של הדרדרות נמשכת עמידה לטיפול (relapsing or refractory) חולקו אקראית לנטילת תמצית כורכום (במינון 1500 מ"ג עם תכולת כורכומין של 66.3 מ"ג ביום) או פלסבו עם כל ארוחה במשך שלושה חודשים. בתום ההתערבות נמצא כי כורכום סייע להפחית את רמות החלבון בשתן (p<0.009), להפחית נוכחות דם בשתן (p<0.002), והפחית את לחץ הדם הסיסטולי (p=0.02), במטופלים הסובלים מלופוס נפריטיס בהשוואה למצב הבסיס. לא נצפתה השפעה מובהקת על המשתנים בהשוואה למצב הבסיס בקבוצת הפלסבו. כורכומין מגן על הכליות בתסמונת כלייתית שמקורה בזאבת מפני לייפת ומוות תאי על ידי פעילות נוגדת חמצון ועיכוב מסלול השעתוק של (TGFβ (transforming growth factor beta הגורם לעליה בביטוי הציטוקין הדלקתי TNFɑ תאי אנדותל הכליה. כורכומין אינו משפיע על המנגנון החיסוני הגורם ליצירת נוגדנים עצמיים בזאבת (הנובע מפעילות יתר של זרוע החיסון (Th2). כמו כן, כורכומין מונע הדרדרות של מצב הכליות בתסמונת על ידי ויסות יתר לחץ הדם העורקי (בייחוד יתר לחץ דם סיסטולי) במנגנון פעולה לא ידוע.
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו(369) בחן את השְפעת הנטילה של כורכומין על פרופיל השומנים בקרב חולים בתסמונת כלילית חריפה (Acute coronary syndrome) שבעים וחמישה נבדקים שאובחנו בתסמונת כלילית חריפה חולקו אקראית לנטילת פלסבו או כורכומין במינון 45, 90 או 180 מ"ג ליום במשך חודשיים. הנבדקים הונחו להמשיך ליטול טיפול תרופתי במהלך ההתערבות (מעכבי ACE, סטטינים, ותרופות נגד סוכרת). 63 נבדקים השלימו את ההתערבות. בתום ההתערבות לא נצפתה השפעה מובהקת של כורכומין על רמות הכולסטרול הכללי, ה-LDL וה-HDL בהשוואה לפלסבו. עם זאת, נצפתה מגמה לא מובהקת של הפחתה ברמות הכולסטרול הכללי וה-LDL והעלאה של רמות ה-HDL, ומגמת ההפחתה הגבוהה ביותר היתה בקבוצת המינון הנמוך בהשוואה לקבוצת המינון הבינוני וקבוצת המינון הגבוה. לגבי רמות הטריגליצרידים, מגמת ההפחתה הלא מובהקת היתה גבוהה יותר בקבוצת המינון הגבוה בהשוואה לקבוצת המינון הנמוך וקבוצת המינון הבינוני.
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו(370) בחן את השְפעת תוסף כורכומנואידים (NCB-02) על תפקוד וסקולרי-אנדותלי לקוי בקרב חולי סוכרת. 72 נבדקים חולי סוכרת לא תלוית אינסולין עם תפקוד וסקולרי-אנדותלי לקוי חולקו אקראית לנטילת תוסף המכיל תמצית תקנית של כורכומנואידים (מתוקננת להכיל 78% כורכומנואידים, מתוכם 72% כורכומין) במינון 300 מ"ג ליום, Atorvastatin ( במינון 10 מ"ג ליום) או פלסבו במשך שמונה שבועות. 67 נבדקים השלימו את ההתערבות. בהשוואה למצב הבסיס נצפה שינוי מובהק בתפקוד האנדותלי, והפחתה בעקה החמצונית (לפי רמות המלונדיאלדהידים), ברמות הפפטיד אנדותלין 1 (המכווץ את כלי הדם) וברמות הציטוקינים הדלקתיים אינטרלוקין 6 ו-TNFɑ בקבוצת הכורכומנואידים ובקבוצת ה-Atorvastatin אך לא בקבוצת הפלסבו.
תרופות להורדת לחץ דם (חוסמי בטא, מעכבי ACE, חוסמי תעלות סִידן)
ניתן לשלב כורכום יחד עם תרופות מסוג זה, אך יש לנקוט בזהירות. בשני מחקרים קליניים(105,369) הודגים כי טיפול משולב של כורכום יחד עם תרופות נוגדות יתר לחץ דם (מעכבי ACE וחוסמי קולטני אנגיוטנסין) הינו בטוח, אם כי לא הייתה השפעה משמעותית על לחץ הדם או רמות השומנים.
אחד המחקרים(105) הדגים הפחתה של סימני דלקת ועקה חמצונית. עם זאת, כורכום עשוי לגרום לתגובות הדדיות פרמקוקינטיות עם תרופות שונות עקב שינוי בפעילות האנזים CYP450. לכן מומלץ לעקוב אחר לחץ הדם ורמות התרופות בדם.
פירוט המחקרים:
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו(105) בחן את יעילות הטיפול בנפרופתיה סוכּרתִית באמצעות כורכום. 40 נבדקים החולים בנפרופתיה סוכּרתִית כתוצאה מסוכרת סוג 2 בעלי ערכי לחץ דם מאוזנים תרופתית (מעכבי ACE וחוסמי הקולטן לאנגיוטנסין) חולקו אקראית לנטילת תוסף כורכום במינון 1500 מ"ג ליום (מינון שווה ערך ל-66.3 מ"ג כורכומין) במשך חודשיים. בתום ההתערבות נמצא שכורכום יעיל בהפחתת מדדי הדלקת, עקה חמצונית (TGF-β, TNF-α ו-IL-8) ובהפחתת החלבון והקריאטינין בשתן בנפרופתיה סוכּרתִית בהשוואה למצב הבסיס (TGF-β ,p<0.006 IL-8 ,p<0.02 TNF-α לא מובהק, פרוטאינוריאה p<0.001, קריאטינין לא מובהק) ובהשוואה לפלסבו (TGF-β ,p<0.006 TNF-α ,p<0.007 IL-8 לא מובהק, פרוטאינוריאה p<0.03, קריאטינין p<0.02). לא נמצאו הבדלים משמעותיים בין שתי הקבוצות מבחינת סוכר בדם, טריגליצרידים, כולסטרול ורמות LDL. לא נצפו תופעות לוואי או אינטראקציות עם טיפול תרופתי.
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו(369) בחן את השְפעת הנטילה של כורכומין על פרופיל השומנים בקרב חולים בתסמונת כלילית חריפה (Acute coronary syndrome) שבעים וחמישה נבדקים שאובחנו בתסמונת כלילית חריפה חולקו אקראית לנטילת פלסבו או כורכומין במינון 45, 90 או 180 מ"ג ליום במשך חודשיים. הנבדקים הונחו להמשיך ליטול טיפול תרופתי במהלך ההתערבות (מעכבי ACE, סטטינים, ותרופות נגד סוכרת). 63 נבדקים השלימו את ההתערבות. בתום ההתערבות לא נצפתה השפעה מובהקת של כורכומין על רמות הכולסטרול הכללי, ה-LDL וה-HDL בהשוואה לפלסבו. עם זאת, נצפתה מגמה לא מובהקת של הפחתה ברמות הכולסטרול הכללי וה-LDL והעלאה של רמות ה-HDL, ומגמת ההפחתה הגבוהה ביותר היתה בקבוצת המינון הנמוך בהשוואה לקבוצת המינון הבינוני וקבוצת המינון הגבוה. לגבי רמות הטריגליצרידים, מגמת ההפחתה הלא מובהקת היתה גבוהה יותר בקבוצת המינון הגבוה בהשוואה לקבוצת המינון הנמוך וקבוצת המינון הבינוני.
מחקר קליני אקראי כפול סמיות ומבוקר במבנה מוצלב(106) שנערך על עשרה נבדקים בריאים ובו מתן חד פעמי תוסף כורכום (שתוקנן להכיל 480 מ"ג כורכומנואידים) בשילוב עם התרופה Nifedipine ממשפחת חוסמי תעלות סידן (עוברת מטבוליזם דרך CYP3A4 ו-P-gp) לא השפיע במובהק על רמות התרופה בדם. הערת מערכת: לא ניתן להסיק מסקנות חד משמעיות לגבי בטיחות השילוב בשל גודל המדגם הקטן והנטילה החד פעמית.
במחקר(104) שנערך על 12 מתנדבים בריאים, נטילת 300 מ"ג כורכומין ביום במשך שישה ימים, הפחיתה את הזמינות הביולוגית של מנה בודדת מהתרופה Talinolol מסוג חוסמי בטא בכ-30% (p<0.05) והגביר את פינויה פי 1.5 (p<0.05).
במחקר שנערך בחולדות(107), מתן פומי של כורכומין (במינון 100 מ"ג/ק"ג) במשך שבעה ימים העלה משמעותית (פי 1.7, p<0.01) את ריכוז התרופה Losartan, תרופה להורדת לחץ דם מסוג חוסמי הקולטן לאנגיוטנסין 2, ואת ריכוז תוצר הפירוק שלה EXP3174 בדם (פי 3.2, p<0.01). היות שלא חל שינוי ב-t1/2 של התרופה, החוקרים משערים כי מנגנון התגובה ההדדית הוא עיכוב מנגנון P-gp והגברת ספיגת התרופה במעי. במידה ומשלבים כורכום עם תרופות אלו רצוי לערוך (בעיקר בתחילת הטיפול) ניטור יומי של לחץ הדם.
במחקר בחולדות(56), מתן פומי של כורכומין בשילוב עם חוסם בטא Celiprolol לתקופה של ארבעה ימים הגביר את ריכוז התרופות בדם פי 1.3 (p<0.01) והפחית את הפרשתו ב-22% (p=0.01).
טיפול ביולוגי בנוגדן TNFɑ (רמיקייד)
ניתן ואף רצוי לשלב כורכומין עם התרופה.
סקירה שיטתית(108) בחנה את יעילות ובטיחות כורכומין בשילוב עם התרופה remicade לטיפול במחלת קרוהן בקרב מבוגרים. התרופה רמיקייד מפחיתה רמת TNFɑ בקרב חולי קרוהן, אך נוטה להפסיק להשפיע כאשר רמת הציטוקין IL-1 עולה ואז גובר הסיכון להתפתחות ממאירות. חולי קרוהן שנטלו כורכומין (כטיפול בודד) הפחיתו במובהק את מדד תסמיני המחלה, את רמת IL-1 ואת רמת חלבון הפאזה האקוטית CRP, בנוסף להפחתה ברמת ה-TNFɑ. החוקרים מסכמים כי שילוב של התרופה עם כורכומין עשוי להפחית את אבדן התגובה לתרופה (Loss Of Response) ולהפחית את הסיכון לפיתוח ממאירויות.
התרופה Methotrexate
ניתן לשלב כורכום יחד עם תרופה זו, אך יש לנקוט בזהירות.
מתוטרקסט משמש ככימותרפיה כאשר הוא נלקח במינונים גבוהים, וכתרופה לדיכוי חיסוני כאשר הוא נלקח במינונים נמוכים (לטיפול במחלות אוטואימוניות).
במחקר קליני(243) נמצא כי נטילה משולבת של כורכום ומתוטרקסט (כחלק מנוהל הציקלופוֹספמיד-מתוטרקסט-5-FU) היה בטוח ושיפר משמעותית את איכות החיים של החולים.
במחקרים פרה-קליניים(109-117), נטילה משולבת של כורכומין עם מתוטרקסט, במינונים גבוהים ונמוכים של התרופה, הודגם כי כורכום עשוי להגדיל את יעילותה, כמו גם להפחית את רעילות התרופה ותגובות שליליות לא רצויות הקשורות לשימוש בתרופה.
מכיוון שאין מחקרים קליניים זמינים, הרלוונטיות הקלינית של ממצאים אלה אינה ברורה.
פירוט המחקרים:
מתוטרקסאט ככימותרפיה- מחקר קליני אקראי כפול סמיות ומבוקר פלסבו(243) בחן את יעילות הטיפול בסרטן באמצעות תוסף כורכומנואידים המתווסף לטיפול הכימותרפי. שמונים נבדקים חולי סרטן בעלי גידולים מוצקים(solid tumors) המטופלים בטיפול כימותרפי חולקו אקראית לנטילת תוסף כורכומנואידים עם זמינות ביולוגית משופרת (סוג מיצוי לא ידוע) במינון 180 מ"ג ליום או פלסבו במשך שמונה שבועות. בתום ההתערבות נמצא כי תוסף הכורכומנואידים היה יעיל יותר במובהק מפלסבו בשיפור איכות החיים של הנבדקים (p<0.001) ובהפחתת מדדי הדלקת TNFɑ (p<0.001) ו-CRP (p<0.001), הפחתת גורם הגדילה TGFβ (p<0.001), הפחתת החלבון הכימוטקטי למונוציטים MCP-1 (p<0.001), והפחתת מדדי הכאב substance P (p<0.005), והפחתת הפפטיד הקשור לגן הקלציטונין CGRP (p<0.001). בנוסף, לתוסף הכורכומנואידים נצפה יתרון לא מובהק (p=0.061) על פני פלסבו בהפחתת רמת הציטוקין הפרו דלקתי.IL-6 עם זאת, לפלסבו נצפה יתרון מובהק (p=0.012) על פני תוסף הכורכומנואידים בהפחתת רמת הציטוקין IL-8.
במחקרים שונים שנערכו בחולדות(109-110), נטילת כורכומין הפחיתה מהרעילות הכלייתית והכבדית הנגרמת משימוש בתרופה Methotrexate.
במחקרים שונים שנערכו בתנאי מעבדה(111-112), כורכומין שיפר את רגישותם של תאי סרטן עצם ודם (Osteosarcoma, Leukemia) העמידים לתרופה מתוטרקסאט, והגביר את יעילות התרופה.
כמו כן, בתנאי מעבדה(113), כורכומין הפחית את הנזק שנגרם לרקמת המעי בעקבות שימוש בתרופה מתוטרקסאט.
מתוטרקסאט לדיכוי חיסוני - במחקר מבוקר שנערך בעכברים(114) החולים בדלקת מפרקים שגרונית (RA), שילוב כורכומין (100 מ״ג לכל ק״ג משקל גוף, בהזרקה) יחד עם התרופה מתוטרקסאט שיפר את יעילותה והפחית מתופעות לא רצויות הנלוות לשימוש בה כטיפול בודד (ירידה במשקל, ירידה בספירת הדם הלבנה והאדומה, ירידה בריכוזי הטסיות וההמטוקריט).
יש לציין כי המחקר האחרון(114) ספג ביקורת(115) על כך שהפרעות בתמונת הדם כתוצאה משימוש במתוטרקסאט הינן תלויות מינון, בעוד קבוצת החולדות שנטלה כורכומין קיבלה חצי ממינון המתוטרקסאט (לכן ייתכן שהשיפור בתמונת הדם אינו קשור כלל לנטילת הכורכומין). במחקר דומה, הזרקה בטנית לחולדות חולות RA של 30 או 100 מ״ג כורכומין הדגימה הפחתה ברעילות הכבדית שנגרמת מהשימוש בתרופה מתוטרקסאט במינון נמוך(116).
במחקר אחר שנערך בחולדות(117), טיפול בכורכומין הפחית את חדירות רירית המעי ונזק שנגרם לרירית בעקבות שימוש במתוטרקסאט (התוצאות היו טובות יותר מאשר במקביל לשימוש בתרופה המקובלת (Sulfasalazine).
תרופות לדיכוי חיסוני (במושתלי איברים)
יש לנקוט זהירות במשלב כורכום עם תרופות אלו.
באם נדרש משלב זה, רצוי לנטר באופן קבוע את רמת התרופה בדם, ובמידת האפשר להפריד בין זמני הנטילה, מכיוון שהצמח עשוי להשפיע על ריכוז התרופה בדם.
סקירה(118) מדווחת על תיאור מקרה(119) בו מושתל כבד שנטל את התרופה טקרולימוס (tacrolimus) הראה סימנים של רעילות תרופתית לאחר נטילת כמות ניכרת של כורכום, ובמחקר בבעלי חיים(120) נטילה משולבת של כורכום עם טקרולימוס גרמה לעלייה ברמת התרופה בדם. טקרולימוס מעכב את אנזימי CYP3A4 ו-A53.
מצד שני, סקירה(66) דיווחה על מחקר חולדות(121) שבו כורכומין הגביר את רמות האנזים 3A4 וגרם לירידה משמעותית ברמות התרופה בדם.
פירוט המחקרים:
מאמר סקירה(118) מתריע מפני השילוב בין הצמח ובין התרופה Tacrolimus מחשש לעיכוב פעילות אנזימי הציטוכרוֹם A4/53 והעלאת ריכוז התרופה.
זאת בעקבות תיאור מקרה(119) שבו דווח על מושתל כבד בן 56 אשר נטל Tacrolimus ואושפז לאחר צריכה מוגברת של כורכום במזון (כ-15 כפיות ביום) כשהוא סובל מבצקות, היפרקלמיה ורמה מוגברת של קריאטינין בסרום אשר נבעו מרעילות תרופתית.
במחקר בודד שנערך בבעלי חיים(120), נמצא שנטילה של 170 מ"ג לכל ק"ג משקל כורכום לפני הזרקה של התרופה Tacrolimus גרם לעליה של רמת התרופה בדם.
לעומת זאת, סקירה(66) מדווחת על כורכומין שניתן חד פעמית לחולדות במינון 50-100 מ"ג/ק"ג משקל גוף ובשילוב עם מתן חד פעמי של התרופה Everolimus אשר הפחית במובהק את ריכוז התרופה בדם (ב-70.6-71.5% בהתאם למינון הצמח, p<0.001), על ידי הפעלה של האנזים CYP3A4 שדרכו מתפרקת התרופה(121) שככל הנראה התגברה על ההשפעה המעכבת של כורכומין על מנגנון P-gp.
תרופות נוגדות דִיכאון
ניתן לשלב כורכומין יחד עם תרופות מסוג זה.
כורכומין עשוי להגביר את השְפעת התרופות, בייחוד תרופות מעכבות MAO, SSRI ו-SNRI.
במחקר קליני(122) נטילה משולבת של תוסף המכיל כורכומין במקביל ל- SSRI הדגימה מגמה להקלה מהירה יותר של התסמינים. במחקר בבעלי חיים(123), הכורכומין הגביר את ההשפעה של עיכוב MAO בעת נטילה משולבת של כורכום יחד עם מעכבי MAO, בהמשך לכך הודגם כי המשלב עם תרופות SSRI סינרגיסטי על ידי העלאת רמות הסרוטונין. לא הייתה השפעה על תרופות טריציקליות. במחקר אחר בבעלי חיים(124), כורכומין שיפר את ההשפעה נוגדת הדיכאון של פלוקסטין (SSRI).
פירוט המחקרים:
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו(122) בחן את יעילות הטיפול בדיכאון באמצעות תוסף המכיל כורכומין בשילוב עם טיפול תרופתי מסוג (SSRI venlafaxine / escitalopram), הנבדקים (40, טווח גילאים 20-60) שאובחנו כסובלים מדיכאון קליני מג’ורי וטופלו בתרופות נוגדות דיכאון חולקו אקראית לקבלת פלסבו או תוסף המכיל מיצוי כורכומין (בריכוז 97%) במינון 330 מ"ג ליום, מיצוי של חומצה אלג'ית מקליפות רימונים (בריכוז 70%) במינון 120 מ"ג ליום ופיפרין במינון 50 מ"ג ליום במשך חמישה שבועות. בתום ההתערבות לא נרשם יתרון לתוסף על פני הפלסבו בהפחתת תסמיני הדיכאון לפי המדדים MADRS (Montgomery-Asberg Depression Rating Scale) ו-HAMD (Hamilton Depression Rating Scale). אולם, הטיפול בתוסף הדגים מגמת שיפור מהירה יותר בהשוואה לפלסבו.
במחקר שנערך על עכברים(123) הדגים כורכומין (במינון 20 ו-40 מ"ג לק"ג משקל גוף) הגברת השפעה של תרופות נוגדות דיכאון מסוג מעכבי MAO (tranylcypromine, selegiline), העלאת רמות של סרוטונין, נוראדרנלין ודופמין ועיכוב פעילות האנזים מונואמין אוקסידאז (MAO-A ו- MAO-B). בנוסף, כורכומין הדגים השפעה סינרגיסטית עם תרופות נוגדות דיכאון מסוג (SSRI (fluoxetine), SNRI (venlafaxine והתרופה הלא טיפוסית bupropion (מעכבת ספיגה חוזרת של דופמין). והגביר את השְפעתן על ידי העלאת רמות הסרוטונין, גם כשניתנו במינון תת קליני. שילוב של כורכומין עם פיפרין (2.5 מ"ג לק"ג משקל גוף) הגביר עוד יותר את ההשפעה. עם זאת, כורכומין לא הגביר את השְפעת התרופות הטריציקליות (imipramine desipramine).
במחקר שנערך בעכברים(124), כורכומין במינון 20 מ"ג/ק"ג שניתן במתן חד פעמי בשילוב עם התרופהFluoxetine (העוברת חילוף חומרים דרך האנזים CYP2D6) העצים את ההשפעה האנטי דיכאונית של התרופה מבלי להשפיע על ריכוזה בסרום ובמוח. הערת מערכת: במחקרים אחרים הודגמה פעילות מעכבת של כורכומין את האנזים CYP2D6. ייתכן שבנטילה ממושכת יותר היתה ניכרת השפעה פרמקודינמית של כורכומין על התרופה.
מתן פומי חד פעמי של כורכומין (במינון 200 מ"ג/ק"ג) לחולדות(125) בשילוב עם התרופה Buspirone שניתנה בהזרקה תוך ורידית לא השפיע על ריכוז התרופה בדמן.
הערת מערכת: גם במקרה זה, לא ניתן ללמוד מנטילה חד פעמית על ההשפעה ארוכת טווח של שילוב כורכומין עם התרופה.
תרופות נוגדות פרכוסים (carbamazepine)
יש לנקוט זהירות בשילוב כורכום יחד עם התרופה.
קיים חשש תיאורטי כי השילוב עלול להוביל לרעילות בכבד.
מחקר(126) שנועד לבחון אינטראקציות פוטנציאליות של צמחי מרפא ולזהות חולים המאושפזים ועלולים להיות בסיכון עקב אינטראקציות אלו מתייחס למחקר שנעשה בעכברים(12) שפורסם בשנת 1998 והציע כי צמח הכורכום השלם עשוי להיות רעיל לכבד (hepatotoxic), לכן החוקרים מזהירים כי מתן של כורכום או כורכומין עם קרבמזפין (carbamazepine), הידועה כרעילה לכבד, יהווה קונטראינדיקציה. עם זאת, במחקרם, מטופל מאושפז השתמש בכורכום בעת נטילת קרבמזפין ללא תגובות כבד שליליות.
בנוסף, קיימת סקירה עדכנית(565) המציגה עדויות לכך שכורכומין דווקא מגן על הכבד.
אנטיביוטיקה
אין מניעה בשילוב כורכום יחד עם תרופות אנטיביוטיות.
מספר סקירות(127-128) מדווחות כי כורכומין פועל באופן סינרגיטי עם מספר תרופות אנטיביוטיות כגון beta-lactams, cephalosporins, aminoglycosides, glycopeptides, tetracyclines, and fluoroquinolones.
במחקר קליני(129), מתן שילוב המכיל כורכומין אשר ניתן יחד עם Ciprofloxacin הוביל להשפעה סינרגטית עם התרופה שהובילה לתוצאות טובות יותר. במספר מחקרים בבעלי חיים(132-133) ובמחקרי מעבדה(134,135,136,137), כורכומין הודגם כסינרגיסטי עם מספר אנטיביוטיקות, כולל tetracycline, norfloxacin, ciprofloxacin, gentamicin, amikacin, cefepime, ampicillin, oxacillin, cefaclor, cefodizime and cefotaxime.
פירוט המחקרים:
מחקר פרוספקטיבי אקראי(129) בחן את ההשפעה של דקל ננסי (Serenoa repens), שורש סרפד (Urtica dioica), כורכומין וקוורציטין, לטיפול משולב עם ציפרופלוקסצין (תרופה אנטיביוטית) לטיפול בדלקת ערמונית חיידקית. 143 מטופלים הסובלים מדלקת ערמונית חיידקית השתתפו במחקר, כולם קיבלו ציפרופלוקסצין במינון 600 מ"ג ליום במשך 14 יום. בקבוצת ההתערבות בנוסף לטיפול האנטיביוטי המטופלים קיבלו גם את התוספים הצמחיים. חודש לאחר תחילת המחקר, בקבוצת הטיפול האנטיביוטי 27% מהמטופלים דיווחו על שיפור, לעומת 89.6% בקבוצת ההתערבות (p<0.0001). נמצא שיפור מבחינת התסמינים ואיכות החיים (p<0.0001 בשני המדדים). כעבור שישה חודשים בקבוצת הביקורת 2 אנשים סבלו מחזרת המחלה, בעוד בקבוצת ההתערבות כולם נותרו בריאים.
במחקר שנערך על ארנבות(132) עם זיהום עורי ב-S.aureu משחה למריחה שהכילה שילוב של כורכומין בריכוז 2% עם tetracycline בריכוז 1% הביאה להחלמה מהירה יותר של העור בהשוואה למשחת tetracycline בריכוז 3% לבדה. עוד נמצא כי משלב של כורכומין והתרופה הוביל להרס של קרומי החיידקים כעבור 18 שעות של טיפול.
במחקר שנערך על ארנבות(133), נטילה פומית של 60 מ"ג כורכומין לכל ק"ג משקל גוף ביום, הגבירה את הזמינות הביולוגית של התרופה Norfloxacin בכ-25%.
מחקר מעבדה(134) בחן את יעילות כורכומין לבדו ובשילוב עם אנטיביוטיקות שונות כנגד שישים זני חיידקים גראם חיוביים ושליליים מייצרי רובד חיידקי (ביופילם). יעילות מקסימלית כנגד חיידקי גראם חיוביים נצפתה בשילוב כורכומין עם התרופה ciprofloxacin, וכנגד חיידקי גראם שליליים בשילוב כורכומין עם amikacin, gentamicin ו-cefepime.
בתנאי מעבדה(135) הודגמה יעילות של כורכומין בשילוב עם תרופות אנטיביוטיות כנגד חיידקי Staph. Aureus עמידים ל-ampicillin, cefixime, cefotaxime, vancomycin ו-tetracycline.
במחקרים(127-128,136) אחרים הודגמה יעילות כורכומין בשילוב עם ampicillin, oxacillin ו-norfloxacin בשילוב עם ciprofloxacin כנגד חיידקי Staph Aureus (סטפילוקוקוס "הזהב") העמידים למטיצילין (MRSA).
כמו כן, במעבדה(137) כורכומין הדגים פעילות סינרגיסטית עם תרופות אנטיביוטיות ממשפחת הצפלוספורינים (cefaclor, cefodizime) ו- cefotaxime כנגד חיידקים גורמי שלשולים.
תרופות נוגדות פטריות
אין מניעה בשילוב כורכום יחד עם תרופות מסוג זה.
במחקרים בבעלי חיים(138,140) כורכומין נמצא כבעל פעילות אנטי פטרייתית כנגד קנדידה ובסקירה(580) ובמחקרי מעבדה(139,141,529) כורכום נמצא כסינרגיסטי עם תרופות אנטי פטרייתיות שונות. אין מחקרים קליניים בנושא ולכן הרלוונטיות הקלינית של ממצאים אלה אינה ברורה. יחד עם זאת, אין מניעה לשלב כורכום עם טיפול תרופתי אנטי פטרייתי וקיים פוטנציאל תיאורטי להפחתת תופעות לוואי תרופתיות הקשורות לרעילות כבדית.
פירוט המחקרים:
במספר מחקרים(138-140) שנערכו בעכברים שהודבקו בקנדידה, כורכומין הפחית במובהק את העומס הפטרייתי.
בתנאי מעבדה(139,141) כורכומין הדגים פעילות סינרגיסטית עם תרופות נוגדות פטריות שונות (voriconazole, itraconazole, ketoconazole, miconazole, fluconazole, amphotericin B, nystatin) כנגד 21 זנים שונים של פטריות קנדידה. אין מחקרים קליניים בנושא ולכן לא ברורה הרלוונטיות הקלינית של הממצאים. יחד עם זאת אין מניעה לשלב כורכום עם טיפול תרופתי אנטי פטרייתי וקיים פוטנציאל תיאורטי להפחתת תופעות לוואי תרופתיות הקשורות לרעילות כבדית.
במחקר מעבדה(529) נבדקה השְפעת כורכומין על 23 זני פטריות. זני ה-Paracoccidioides brasiliensis היו הרגישים ביותר, בעוד שזני האספרגילוס (Aspergillus) לא הושפעו. כמו כן, הכורכומין היה הרבה יותר יעיל מפלוקונזול (fluconazole) במניעת הדבקה של מיני קנדידה לחלל הפה, במיוחד בחולי איידס.
אנטי היסטמינים (Loratadine)
יש לנקוט בזהירות במשלב כורכום יחד עם תרופה זו.
סקירה(66) מדווחת על מחקר בבעלי חיים(142) שבו כורכומין הגביר את רמת התרופה האנטי-היסטמינית Loratadine.
הרלוונטיות הקלינית של ממצא זה אינה ברורה.
פירוט המחקרים: סקירה(66) מדווחת על מחקר שנערך בחולדות(142) ובו מתן פומי של כורכומין במנה בודדת במינון של 0.5-8 מ"ג/ק"ג משקל גוף בשילוב עם התרופה האנטי היסטמינית Loratadine העלה במובהק את רמות התרופה בדם ב-39.4-66.7% (במובהקות p<0.05). העליה ברמות התרופה בדם הוסברה על ידי שיפור ספיגתה במעי דרך עיכוב פעילות מנגנון P-gp במעיים והפחתת פירוקה על ידי הפחתת פעילות האנזים CYP3A4 בכבד ובמעיים. לא ברורה הרלוונטיות הקלינית של ממצא זה, בייחוד לאור העובדה שמדובר בנטילה חד פעמית של הצמח והתרופה. אך היות שהתרופה בטוחה ונטולת תופעות לוואי משמעותיות, שימוש קצר מועד במשלב התרופה והצמח יכול להיחשב כבטוח.
התרופה Infliximab
אין מניעה במשלב כורכום יחד עם תרופות מסוג זה.
סקירה שיטתית(108) בדקה את האפשרות של נטילה משולבת של כורכום ואינפלקסימאב (Infliximab) והגיעה למסקנה כי כורכום יעיל בהפחתת תסמיני מחלת קרוהן וסמנים דלקתיים (IL-1 ו-TNF-alpha) אשר עשויים לתרום לתגובת הגוף לתרופה, וכן להפחית את הסיכון לחלות בסרטן.
פירוט המחקרים:
סקירה שיטתית(108) בחנה את יעילות ובטיחות כורכומין בשילוב עם התרופה remicade לטיפול במחלת קרוהן בקרב מבוגרים. התרופה רמיקייד מפחיתה רמת TNFɑ בקרב חולי קרוהן, אך נוטה להפסיק להשפיע כאשר רמת הציטוקין IL-1 עולה ואז גובר הסיכון להתפתחות ממאירות. חולי קרוהן שנטלו כורכומין (כטיפול בודד) הפחיתו במובהק את מדד תסמיני המחלה, את רמת IL-1 ואת רמת חלבון הפאזה האקוטית CRP, בנוסף להפחתה ברמת ה-TNFɑ. החוקרים מסכמים כי שילוב של התרופה עם כורכומין עשוי להפחית את אבדן התגובה לתרופה (Loss Of Response) ולהפחית את הסיכון לפיתוח ממאירויות.
התרופה Ciprofloxacin
ניתן לשלב כורכום יחד עם תרופה זו, אך יש לנקוט בזהירות.
במחקר קליני(129), נטילה משולבת של תוסף המכיל כורכומין יחד עם Ciprofloxacin הובילה להשפעה סינרגיסטית שהובילה לתוצאות טובות יותר. עם זאת, במחקר בבעלי חיים(130) כורכומין הפחית את יעילותה של Ciprofloxacin הפועלת על ידי יצירת ROS, בשל הפעילות נוגדת החמצון של הכורכומין.
פירוט המחקרים:
מחקר פרוספקטיבי אקראי(129) בחן את ההשפעה של דקל ננסי (Serenoa repens), שורש סרפד (Urtica dioica), כורכומין וקוורציטין, לטיפול משולב עם ציפרופלוקסצין (תרופה אנטיביוטית) לטיפול בדלקת ערמונית חיידקית. 143 מטופלים הסובלים מדלקת ערמונית חיידקית השתתפו במחקר, כולם קיבלו ציפרופלוקסצין במינון 600 מ"ג ליום במשך 14 יום. בקבוצת ההתערבות בנוסף לטיפול האנטיביוטי המטופלים קיבלו גם את התוספים הצמחיים. חודש לאחר תחילת המחקר, בקבוצת הטיפול האנטיביוטי 27% מהמטופלים דיווחו על שיפור, לעומת 89.6% בקבוצת ההתערבות (p<0.0001). נמצא שיפור מבחינת התסמינים ואיכות החיים ( p<0.0001בשני המדדים). כעבור שישה חודשים בקבוצת הביקורת 2 אנשים סבלו מחזרת המחלה, בעוד בקבוצת ההתערבות כולם נותרו בריאים.
במחקר שנערך במעבדה ובעכברים(130), כורכומין הפחית את יעילות התרופה Ciprofloxacin וגרם לשגשוג של חיידקי S.typhi ו- S.typhimuriu הגורמים למחלת הטיפוס על ידי הגנה על החיידקים מפני עקה חמצונית שגורמת התרופה.
התרופה Norfloxacin
יש לנקוט בזהירות במשלב כורכום יחד עם תרופה זו. במחקר שנערך בארנבים(133), נמצא כי מתן פומי של כורכומין במינון של 60 מ"ג/ק"ג ליום, הגביר את הזמינות הביולוגית של התרופה Norfloxacin בכ-25%. מחקר מעבדה(136) הדגים את יעילותו של הכורכומין בשילוב עם ampicillin, oxacillin, norfloxacin ועם ciprofloxacin נגד זיהום חיידקי סטפילוקוקוס אוראוס עמידים למתצילין (MRSA). הרלוונטיות הקלינית של ממצאים אלה אינה ברורה.
התרופה Cotrimoxazole
יש לנקוט בזהירות במשלב כורכום יחד עם תרופה זו. במחקר שנערך בעכברים(131) שנדבקו בקדחת הטיפוס בעקבות הדבקה בסלמונלה טיפימוריום, נטילה משולבת של כורכומין יחד עם התרופה Cotrimoxazole ממשפחת הסולפונאמיד הפחיתה את ההשפעה האנטי מיקרוביאלית של התרופה. הרלוונטיות הקלינית של ממצא זה אינו ברורה.
תרופות לטיפול בשחפת
ניתן לשלב כורכום יחד עם תרופות לטיפול בשחפת. יחד עם זאת יש לנקוט זהירות בשילוב עם התרופה Bedaquiline כפי שמפורט בהמשך.
במחקר קליני(143) השילוב של תמצית כורכום וקורדיפוליה במקביל ל- isoniazid, rifampicin ו- pyrazinamide הפחית באופן משמעותי את הרעילות לכבד הנגרמת על ידי התרופות, שיפר את יעילות התרופות והוביל לשיפור בתסמיני המחלה ואף נראתה הפחתה בתוצאות חיוביות לשחפת, ובנגעי ריאה אופייניים.
פירוט המחקרים:
במחקר קליני(143) 528 נבדקים חולי שחפת הנוטלים תרופות חולקו אקראית לנטילת תמצית כורכום במינון 1 גרם ליום (25% כורכומין) בנוסף ל-1 גרם ליום של הצמח Tinospora cordifolia או פלסבו במשך 6 חודשים. 508 נבדקים השלימו את ההתערבות. בתום שישה חודשים נמצא כי נטילת הטיפול הצמחי הפחיתה משמעותית את הרעילות הכבדית הנגרמת מהתרופות Isoniazid, Rifampicin ו-Pyrazinamide (לפי הפחתה ברמות אנזימי הכבד ALT, AST וברמת הבילירובין בסרום, p<0.0001). במקביל נצפה שיפור בתסמיני המחלה בקרב הנבדקים בקבוצת הטיפול הצמחי בהשוואה לפלסבו שבא לידי ביטוי בעליה מובהקת במשקל ובירידה מובהקת בקצב שקיעת הדם (ESR). כמו כן, בבדיקות כיח של הקבוצה שנטלה את הצמחים, לאחר 4 שבועות נצפתה ירידה משמעותית בתוצאות חיוביות לשחפת (p=0.0068) כמו גם במספר הנגעים האופייניים ברקמת הריאה (p=0.0037).
התרופה Bedaquiline
יש לנקוט בזהירות בשילוב התרופה יחד עם כורכום.
במחקר בחולדות(543), נטילה של כורכום יחד עם התרופה בדקווילין (Bedaquiline) הובילה לעלייה בריכוז התרופה בדם.
פירוט המחקרים:
במחקר על חולדות(543), נטילה של כורכום יחד עם התרופה בדקווילין (Bedaquiline) הובילה לעלייה בריכוז התרופה בדם (מ-315±77 ל-ng/ml 536±83) ובשטח מתחת לעקומה (AUC) של בדקווילין (מ-1813 ± 372 ל-2870 ± 226). כמו כן, נצפתה פעילות מעכבת על מנגנון P-gp הפועל להוצאת התרופה מהתאים ומעכב את חילוף החומרים שלה.
אוֹמגה 3
ניתן ואף מומלץ לשלב כורכומין יחד עם תרופות אלו.
במחקר קליני(144), נמצא כי השילוב של ננו-כורכומין ותוסף אומגה 3 הפחית את תדירות התקפי המיגרנה ביעילות רבה יותר מאשר התוספים לבד. פעילות זו נראתה כנראה בשל התכונות האנטי הדלקתיות של הכורכום והאומגה 3. השפעה סינרגיסטית נצפתה גם במחקר מעבדה(566). כמו כן, במחקרי בעלי חיים (145-146) כורכומין הגביר ייצור וזמינות של DHA בכבד ובמערכת העצבים המרכזית ושיפר את יחס ההמרה של DHA מ-ALA ו-EPA.
פירוט המחקרים:
במחקר קליני אקראי כפול סמיות ומבוקר פלסבו(144) שנערך בקרב 80 נבדקים (80% מהם נשים, טווח גילאים 20-50) הסובלים ממיגרנות כרוניות והנוטלים תרופות (נוגדי דיכאון amitriptyline או nortriptyline וחוסם בטא propranolol), נמצא שנאנו-כורכומין (במינון 80 מ"ג ליום) ותוסף אומגה 3 (שמן דגים במינון 2500 מ"ג ליום, 1200 מ"ג EPA ו-600 מ"ג DHA) שניתנו במשולב אך לא כשניתנו לבדם במשך חודשיים היו יעילים במובהק בהפחתת תדירות ההתקפים בהשוואה למצב הבסיס ובהשוואה לפלסבו (p<0.001 בשניהם). פעילות כורכומין בשילוב אומגה 3 יוחסה להפחתה מובהקת (p<0.001) של הביטוי הגנטי והרמות בסרום של הציטוקין TNFɑ בשניהם.
טיפולי אור (פוטותרפיה)
ניתן ואף מומלץ לשלב כורכום יחד עם טיפול זה.
במחקר קליני(147), השילוב של כורכום ופוטותרפיה היה יעיל לטיפול בפסוריאזיס.
פירוט המחקרים:
במחקר קליני כפול-סמיות מבוקר פלסבו(147) נמצא שטיפול משולב של כורכום במינון של כמוסה אחת, פעם ביום, יחד עם טיפולי אור מקומיים בנגעי פסוריאזיס היה יעיל יותר מאשר כורכום יחד עם טיפולי אור מדומה אשר שימשו כקבוצת ביקורת. מטופלים עם נגעי עור ברמה בינונית עד חמורה התחילו בטיפולי אור שנמשכו שבועיים, לאחר 2-3 ימים מנטילת תוסף הכורכום. הטיפול באור כלל חשיפה של כל הגוף לקרינה מסוג UVA וכן טיפול אמיתי (real visible light phototherapy) או מדומה / פלסבו (simulated visible light phototherapy) באזורי גוף נבחרים. נמצא בסיום המחקר שחל שיפור בשתי הקבוצות. בקבוצת ההתערבות חל שיפור של 80% בנגעי העור, ובקבוצת הפלסבו שיפור של 20%.
כִימותרפיה - כללי
אין מניעה בשילוב הכורכומין יחד עם תרופות אלו, אך יש לנקוט זהירות.
במחקרים קליניים(177,567,206,20,569,224,243,244,570) נטילה משולבת של כורכום יחד עם מגוון כימותרפיות (docetaxel, Gemcitabine, Imatinib, cyclophosphamide, cisplatin ו- 5-FU) נצפתה כבטוחה ואף שיפרה את התוצאות הקליניות ואת איכות חייהם של המטופלים.
בנוסף, מספר מחקרים קליניים(225,248,249,250,251,577,578,226) הראו כי כורכום ומרכיביו (בדרך כלל באמצעות יישום חיצוני או בנטילה פומית בשילוב עם צמחי מרפא אחרים) מסייעים במניעת תגובות שליליות הקשורות לסרטן עצמו ולטיפול קונבנציונאלי: כיבים ריריים בחלל הפה, רגישות ודלקתיות העור הנגרמת כתוצאה מהקרנות, עייפות, בחילות והקאות, שלשולים או עצירות, אובדן תיאבון וירידה במשקל, פגיעה בזיכרון או שינויים קוגניטיביים, רגישות לזיהומים/אלח דם, נויטרופניה ותסמינים של פגיעה בלב כתוצאה מהמחלה ומתרופות כימותרפיות.
במחקרים פרה-קליניים נצפתה השפעה סינרגיסטית של כורכום יחד עם docetaxel(178), doxorubicin(155-176), paclitaxel (179-184), Gemcitabine(207,208), Imatinib(575), cyclophosphamide (219-222,573,574), cisplatin (170,188-205,568), bleomycin(214,215,571), irinotecan(216,572) ו- FU-5 (209-211).
מספר סקירות(151-152) המדווחות על מחקרים קליניים, בבעלי חיים ובמעבדה(54-56,58,60,111,153) מצאו כי הכורכום מנע את עמידות התאים סרטניים לטיפול תרופתי בעקבות פעילותו המעכבת על אנזים P-gp אשר שואב באופן פעיל את התרופה הכימותרפית מתא הגידול.
לכורכומין פוטנציאל טיפולי רב בקרב חולי סרטן אולם נדרשים מחקרים קליניים ברורים אשר יוכיחו כי להשפעה המתוארת יש ערך קליני וכי השילוב הינו בטוח. בנוסף, מהמחקרים הקליניים עולה כי לא רק שכורכום אינו פוגע ביעילות הטיפולים אלא שבחלק מהמקרים הוא משפר את תוצאות הטיפול ומפחית תופעות לוואי תרופתיות שונות.
כימותרפיה מסוג Doxorubicin (Adriamycin(
אין מניעה בשילוב כורכום יחד עם תרופה זו.
אמנם בעבר מחקר מעבדה בודד(154) הראה כי כורכומין עלול לעכב עד 70% מוות תאי הנגרם על ידי תרופות כימותרפיות שונות המשמשות לטיפול בסרטן השד כגוןCyclosphinamide, Camptothecin, Mechlorethamine ו-Doxorubicin(Adriamycin), אך בשנים האחרונות נערכו מחקרים רבים (במעבדה ובבעלי חיים) אשר הדגימו כי משלב של כורכומין והתרופה Doxorubicin הינו סינרגיסטי ומגביר את יעילות התרופה(155-162), גם כנגד תאי סרטן עמידים(163-170). כמו כן, תמציות כורכום ו/או כורכומין הדגימה השפעה מגנה מפני רעילות לבבית, כבדית וכלייתית אשר עלולה להיגרם עקב שימוש בתרופה(156,164,169-176).
כימותרפיה מסוג Docetaxel
ניתן לשלב כורכום עם תרופות אלו, אך מומלץ לנטר את רמת התרופה בדם.
במחקר קליני(177) (Phase 1) שנערך על 14 חולות סרטן שד מתקדם או גרורתי, הומלץ על מינון של 6 גרם כורכומין ביום, למשך שבעה ימים רצופים, כל שלושה שבועות, במקביל למתן התרופה Docetaxel במינון המקובל. רק עשר מטופלות סיימו את המחקר במינון של עד 8 גרם ליום, מתוכן חמש מטופלות חוו שיפור חלקי, אצל שלוש המחלה נותרה יציבה ואחת עברה הסרה כירורגית של הגרורות.
במחקר מעבדה (in-vivo, in-vitro) הודגם(178) כי כורכומין משפר את יעילות התרופה Docetaxel.
כמו כן, בנטילה פומית של עכברים ובתנאי מעבדה, שילוב כורכומין עם התרופה Paclitaxel הדגים פעילות סינרגיסטית (עיכוב חלוקת תאים, אפופטוזיס מוגבר) לעומת התרופה לבדה(179-180). ההשפעה נוגדת הגרורות של כורכומין יחד עם מינון נמוך של Paclitaxel היתה שוות ערך למינון גבוה של התרופה לבדה.
תיאורטית, שילוב כזה יהווה טיפול אפקטיבי באותה מידה, אך בעל רעילות מופחתת(181).
במספר מחקרים שנערכו בעכברים ובתנאי מעבדה כורכמין הגביר רגישות תאי סרטן שד, תאי סרטן שחלות ותאי סרטן צוואר הרחם לתרופות cyclophosphamide ו-paclitaxel וייעל את פעולתן(182-184).
סקירה(66) מדווחת על מחקר שנערך על עכברות(185) שהושרה בהן סרטן שחלות אנושי בו מתן משולב של Paxlitaxel בשילוב עם כורכומין במינון 50 מ"ג/ק"ג משקל גוף במשך שלושה ימים העלה פי 4.1 את ריכוז התרופה בדם ושיפר את זמינותה הביולוגית פי 5.2 בהשוואה למן התרופה לבדה (p<0.05). הצטברות התרופה ברקמת הגידול עלתה אף היא פי 3.2. מנגנון הפעולה המשוער הוא הפחתת הביטוי הגנטי של P-gp ו-CYP3A2 על ידי כורכומין.
מתן מנה בודדת(186) של כורכומין לחולדות בשילוב עם התרופה Docetaxel העלה פי 1.86 את ריכוזה בדם (לפי השטח תחת העקומה הפרמקוקינטית) ואת זמן מחצית החיים שלה פי 1.55 והפחית את פינויה ב-52.1%. מנגנון הפעולה הוא עיכוב הנשאים OATP1B1 ו-OATP1B3 על ידי כורכומין.
מתן כורכומין(187) עם התרופה Docetaxel במשך ארבעה ימים לחולדות העלה את ריכוז התרופה בדם ואת זמינותה הביולוגית פי 8 (p<0.01).
כימותרפיה מסוג Paclitaxel
אין מניעה במשלב כורכומין יחד עם תרופות אלו, אך יש לנקוט בזהירות.
יש לעקוב אחר רמות התרופה בדם כמו גם סימני רעילות תרופתית.
במחקרים פרה-קליניים(179,180,181,182-184), נמצא כי כורכומין הגביר את יעילות התרופה פקליטקסל והפחית את רעילותה.
עם זאת, סקירה(66) ומחקר בבעלי חיים(185) הדגימו עליה בריכוז פקליטקסל בדם בעקבות נטילת הכורכומין לכן יש לנקוט משנה זהירות.
פירוט המחקרים:
בנטילה פומית של עכברים ובתנאי מעבדה(179-180), שילוב כורכומין עם התרופה Paclitaxel הדגים פעילות סינרגיסטית (עיכוב חלוקת תאים, אפופטוזיס מוגבר) לעומת התרופה לבדה.
ההשפעה נוגדת הגרורות של כורכומין יחד עם מינון נמוך שלPaclitaxel הייתה שוות ערך למינון גבוה של התרופה לבדה. תיאורטית, שילוב כזה יהווה טיפול אפקטיבי באותה מידה, אך בעל רעילות מופחתת(181).
במספר מחקרים שנערכו בעכברים ובתנאי מעבדה(182-184) כורכמין הגביר רגישות תאי סרטן שד, תאי סרטן שחלות ותאי סרטן צוואר הרחם לתרופות cyclophosphamide ו-paclitaxel וייעל את פעולתן.
מחקר נערך על עכברות(185) שהושרה בהן סרטן שחלות אנושי, ובו מתן משולב של Paclitaxel בשילוב עם כורכומין במינון 50 מ"ג/ק"ג משקל גוף במשך שלושה ימים העלה פי 4.1 את ריכוז התרופה בדם ושיפר את זמינותה הביולוגית פי 5.2 בהשוואה להתרופה לבדה (במובהקות p<0.05). הצטברות התרופה ברקמת הגידול עלתה אף היא פי 3.2. מנגנון הפעולה המשוער הוא הפחתת הביטוי הגנטי של P-gp ו-CYP3A2 על ידי כורכומין.
כימותרפיה מבוססת פלטינום (Cisplatin)
אין מניעה בשילוב כורכום יחד עם תרופה זו.
במחקר קליני(243) נמצא כי נטילה משולבת של כורכום יחד עם ציספלטין (כחלק מטיפול קונבנציונאלי של דוסטקסל-ציספלטין-5-FU) הייתה בטוחה ושיפרה משמעותית את איכות חייהם של החולים.
מחקרים פרה-קליניים(188-195,196-204,568,170,205) הראו כי טיפול משולב של כורכומין יחד עם ציספלטין מגביר את יעילותו, מפחית את הרעילות הנגרמת על ידי התרופה ומגביר את הרגישות של תאי גידול העמידים לתרופה. הרלוונטיות הקלינית של ממצאים אלו אינה ברורה.
פירוט המחקרים:
במחקר אקראי כפול סמיות מבוקר פלסבו(243), שנערך בקרב 80 חולי סרטן עם גידול מוצק (סרטן המעי הגס, הקיבה ושד) העוברים טיפולי כימותרפיה סטנדרטיים (דוסטקסל-ציספלטין-5-FU לסרטן קיבה ושד, topotecan-cyclophosphamide-etoposide או cyclophosphamide-methotrexate-5-FU לסרטן השד, וטיפולים מבוססי 5-FU לסרטן מעי הגס), מתן תוסף כורכומינואידים פיטוזומלי (®Meriva המכיל 20% כורכומינואידים) במינון של 900 מ"ג ליום (שווה ערך ל-180 מ"ג כורכומינואידים ליום) במשך 8 שבועות שיפר משמעותית את איכות חייהם של המטופלים על פי מדד QoL של אוניברסיטת וושינגטון (UW-QoL) במובהקות p<0.001, ודיכא משמעותית את סמני הדלקת המערכתית שלהם(TNF-α, TGFβ, hs-CRP, MCP-1, p<0.001; IL-6, p=0.061; substance P, p=0.005) בהשוואה לפלסבו. מצד שני, נראתה הפחתה משמעותית ב-IL-8 בסרום עם פלסבו בהשוואה לכורכומינואידים (במובהקות p=0.012). שינויים באיכות החיים היו קשורים לשינויים ברמות TGFβ בסרום. הטיפול בכורכומינואידים היה בטוח ונסבל היטב. שמונה נבדקים דיווחו על תופעות לוואי קלות במערכת העיכול. עם זאת, אף אחד מהנבדקים שנשרו מהמחקר לא דיווח על תגובות שליליות.
על פי מחקרים שנערכו בבעלי חיים ובתנאי מעבדה(188-195), שילוב של כורכומין והתרופה Cisplatin מגביר את יעילותה ואת השפּעתה כנגד תאי סרטן עמידים.
יתרה מזו, במספר מחקרים נוסף של בעלי חיים ומעבדה(196-204,568) הודגמה יכולתם של הכורכום והכורכומין להפחית ואף להעלים תופעות לוואי רעילות של התרופה, כולל רעילות לכבד, רעילות לכליות, נזק מבני בתאים ונזק שמיעתי.
בתנאי מעבדה(170,205), כורכומין הגביר רגישות תאי סרטן גליומה אנושיים ותאי סרטן שחלות עמידים לתרופות cisplatin, etoposide, camptothecin, doxorubicin ולהקרנות.
כימותרפיה מסוג Gemcitabine
ניתן ואף מומלץ לשלב כורכום יחד עם תרופות אלו.
בשלושה מחקרים קליניים(206,20,569) נמצא כי טיפול משולב של כורכומין יחד עם התרופה Gemcitabine הוביל לשיפור היעילות הפחתת רעילות התרופה כמו כן, הטיפול הינו בטוח, ונסבל ללא תופעות לוואי שליליות. במחקרים פרה-קליניים(207-208) שילוב הכורכומין יחד עם התרופה Gemcitabine הפחית את העמידות לתרופה ונראה כבעל פעילות סינרגיסטית.
פירוט המחקרים:
מחקר קליני(206) (Phase 1) נערך על 16 חולי סרטן לבלב או דרכי מרה ושילב תוסף כורכומין בעל זמינות גבוהה יחד עם טיפול בכימותרפיה Gemcitabine. במינון 200-400 מ"ג כורכומין, השילוב נמצא בטוח לשימוש. לא נצפו תופעות ושלושה מטופלים המשיכו לצרוך את התוסף למעלה מתשעה חודשים.
במחקר קליני(20) נמצא כי מינון של 8 גרם כורכומינואידים (90% כורכומין) ביום על פני 3-4 שבועות, לצד עירוי של התרופה Gemcitabine לטיפול בסרטן לבלב מתקדם, לא נסבל ע"י 5 מתוך 17 משתתפי המחקר, שפרשו עקב תלונות על הפרעות במערכת העיכול. המינון הנחקר הופחת ל-4 גרם כורכומין ביום, ומבין הנבדקים הנותרים, מטופל אחד חווה שיפור חלקי, אצל ארבעה מטופלים המחלה נותרה יציבה, נבדק אחד נפטר במהלך המחקר, ואצל שישה מטופלים הגידול המשיך להתקדם.
במחקר פרוספקטיבי(569) (phase 2) אשר כלל 44 חולי סרטן (13 עם גידול מקומי, 31 עם גידול גרורתי), טיפול משולב של 500 מ"ג Meriva (פורמולת פטנט של כורכומין יחד עם פוספוליפידים) 4 פעמים ביום למשך 9 סבבים (כאשר כל סבב הינו 28 ימים) יחד עם התרופה gemcitabine הוביל לשיעור של 61.4% בשליטה במחלה. התקדמות התרחשה בקרב 17 חולים (38.6%), וחציון הזמן להתקדמות עמד על 8.4 חודשים. לאחר 26 חודשים, 37 חולים (84.1%) מתו לאחר הישרדות חציונית של 10.2 חודשים. בחולי סרטן הלבלב עם גידול מקומי זמן ההישרדות החציוני היה 16 חודשים ובאלו עם הגידול הגרורתי 8.5 חודשים (זמן ההישרדות הרגיל עם gemcitabine עמד על 5.7 חודשים). אלו שלא הגיבו לטיפול היו בקורלציה עם רמות גבוהות יותר של IL-6 (p=0.03) ,CD40L (p=0.05) ו- CRP(p=0-03) אשר הדגימו את הקשר הישיר בין רמת הדלקת לחומרת המחלה. שיעורי דלקת גבוהים יותר נקשרו להתקדמות הגידול ולעמידות תאית מוגברת. אצל החולים שהגיבו לטיפול סמנים ביולוגיים לא השתנו ובאלו שלא הגיבו חל שינוי משמעותי בסמנים ביולוגיים לאחר הסבב הראשון. לא נרשמה ירידה באיכות החיים במהלך הטיפול. השילוב של nab-paclitaxel ו-gemcitabine הגדיל את זמן ההישרדות מ- 8.5 ל-10.7 חודשים. הוספת ®Meriva לתרופה Gemcitabine נמצאה יעילה לא פחות מהוספת nab-paclitaxel והיא קשורה בפחות רעילות. תיסוף ב-®Meriva לא הוביל לרעילות מוגברת ואיכות החיים נשמרה, כמו כן לא הייתה אינטראקציה שלילית בין הצמח לתרופה.
במחקרים פרה-קליניים(207-208), שנערכו על תאי סרטן הלבלב ובקרב עכברים, נמצא כי כורכומין תורם להפחתת התפתחות עמידות לכימותרפיה מסוג Gemcitabine, אשר מהווה גורם עיקרי להופעת גרורות, ובעל השפעה סינרגיסטית עם התרופה דרך עיכוב NFkB, השריית אפופטוזיס ומניעת אנגיוגנזה.
כימותרפיה מסוג (Fluorouracil (5-FU
ניתן ואף מומלץ לשלב כורכומין יחד עם תרופות אלו.
במחקר קליני(570) נטילה משולבת של כורכומין יחד עם התרופות FOLFOX ± bevacizumab הביאה לתוצאות טובות יותר מהתרופות בלבד והייתה בטוחה ונסבלת.
במחקר קליני אחר(243), טיפול משולב של כורכום יחד עם Fluorouracil (כחלק מטיפול קונבנציונאלי בדוסטקסל-ציספלטין-5-FU או ציקלופוֹספמיד-מתוטרקסט-5-FU) התגלה כבטוח ושיפר משמעותית את איכות חייהם של החולים.
במחקרים פרה-קליניים(209-211), נמצא כי הכורכומין הגביר רגישות של תאי גידול במעי ובחלחולת ל-5-FU ושיפר את עיכוב ריבוי תאי הגידול.
פירוט המחקרים:
במחקר אקראי מבוקר(570) אשר כלל 27 חולים עם סרטן מעי גס גרורתי, טיפול בתרופות FOLFOX (Leucovorin/5-FU/Oxaliplatin) ± bevacizumab לבד למשך 3 סבבי כימותרפיה הושווה ל-FOLFOX + 2 גרם כורכומין ליום/CUFOX (קומפלקס של C3 המכיל כ-80% כורכומין ו-20% demethoxycurcumin ו-isdemethoxycurcumin) למשך 9 סבבים. תוספת הכורכומין לטיפול נמצאה בטוחה, ללא הבדל משמעותי במספר תופעות הלוואי. תופעות הלוואי בקבוצת הכורכומין היו ברובן קשורות למערכת העיכול. כל החולים בטיפול ה-FOLFOX נפטרו במהלך תקופת המעקב (9 מתוך 9), ואילו 13/18 (72%) בטיפול ה-CUFOX נפטרו. נראתה עלייה משמעותית ב-PFS (הישרדות ללא התקדמות המחלה) וב-OS (הישרדות כללית) בקבוצת הכורכומין, וציון איכות חיים גבוה יותר בקבוצת הכורכומין. מסקנת החוקרים הייתה שהשילוב של כורכומינואידים ו-FOLFOX בטוח ונסבל עם פוטנציאל להשגת תוצאות טובות.
במחקר אקראי כפול סמיות מבוקר פלסבו(243), שנערך בקרב 80 חולי סרטן עם גידול מוצק (סרטן המעי הגס, הקיבה ושד) העוברים טיפולי כימותרפיה סטנדרטיים (דוסטקסל-ציספלטין-5-FU לסרטן קיבה ושד, topotecan-cyclophosphamide-etoposide או cyclophosphamide-methotrexate-5-FU לסרטן השד, וטיפולים מבוססי 5-FU לסרטן מעי הגס), מתן תוסף כורכומינואידים פיטוזומלי (®Meriva המכיל 20% כורכומינואידים) במינון של 900 מ"ג ליום (שווה ערך ל-180 מ"ג כורכומינואידים ליום) במשך 8 שבועות שיפר משמעותית את איכות חייהם של המטופלים על פי מדד QoL של אוניברסיטת וושינגטון (UW-QoL) במובהקות p<0.001, ודיכא משמעותית את סמני הדלקת המערכתית שלהם (TNF-α, TGFβ, hs-CRP, MCP-1, p<0.001; IL-6, p=0.061; substance P, p=0.005) בהשוואה לפלסבו. מצד שני, נראתה הפחתה משמעותית ב-IL-8 בסרום עם פלסבו בהשוואה לכורכומינואידים (במובהקות p=0.012). שינויים באיכות החיים היו קשורים לשינויים ברמות TGFβ בסרום. הטיפול בכורכומינואידים היה בטוח ונסבל היטב. שמונה נבדקים דיווחו על תופעות לוואי קלות במערכת העיכול. עם זאת, אף אחד מהנבדקים שנשרו מהמחקר לא דיווח על תגובות שליליות.
במחקר מעבדה(209) נמצא שכורכומין מעלה את רגישותם של תאי סרטן (מעי הגס וחלחולת) עמידים לתרופה הכימותרפית (Fluorouracil (5-FU.
במחקרי מעבדה אחרים(210-211) נמצא ששילוב כורכומין עם התרופות Fluorouracil ו-Oxaliplatin (FOLFOX) עיכב שגשוג של תאי סרטן מעי יותר מאשר שימוש במשלב התרופות לבד, כורכומין לבד או כורכומין בתוספת 5-FU.
כימותרפיה מסוג Vinblastine (Vinca Alkaloids)
יש לנקוט זהירות בשילוב כורכומין יחד עם תרופה זו.
במחקר מעבדה(58), הודגם כי כורכומין הגביר את רגישות התאים העמידים לתרופה וינבלסטין (Vinblastine). עם זאת, סקירה(212) מדווחת על מחקר מעבדה אחר(213) שבו הודגם כי כורכומין מפחית את ההשפעה הציטוטוקסית של וינבלסטין בתאים סרטניים בצוואר הרחם. הרלוונטיות הקלינית של ממצאים אלו אינה ברורה.
כימותרפיה מסוג Bleomycin
אין מניעה בשילוב כורכומין יחד עם תרופה זו.
מחקרים בבעלי חיים(214-215,571) הדגימו כי טיפול משולב של כורכומין יחד עם התרופה בלאומיצין (Bleomycin) עשוי להגן מפני רעילות הנגרמת על ידי התרופה. הרלוונטיות הקלינית של ממצאים זה אינו ברורה.
פירוט המחקרים:
נתונים שעולים ממחקרים שנערכו במכרסמים(214-215) מצביעים על כך שטיפול מקדים בכורכומין ונטילתו במקביל לתרופה Bleomycin, עשוי לסייע להפחית רעילות לריאות (הפחתת פיברוזיס ריאתי, דלקתיות וסמנים אחרים של רעילות ריאתית) הנגרמת כתופעת לוואי תרופתית.
במחקר שנערך על עכברים(571) שטופלו בבלאומיצין, נטילה פומית של כורכומין לא השפיעה על הפיברוזיס הריאתי (המושרה על ידי בלאומיצין), אך הזרקת כורכומין אל חלל הצפק (intraperitoneally) הפחיתה את הדלקת ועיכבה את הצטברות הקולגן עם מגמה לשיפור שיעור ההישרדות. כך גם לאחר החרפת הדלקת בעקבות הטיפול התרופתי. במחקר מעבדה אחר של אותם מחברים, הכורכומין הפחית את הפעילות הפרופיברוטית הן בפיברובלסטים תקינים והן בפיברולסטים IPF, וכמו כן, עיכב את מסלול איתות TGFβ.
כימותרפיה מסוג Irinotecan
אין מניעה בשילוב כורכומין יחד עם תרופה זו.
במחקרים פרה-קליניים(216,572), טיפול משולב של כורכומין יחד עם התרופה אירינוטקן (Irinotecan) היה סינרגיסטי עם התרופה, שיפר את השפעותיה ומנע את הרעילות שהיא גורמת.
פירוט המחקרים:
בתנאי מעבדה(216), שילוב של כורכומין עם התרופה Irinotecan נמצא סינרגיסטי; כורכומין הגביר השריית אפופטוזיס על-ידי התרופה בתאי סרטן מעי.
במחקר שנערך על עכברים(572) עם שלשולים הנגרמים על ידי אירינוטקן, הזרקה תוך בטנית של 100 מ"ג/ק"ג כורכומין למשך 8 ימים לפני הזרקת אירינוטקן מנע את השלשולים ואת מבנה המעיים הלא תקין הנגרם על ידי התרופה. כמו כן, השילוב הגביר את הביטוי של P4HB ו-PRDX4 ברקמת המעי הדק. במחקר מעבדה של אותם מחברים שהשתמשו בתאי IEC-6 (תאי קריפטה במעי עכברוש בוגר), כורכומין מנע שינויים מולקולריים הנגרמים על ידי התרופה וגם עיכב את הפעלת NK-kB, מנע עקה חמצונית והגן על תאים בריאים מפני אפופטוזיס המושרה על ידי תרופות.
כימותרפיה מסוג Etoposide
יש לנקוט זהירות בשילוב כורכום עם תרופה זו.
אין מניעה בשילוב כורכומין יחד עם תרופה זו, אך יש לנקוט בזהירות.
במחקר קליני(243), נטילה משולבת של כורכומים יחד עם התרופה אטופוסייד (Etoposide) נמצאה בטוחה ונראה שיפור משמעותי באיכות החיים של המטופלים.
סקירה(66) מדווחת על מחקר בחולדות(217), שבו כורכומין שניטל במקביל לאטופוסייד הגביר באופן משמעותי את הזמינות הביולוגית ואת הריכוז המרבי של התרופה כאשר היא ניתנת פומית אך לא השפיע כאשר התרופה הוזרקה לווריד. מנגנון הפעולה המשוער הוא עיכוב מנגנון P-gp ועיכוב פעילות האנזים CYP3A4 במעי הדק על ידי כורכומין. במחקר מעבדה(218), כורכומין התגלה כאנטגוניסטי לאטופוסייד כאשר הוא ניטל במקביל. במחקר מעבדה נוסף(170) כורכומין הגביר את הרגישות של תאי גידול מסוג גליומה לתרופות כימותרפיות שונות, ביניהן התרופה Etoposide, ולהקרנות.
פירוט המחקרים:
במחקר אקראי כפול סמיות מבוקר פלסבו(243), שנערך בקרב 80 חולי סרטן עם גידול מוצק (סרטן המעי הגס, הקיבה ושד) העוברים טיפולי כימותרפיה סטנדרטיים (דוסטקסל-ציספלטין-5-FU לסרטן קיבה ושד, topotecan-cyclophosphamide-etoposide או cyclophosphamide-methotrexate-5-FU לסרטן השד, וטיפולים מבוססי 5-FU לסרטן מעי הגס), מתן תוסף כורכומינואידים פיטוזומלי (®Meriva המכיל 20% כורכומינואידים) במינון של 900 מ"ג ליום (שווה ערך ל-180 מ"ג כורכומינואידים ליום) במשך 8 שבועות שיפר משמעותית את איכות חייהם של המטופלים על פי מדד QoL של אוניברסיטת וושינגטון (UW-QoL) במובהקות p<0.001, ודיכא משמעותית את סמני הדלקת המערכתית שלהם (TNF-α, TGFβ, hs-CRP, MCP-1, p<0.001; IL-6, p=0.061; substance P, p=0.005) בהשוואה לפלסבו. מצד שני, נראתה הפחתה משמעותית ב-IL-8 בסרום עם פלסבו בהשוואה לכורכומינואידים (במובהקות p=0.012). שינויים באיכות החיים היו קשורים לשינויים ברמות TGFβ בסרום. הטיפול בכורכומינואידים היה בטוח ונסבל היטב. שמונה נבדקים דיווחו על תופעות לוואי קלות במערכת העיכול. עם זאת, אף אחד מהנבדקים שנשרו מהמחקר לא דיווח על תגובות שליליות.
מחקר שנערך בחולדות(217) ובו מתן כורכומין במינון 2 או 8 מ"ג/ק"ג משקל גוף שניתן בשילוב עם התרופה Etoposide (שניתנה פומית או בהזרקה) העלה במובהק את זמינותה הביולוגית (עליה של 32.2-35.9% בריכוז המקסימלי של התרופה, עליה של 35.1-50.8% בשטח מתחת לעקומה הפרמקוקינטית ועליה של 36-52% בזמינות הביולוגית) כאשר ניתנה פומית(p<0.01) , אך לא השפיע על זמינותה הביולוגית כאשר ניתנה בהזרקה תוך ורידית. מנגנון הפעולה המשוער הוא עיכוב של מנגנון P-gp ועיכוב פעילות האנזים CYP3A4 במעי הדק על ידי כורכומין.
במחקר מעבדה(218), כורכומין הדגים השפעות אנטי-גידוליות חזקות לבדו, אך כאשר שולב יחד עם Etoposide נצפתה השפעה אנטגוניסטית על 4 מתוך 5 שורות התאים שמנעו מתאי הגידול למות. המנגנון המשוער הוא ששתי התרכובות גרמו לאפופטוזיס ולנמק, אך בדרכים שונות הובילו לתאים סרטניים להיתקע בשלבי S ו-G2/M המאפשרים לתאי הגידול זמן לתקן נזקי DNA ולחדש את התקדמות מחזור התא.
במחקר אחר שנערך גם הוא בתנאי מעבדה(170), כורכומין הגביר רגישות תאי סרטן גליומה אנושיים לתרופות Cisplatin, Etoposide, Camptothecin, Doxorubicin ולהקרנות.
כימותרפיה מסוג Cyclophosphamide
אין מניעה בשילוב כורכומין או כורכום יחד עם תרופה זו, אך יש לנקוט בזהירות.
במחקר קליני(243) נמצא כי טיפול משולב של כורכום והתרופה ציקלופוֹספמיד (כחלק מהטיפול הקונבנציונאלי topotecan-cyclophosphamide-etoposide או cyclophosphamide-methotrexate-5-FU) היה בטוח ושיפר משמעותית את איכות החיים של החולים.
במחקרים בבעלי חיים(219-222,573-574) כורכומין מנע נזקים הנגרמים על ידי התרופה.
עם זאת, במחקר אחר בבעלי חיים(154) אשר מעלה חשש, כורכומין במינון נמוך שניתן יחד עם ציקלופוֹספמיד מנע את הפחתת גודל הגידול. יש צורך במחקר נוסף על מנת להבין אם מתן כורכומין עשוי להפחית את רעילות התרופה מבלי להפחית את יעילותה.
פירוט המחקרים:
במחקר אקראי כפול סמיות מבוקר פלסבו(243), שנערך בקרב 80 חולי סרטן עם גידול מוצק (סרטן המעי הגס, הקיבה ושד) העוברים טיפולי כימותרפיה סטנדרטיים (דוסטקסל-ציספלטין-5-FU לסרטן קיבה ושד, topotecan-cyclophosphamide-etoposide או cyclophosphamide-methotrexate-5-FU לסרטן השד, וטיפולים מבוססי 5-FU לסרטן מעי הגס), מתן תוסף כורכומינואידים פיטוזומלי (®Meriva המכיל 20% כורכומינואידים) במינון של 900 מ"ג ליום (שווה ערך ל-180 מ"ג כורכומינואידים ליום) במשך 8 שבועות שיפר משמעותית את איכות חייהם של המטופלים על פי מדד QoL של אוניברסיטת וושינגטון (UW-QoL) במובהקות p<0.001, ודיכא משמעותית את סמני הדלקת המערכתית שלהם (TNF-α, TGFβ, hs-CRP, MCP-1, p<0.001; IL-6, p=0.061; substance P, p=0.005) בהשוואה לפלסבו. מצד שני, נראתה הפחתה משמעותית ב-IL-8 בסרום עם פלסבו בהשוואה לכורכומינואידים (במובהקות p=0.012). שינויים באיכות החיים היו קשורים לשינויים ברמות TGFβ בסרום. הטיפול בכורכומינואידים היה בטוח ונסבל היטב. שמונה נבדקים דיווחו על תופעות לוואי קלות במערכת העיכול. עם זאת, אף אחד מהנבדקים שנשרו מהמחקר לא דיווח על תגובות שליליות.
במחקר שנערך על חולדות(219) נמצא כי טיפול מקדים של 7 ימים בכורכומין מנע נזק ריאתי ממנת Cyclophosphamide אחת בהזרקה בטנית.
במחקרים נוספים בבעלי חיים(220-222) נמצאו עדויות נוספות למניעת נזק המושרה על ידי התרופה.
במחקר במכרסמים(154) נמצא כי האכלה במינון נמוך של כורכומין לפני מנת Cyclophosphamide אחת בהזרקה בטנית, מנעה הפחתה בגודל הגידול אחרי 24 ו-48 שעות. המחקר הזה קיבל ביקורת(223) על זמן התערבות קצר (גם של כורכומין וגם של התרופה) ושימוש בכורכומין במינון נמוך.
כימותרפיה מסוג Imatinib
נטילה של כורכומין ו/או כורכום יחד עם תרופה זו אפשרית.
במחקר קליני(224) ובמחקר מעבדה(575) טיפול משולב של כורכום ו-Imatinib הגביר את יעילות התרופה.
פירוט המחקרים:
במחקר קליני אקראי מבוקר(224), 50 נבדקים חולי לוקמיה מיאלואידית כרונית (CML) שטופלו ב-imatinib חולקו אקראית לקבלת התרופה לבדה או התרופה בשילוב כורכום טחון לאבקה מומסת בחלב במשך שישה שבועות. שילוב התרופה ואבקת השורש במינון 15 גרם ליום היה יעיל יותר במובהק בהפחתת רמות הניטריק אוקסיד שרמות מוגבהות שלו קשורות להתפתחות גידולים סרטניים בדמם של החולים (הפחתה מ-42.85 מיקרומול לליטר ל-4.06 מיקרומול לליטר) בהשוואה לתרופה לבדה (הפחתה מ-41.48 מיקרומול לליטר ל-14.26 מיקרומול לליטר) (במובהקות p<0.001).
מחקר מעבדה(575) מצא כי כורכומין אשר הודגר במבחנה עם התרופות הכימותרפיות וינקריסטין (vincristine), אימטיניב (imatinib) ודאונורוביצין (daunorubicin) באמצעות התא האנושי OP-1 הגביר את היעילות של וינקריסטין ואימטיניב, וכן הגביר אפופטוזיס ועיכב את פעילות NF-κB.
כימותרפיה מסוג Tamoxifen
אין מניעה בשילוב כורכום יחד עם תרופה זו, אך יש לנקוט בזהירות ולעקוב אחר רמות התרופה בדם.
מחקר קליני(576) הדגים כי טיפול משולב של כורכומין ופיפרין יחד עם טמוקסיפן (Tamoxifen) הפחית משמעותית את ריכוז האנדוקסיפן (המטבוליט הפעיל של טמוקסיפן).
סקירה(66) מדווחת על מחקר בחולדות(153) שבו טיפול משולב של כורכומין יחד עם טמוקסיפן הגביר את ריכוז התרופה בדם באמצעות עיכוב פעילות האנזים CYP3A4 במעי ובכבד ועיכוב של מנגנון P-gp במעי.
פירוט המחקרים:
במחקר קליני(576) שנערך בחולות סרטן שד, נבדק טיפול ב-1200 מ"ג של כורכומין ופיפרין (10 מ"ג) 3 פעמים ביום יחד עם טמוקסיפן. נמצא כי ריכוז האנדוקסיפן (המטבוליט הפעיל של טמוקסיפן) ירד באופן משמעותי בטיפול יחד עם הכורכומין ב-7.7% (p=0.07) וב-12.4% (p=0.02) עם הכורכומין והפיפרין.
מחקר שנערך בחולדות(153) ובו כורכומין שניתן בשילוב עם התרופה Tamoxifen במתן חד פעמי פומי הגביר את ריכוז התרופה בדם ב-33.1-64% באופן תלוי מינון (p<0.05 כאשר כורכומין ניתן במינון של 2.5 מ"ג/ק"ג ו-p<0.01 כאשר כורכומין ניתן במינון של 10 מ"ג/ק"ג) והפחית את פירוקה (במובהקות p<0.05) דרך עיכוב פעילות האנזים CYP3A4 במעי ובכבד ועיכוב מנגנון P-gp במעי.
כימותרפיה מסוג Vinorelbine
אין מניעה בשילוב כורכומין יחד עם תרופה זו.
במחקר מעבדה(581), שימוש בכורכומין ובוינורלבין על תאי H520 (קרצינומה של תאי ריאות), גרם לאפופטוזיס ועיכוב ביטוּיהם של COX-2, NF-kB ו-AP-1. טיפול מקדים בכורכומין הגדיל את האפופטוזיס המושרה מ-Vinorelbine מ-38% ל-61.3%. הרלוונטיות הקלינית של ממצא זה אינה ברורה.
רדיותרפיה
ניתן ואף מומלץ לשלב כורכומין יחד עם טיפול זה.
כורכום עשוי להגביר את יעילות הטיפול ולהפחית את רמת העקה החמצונית הכללית ואת תופעות הלוואי השליליות של הטיפול.
במחקר קליני(225), מתן תוסף כורכומין מסוג ®Meriva (תוסף כורכומינואידים פיטוזומלי המכיל 20% כורכומינואידים) הפחית באופן משמעותי תגובות שליליות הנגרמות כתוצאה מהקרנות ואת הדרישה לתרופות לטיפול בתגובות השליליות בנוסף להפחתת עקה חמצונית.
על פי מטא-אנליזה(579) ו-2 מחקרים קליניים(577-578) מתן כורכומין הפחית את השכיחות של מוקוזיטיס (דלקת וכיב בריריות המצפות את המעי) ותסמיני פרוקטיטיס (דלקת של רירית פי הטבעת, מהקצה התחתון של המעי הגס המוביל לפי הטבעת) הנגרמים עקב טיפולי קרינה.
במחקר קליני אחר(226) טיפול בכורכומין במקביל לטיפול בהקרנות הגביר את יכולת נוגדי החמצון הכוללת בדם והפחית את פעילות האנזים SOD מבלי להפחית את האפקטיביות של ההקרנות.
במחקרים פרה-קליניים(227,228) נמצא כי כורכומין הינו סינרגיסטי עם טיפולי הקרנות על ידי עיכוב NF-kB.
פירוט המחקרים:
מחקר קליני מבוקר(225) בחן את יעילות ובטיחות השימוש בתוסף כורכומין פוספוליפידי (Meriva) לטיפול בתופעות הלוואי הנובעות מטיפולים רדיותרפיים בסרטן. במחקר השתתפו 80 נבדקים חולי סרטן בני 35-70 לאחר ניתוח המוגדרים במצב גופני נפשי ותפקודי טוב (ציון של 70 ומעלה בסולם קרנופסקי) ללא מחלות לב, סוכרת או תסמונת מטבולית, העוברים טיפולי רדיותרפיה. הנבדקים חולקו אקראית לנטילת תוסף כורכומין פוספוליפידי (המכיל 100 מ"ג כורכומנואידים, DMT:BDMT:curcumin ביחס של 33:8:1 בהתאמה ו-200 מ"ג לציטין סויה) במינון 1500 מ"ג ליום או פלסבו במשך עד ארבעה חודשים (מתוכם לפחות 60 ימים ברציפות). נמצא שנטילת כורכומין הפחיתה במובהק את תופעות הלוואי של הטיפול בהשוואה לקבוצת הביקורת: פגיעה ברקמות אפיתל, פגיעה בפה, גרון ושט ומעיים, כאבים וכיבים בפה ובגרון, קושי בבליעה, כאבים בושט, שלשול ובחילה, נפיחות/בצקת בגפיים התחתונות, עייפות כללית, חולשה ואת הצורך בתרופות לטיפול בתופעות הלוואי (p<0.05). בנוסף, כורכומין הפחית במובהק את העקה החמצונית בדמם של הנבדקים בעקבות הטיפול בהשוואה לקבוצת הביקורת (הפחתה מ-467 ל- 389 יחידות PFR* בקבוצת הכורכומין לעומת עליה מ-471 ל-478 יחידות בקבוצת הביקורת, (בהתאמה p<0.022) ובהשוואה למצב הבסיס (בהתאמה p<0.021). הטיפול באמצעות כורכומין נסבל היטב והיה נטול תופעות לוואי.
במחקר קליני(577) אשר כלל 32 חולים עם סרטן ראש וצוואר, נטילה של ננו-כורכומין במקביל להקרנות הפחיתה משמעותית את שכיחות המוקוזיס ל-32% מהחולים לעומת 100% הופעה בקבוצת הביקורת, וכן הפחיתה את חומרתו.
במחקר קליני מבוקר אקראי(578) אשר כלל 64 חולים עם סרטן הערמונית שעברו הקרנות, נטילה של 120 מ"ג ליום ננוכורכומין הפחיתה את תדירות הפרוקטיטיס (דלקת של רירית פי הטבעת, מהקצה התחתון של המעי הגס המוביל לפי הטבעת) המושרה מקרינה מ-58.1% ל-45.5% (במובהקות p=0.31) לא היה הבדל בין הקבוצות בתגובת הגידול.
במחקרים שנערכו בעכברים(227) ובמעבדה(228), כורכומין הדגים פעילות אנטי סרטנית סינרגיסטית עם טיפולי רדיותרפיה על ידי עיכוב NFkB.
הריוֹן
קיימת מחלוקת בנושא.
מקורות ספרותיים מסוימים מציינים כי הכורכום מתאים לשימוש בהריון(27,30).
במגוון מחקרים בבעלי חיים שונים שצרכו כורכום לא נצפו כל רעילות או השפעה טרטגונית(40,44,229-230).
עם זאת, מקורות אחרים מביעים חששות תיאורטיים לשימוש בכורכום בזמן ההריון, בטענה כי כורכום הינו אמנגוג (ממריץ רחם) ועלול לגרום להפלה(29,33,231).
הנקה
כורכום מתאים לשימוש בהנקה(27,30).
במחקר קליני כפול-סמיות מבוקר פלסבו(232), בו השתתפו 63 נשים מניקות הסובלות ממסטיטיס (דלקת בשד) אשר חולקו באופן אקראי לשימוש בקרם כורכומין כל 8 שעות במשך 3 ימים או לפלסבו, נמצא כי לאחר 72 שעות חל שיפור מובהק בקבוצת הכורכומין בהשוואה לפלסבו בתסמיני הדלקת, ללא תופעות לוואי.
מחקרים ומנגנונים
הקדמה
כורכום הוא אחד הצמחים הנחקרים ביותר. חיפוש בפאבמד מניב מעל 3000 תוצאות. אף על פי כן, מספר המחקרים הקלינים האיכותיים, ויותר מכך היכולת להסיק מסקנות חד משמעיות בנוגע ליעילות הצמח במצבי חולי שונים מצומצמים בהרבה. הסיבות לכך הן השונות הגדולה בין המחקרים, בעיות מתודולוגיות בתכנון המחקרים, גודל מדגם קטן, משך התערבות קצר והעדר בקרה ואקראיות.
בעיה מרכזית נוספת היא זמינות ביולוגית נמוכה של כורכום ושל הרכיב הפעיל כורכומין, שעליה מנסים להתגבר באמצעים שונים ומגוונים (ראו סקירה כאן). בשנים האחרונות, אנו עדים להתפתחויות טכנולוגיות מבטיחות המובילות להצלחות טיפוליות, אך בהשוואה לפוטנציאל הטיפולי העצום כפי שעולה משלל המחקרים הפרה-קליניים, הדרך למציאת אופני השימוש המיטביים ולהוכחת יעילות קלינית חד משמעית עוד ארוכה.
בהמשך נסקור את מרבית המחקרים הקליניים והפרה-קליניים לפרוטרוט אולם על מנת להקל על הקוראים, ריכזנו תחילה את עיקרי הממצאים:
סרְטן - מספר מחקרים מצביעים על פוטנציאל של הצמח במניעת סרטן במצבים טרום סרטניים או באוכלוסיות בסיכון הודות לפעילות נוגדת חמצון, נוגדת דלקת ואנטי מוטגנית, אך לרוב מדובר במחקרים מצומצמי היקף וקצרי טווח. כמו כן, ישנו מספר מצומצם יחסית של מחקרים קליניים, לרוב בעלי איכות מתודולוגית ירודה, המצביעים על הפוטנציאל של הצמח לבדו (לעתים בשילוב רכיבים צמחיים נוספים) או בשילוב טיפולים קונבנציונאליים בטיפול בסרטן, אך העובדה כי לא תמיד נבחנה השְפעת הצמח על המצב המחלתי אלא על מרקרים שונים לדלקת או לעקה חמצונית, לא מאפשרת הסקת מסקנות חד משמעית לגבי יעילות הצמח. לבסוף, מספר מחקרים קליניים מעידים על התרומה של כורכום ורכיביו (לרוב באפליקציה חיצונית או בשילוב עם צמחים נוספים בנטילה פנימית) למניעת תופעות הלוואי המתלוות לסרטן עצמו ולטיפולים הקונבנציונאליים: כיבים ברירית חלל הפה ורגישות עורית ודרמטיטיס כתוצאה מטיפולי הקרנות, עייפות, בחילות והקאות, שלשול או עצירות, אובדן תאבון וירידה במשקל, פגיעה בזכרון או שינויים קוגניטיביים, רגישות לזיהומים/אלח דם, נויטרופניה, תסמינים של פגיעה לבבית כתוצאה מהמצב המחלתי ומתרופות כימותרפיות. גם במקרה זה האיכות המתודולוגית הירודה של חלק מהמחקרים והעובדה שכורכום ניתן בשילוב עם רכיבים נוספים פוגמת בהסקת מסקנות חד משמעיות לגבי יעילות הצמח בהפחתת תופעות הלוואי.
ויסות חיסוני - בחינה של המחקרים הקליניים, שלל מחקרי בעלי החיים ומחקרי המעבדה מעלה כי עיקר הפעילות של כורכום היא מווסתת חיסון ונוגדת דלקת, וההשפעה הממריצה על מערכת החיסון היא שולית ביותר ונוטה להגברת פעילות זרוע החיסון Th1 כלפי תאים סרטניים (ראו גם מנגנוני פעולה בסרטן, כאן). במצבי תגובתיות יתר של מערכת החיסון עיקר ההשפעה של כורכום היא דיכוי פעילות מונוציטים/מקרופג'ים ותאים דנדריטיים (של מערכת החיסון המולדת) והפחתת יכולתם להשרות תגובה חיסונית מאוקטבת (Th1/Th17/Th2) של מערכת החיסון הנרכשת. בנוסף, כורכום מווסת תגובות יתר חיסוניות של זרועות החיסון Th1 ו-Th17 (לדוגמא טרשת נפוצה, סוכרת סוג 1, דלקת מפרקים שגרונית וקרוהן) ו-Th2 (לדוגמא בקוליטיס, בנזלת אלרגית ובאסתמה) בהתאם לצורך. מנגנון הפעולה העיקרי של כורכום בויסות חיסוני הוא עיכוב מסלול גורם השעתוק NFkB ועיכוב פעילות האנזימים Cox2 ו-5-LOX.
דלקוֹת מפרקים - שלושה עשר מחקרים קליניים שבחנו את יעילות תכשירי כורכום לבדם או בשילוב רכיבים נוספים בטיפול בדלקת מפרקים ניוונית הדגימו יעילות מובהקת בשיפור התסמינים (כאב, נוקשות, תפקוד) בהשוואה לפלסבו, במידה המשתווה לטיפול תרופתי בנוגדי דלקת לא סטרואידיים (NSAID’s) וללא תופעות הלוואי האופייניות לשימוש בתרופות, אך חלק מהמחקרים סבלו מבעיות מתודולוגיות והעדר בקרה הפוגמים בתוקף הממצאים. יעילות הכורכום יוחסה לפעילותו כנוגד דלקת וכמפחית עקה חמצונית. מחקר יחיד הדגים יעילות של תוסף כורכומנואידים בטיפול בתסמיני המחלה ובמדדי הדלקת. כמו כן, שני מחקרים שהשוו את יעילות כורכומין לטיפול התרופתי בטיפול בדלקת מפרקים שגרונית הדגימו יעילות המשתווה לתרופות ואף עולה עליהן בשיפור התסמינים, ומחקר אחד בחן את השְפעת הכורכומין גם על מדדי הדלקת והדגים יעילות בהפחתת מדד ה-CRP אף יותר מאשר בעקבות הטיפול התרופתי.
מחלוֹת מעִי דלקתיות - חמישה מחקרים מעידים על יעילות מסוימת של כורכום בשילוב עם הטיפול התרופתי בהקלה בתסמיני קוליטיס קלה עד בינונית (שיפור היציאות, הפחתת כאבים), בהשגת הפוגה מהמחלה ובשמירה על הפוגה, בשיפור מצב המעי ובהפחתת מדדי דלקת. עם זאת, לא ברורה יעילות הצמח לבדו. כמו כן, שני מחקרים בלבד מתייחסים לטיפול באמצעות כורכום במחלת הקרוהן, ולפי המחקרים הללו נראה כי הצמח עשוי להועיל להקלה בתסמינים ולשיפור מדדי הדלקת הודות לפעילותו מווסתת החיסון.
גסטרִיטיס/כִיבים פפטיים/הלִיקובקטר - במספר מחקרים קליניים שבהם ניתנו כורכום או כורכומין כתוספת לטיפול התרופתי (סותרי חומצה והטיפול האנטיביוטי המשולש) הודגמה יעילות של משלב התרופות והצמח בשיפור תסמיני דיספפסיה, אך לא היה לצמח ערך מוסף במיגור חיידק ההליקובקטר פילורי. לעומת זאת, נתקבלו ממצאים סותרים בין מחקרים שונים לגבי יעילות כורכום בשיפור התסמינים ובריפוי הכיבים הפפטיים כשהצמח ניתן לבדו. מחקרי מעבדה ובעלי חיים הדגימו עיכוב ואף סילוק של חיידק ההליקובקטר פילורי על ידי עיכוב גידולו והיצמדותו לסעיפי הקיבה.
תִסמונת המעִי הרגיש – מספר מצומצם של מחקרים מעיד על יעילות כורכום לבדו או בשילוב עם רכיבים צמחיים נוספים בהקלה על תסמיני דיספפסיה ומעי רגיש, אך שילוב צמחים נוספים בפורמולה ובעיות מתודולוגיות בתכנון המחקרים לא מאפשרים הסקת מסקנות חד משמעית לגבי הכורכום לבדו. לכורכום השפעה נוגדת עווית במערכת העיכול דרך השפעה ישירה על פעילות מתווכים עצביים (היסטמין, אצטיל כולין וסרוטונין) במעי, והוא מעודד הפרשת אנזימי עיכול מהלבלב ומצי מרה מכיס המרה. פעילות זו מיוחסת לרכיבים המרירים ארומתיים בצמח. הפעילות נוגדת החמצון ונוגדת הדלקת של כורכום ושל כורכומין תומכת בעקיפין בפעילות סרוטונין במערכת העיכול ובתקשורת שבין מערכת העיכול והמוח. לבסוף, לכורכום פעילות אנטי מיקרוביאלית כנגד מגוון רחב של חיידקים, טפילים ופטריות שעלולים לגרום או להחריף תסמיני דיספפסיה.
מחלות כבד וכיס המרה - מספר מחקרים קליניים מלמדים על השפעה מיטיבה של כורכום על פעילות הכבד וכיס המרה. כורכום מסדיר הפרעות בתפקוד הכבד הודות לפעילות נוגדת חמצון ונוגדת דלקת ומשפר מדדים מטבוליים בכבד שומני, מעודד את כיווציות כיס המרה ומסדיר את הפרשת המרה. מחקרים פרה-קליניים מדגימים הגנה על הכבד מפני שחמת, לייפת (פיברוזיס) והשפעות רעילות של חומרים שונים.
סוכרֶת והתסמונת המטבוֹלית - ממצאי המחקרים הקליניים אינם תומכים בהשפעה ההיפוגליקמית של כורכום, אולם כורכום וכורכומין נמצאו יעילים במניעת סוכרת בקרב נבדקים טרום סוּכרתיים על ידי הגברת הפרשת האינסולין מתאי הלבלב, הפחתת תנגודת לאינסולין והעלאת רמת האדיפונקטין.
כמו כן, כורכום לבדו או בשילוב עם רכיבים צמחיים נוספים נמצא יעיל בהפחתת סיבוכי סוכרת כגון נוירופתיה, נפרופתיה, כבד שומני, ירידה בתפקוד קוגניטיבי, מחלת כלי הדם הקטנים, וטרשת עורקים הודות לפעילות נוגדת דלקת ונוגדת חמצון. עם זאת, קיימת מחלוקת במחקרים לגבי יעילות כורכום וכורכומין לירידה במשקל ובייחוד להפחתת השומן הבטני, לאיזון רמות הכולסטרול והטריגליצרידים ולהפחתת הסיכון לתחלואה קרדיווסקולרית.
מחלוֹת לב וכלי דם - מחקרים קליניים הדגימו כי כורכומין משפר את פרופיל השומנים בדם, מפחית חמצון שומנים, משפר את תפקוד כלי הדם על ידי הפחתת תהליכים דלקתיים בעורקים, הפחתת הומוציסטאין והגברת הזמינות הביולוגית של חנקן חמצני (NO), משפר את זרימת הדם ומפחית את לחץ הדם הסיסטולי. ממחקרים פרה-קליניים עולה כי כורכומין מפחית פגיעות בשריר הלב הודות לפעילותו נוגדת החמצון ומפחית פגיעות בכלי הדם עקב סוכרת הודות לפעילות נוגדת דלקת.
תפקוד קוגנִיטיבי עצבי - מספר מחקרים קליניים ומחקר אפידמיולוגי אחד תומכים ביעילות כורכום וכורכומין הניתנים לבדם או בשילוב עם רכיבים נוספים בשיפור התפקוד הקוגניטיבי ובהפחתת דחק בקרב נבדקים בריאים, בטיפול בדלקת נוירוגנית הקשורה במיגרנות כרוניות, וכן במניעת הדרדרות קוגניטיבית בגיל המבוגר ובשלבים הראשונים להתפתחות דמנציה ואלצהיימר. כמו כן, ברוב המחקרים מלבד אחד הודגמה יעילות מובהקת של הצמח בשיפור מדדי דיכאון וחרדה בהשוואה לפלסבו ובאופן המשתווה לתרופות, ללא תופעות הלוואי השליליות של הטיפול התרופתי. מחקרים פרה-קליניים רבים מלמדים כי הצמח יעיל במניעת התקדמות מחלות נוירודגנרטיביות שונות (אלצהיימר, פרקינסון, טרשת נפוצה ועוד) הודות להשפעותיו כנוגד חמצון (מעלה את רמת הגורם הנוירוטרופי המוחי ומעודד תהליכי תיקון והתחדשות של תאי העצב), נוגד דלקת ומווסת חיסון, סופח מתכות ומגן מפני רעילות חומרים שונים, משקם עצבי, מווסת רמות נוירוטרנסמיטרים (מעכב האנזים MAO המפרק נוירוטרנמיטרים מונואמינים – סרוטונין, נוראדרנלין ודופמין), מווסת ציר ההיפותלמוס-יתרת המח-אדרנל (HPA) ומפחית רמות קורטיזול.
כאבי שרירים וגידים - מספר קטן של מחקרים קליניים ופרה-קלינים מדגימים את יעילותו של כורכומין בהפגת כאבי שרירים כתוצאה מאימון גופני בעצימות גבוהה. כורכומין מפחית את פירוק השרירים (לפי רמת הקריאטין קינאז) ומצמצם את הדלקת והכאב הנלווים בזכות פעילותו נוגדת החמצון ונוגדת הדלקת. במחקר יחיד נוסף, כורכומין שניתן בשילוב עם רכיבים נוספים (MSM, קולגן, גליקוזמינוגליקנים, ל-ארגינין, ל-ליזין ולבונה) סייע לתהליכי ההחלמה ולהפחתת הכאב לאחר ניתוח לאיחוי קרע בגיד הכתף, אך לאור ריבוי הרכיבים בתוסף לא ניתן לייחס את ההשפעה באופן בלעדי לכורכומין.
מחלות חניכיים - מספר מחקרים בחנו את יעילות תכשירי כורכום וכורכומין בשימוש חיצוני בהשוואה לתכשירים סטנדרטיים (מבוססי כלורהקסידין) לטיפול בדלקות חניכיים כרוניות. מן המחקרים עולה כי כורכום בשילוב אמצעים מכניים (ניקוי אבנית) יעיל בהפחתת הרובד החיידקי, בטיפול בדלקת ובשיפור התסמינים הנלווים (דימום, אדמומיות) בזכות פעילותו נוגדת הדלקת והאנטי בקטריאלית ותכונתו המצמתת, אך בשל איכות מתודולוגית לוקה בחסר של המחקרים (בעיקר שימוש במינון לא מספק של כורכום) קשה לקבוע אם תכשירים מבוססי כורכום משתווים ביעילותם לתכשירים מסחריים מבוססי כלורהקסידין. עם זאת, השימוש בתכשירים מבוססי כורכום לווה בפחות השפעות שליליות בהשוואה לתכשירים הסטנדרטיים.
מחלות עיניים - בשלושה מחקרים קליניים הדגים כורכומין בשילוב עם הטיפול התרופתי יעילות טיפולית כנגד דלקות כרוניות ממקור זיהומי או אוטואימוני בעיניים: דלקת הענביה הקדמית ודלקת מדומה בארובת העין. כורכומין שיפר את תסמיני הדלקת והפחית את סיכויי הישנותה הודות לפעילותו נוגדת הדלקת ונוגדת החמצון. באחד המחקרים יעילות כורכומין השתוותה ליעילות הטיפול הקורטיקוסטרואידי, ללא תופעות הלוואי הכרוכות בטיפול מסוג זה.
מחלות כליה - כורכום הניתן לבדו או בשילוב עם רכיבים צמחיים נוספים משפר תסמינים (פרופיטוס-גרד, יתר לחץ דם והפרשת חלבון בשתן) של מחלות כליה כרוניות שונות כגון פגיעה כלייתית בסוכרת, תסמונת כלייתית עקב מחלת הזאבת, מגן על הכליות מפני לייפת ומוות תאי ומשפר סיכויי קליטה של כליות מושתלות על ידי פעילות נוגדת דלקת ונוגדת חמצון.
מחלות עור - מספר מחקרים קליניים מצביעים על יעילות כורכום לבדו או בשילוב עם צמחים נוספים (לרוב בשימוש חיצוני) במניעת הזדקנות העור, במניעת נזקי קרינה ובריפוי פצעים, ובטיפול בילפת שטוחה (ליכן פלנוס), פסוריאזיס וויטיליגו. כורכום פועל כנוגד דלקת וכנוגד חמצון, כמעכב שגשוג תאים, כאנטי מיקרוביאלי וכמעודד התחדשות הרקמות.
השפעה על מערכת המין הנשית - שני מחקרים מצביעים על יעילות כורכומין בהקלה על תסמינים קדם-וסתיים בהיבט הפיסי, הנפשי וההתנהגותי. יעילות הצמח מתבססת על השפעותיו נוגדות העווית, הדלקת והכאב (בשל יכולתו לעכב ייצור והפרשה של פרוסטגלנדינים), ועל יכולתו למנוע הפחתה בזמינותם של מתווכים עצביים (סרוטונין, דופמין ונוראדרנלין) בתגובה לתנודות אסטרוגן. כמו כן, מחקרים פרה קליניים מעידים על פעילות פיטואסטרוגנית אפשרית של כורכומין, חלשה פי 103 ביחס לאסטרוגן אנדוגני, כך שבעת קשירה לקולטני אסטרוגן שעל תאי סרטן השד ועל תאי רירית רחם אקטופיים באנדומטריוזיס, כורכומין מפחית את שגשוג התאים. סקירה הבוחנת את המחקרים הפרה-קליניים בנוגע ליעילות כורכומין בטיפול באנדומטריוזיס מצביעה על הפוטנציאל הקליני של הצמח בטיפול במחלה הודות לפעילותו נוגדת החמצון והדלקת, נוגדת שגשוג התאים ומשרת האפופטוזיס ונוגדת פלישת תאים ואנגיוגנזה.
בטא תלסמיה - שני מחקרים קליניים שנערכו בקרב חולי בטא תלסמיה מייג'ור ומינור מלמדים על יעילות מסוימת של כורכום ורכיביו בספיחת עודפי ברזל ופינויים, ובהפחתת העקה החמצונית הנובעת מהפרעות במשק הברזל. עם זאת, בשל בעיות מתודולוגיות בתכנון המחקר (גודל מדגם קטן, העדר אקראיות ובקרה) לא ניתן לקבוע בוודאות כי כורכום אכן יעיל לטיפול במחלה ונחוצים לשם כך מחקרים קליניים נוספים.
מחלות ריאה - נכון לזמן זה (דצמבר 2017) אין מחקרים קליניים העוסקים בטיפול באמצעות כורכום או כורכומין במחלות ריאה. עם זאת, בשלל מחקרים פרה-קליניים הודגמה יעילות של הצמח בטיפול בדלקות ריאה כרוניות על רקע אסתמה ו-COPD הודות לפעילות נוגדת דלקת, מווסתת חיסון, נוגדת חמצון ונוגדת לייפת (פיברוזיס) של כורכום.
מחלות זיהומיות - מספר לא מבוטל של מחקרי בעלי חיים ומחקרי מעבדה מלמד על פעילות אנטי מיקרוביאלית רחבה של כורכום כנגד שלל חיידקים, וירוסים, פטריות וטפילים. כורכומין משרה עקה חמצונית בסביבת הפתוגנים, מעכב את גדילתם והתרבותם, ופוגע במערכות ההגנה והתקשורת שלהם. מספר המחקרים הקליניים העוסקים ביעילות כורכום וכורכומין בטיפול במחלות זיהומיות הוא זעום. מלבד יעילות כורכום בשימוש חיצוני בטיפול בדלקות חניכיים שלה הקצינו סעיף נפרד (ראו כאן), מצאנו רק מחקר אחד העוסק בטיפול באמצעות כורכומין בשילוב עם רכיבים נוספים (Serenoa serrulata, Urtica dioica, קוורצטין) בדלקת חיידקית כרונית של הערמונית. במחקר זה הטיפול הצמחי הדגים יעילות מובהקת מול הטיפול האנטיביוטי בשיפור התסמינים ובשיפור איכות החיים של הנבדקים, אך לא ניתן ליחסה להשפעה בלעדית של הכורכום. בנוסף, שני מחקרים קליניים עסקו בפעילות האנטי נגיפית של הצמח: האחד בטיפול ב-HIV למשך שמונה שבועות בלבד אשר לא הדגים הפחתה בעומס הנגיפי אך מצא שיפור במצב הנבדקים לפי דיווחם. המחקר השני אשר בדק טיפול ב-HPV הדגים יעילות בשיפור התסמינים על ידי שימוש בקרם וגינלי המכיל כורכומין בשילוב עם צמחים נוספים, אך לא על ידי נטילה פומית של כמוסות כורכומין בהשוואה לפלסבו.
סרְטן
הקדמה | מחקרים קליניים | מנגנוני פעולה
הקדמה
מספר מחקרים מצביעים על פוטנציאל של הצמח במניעת סרטן במצבים טרום סרטניים או באוכלוסיות בסיכון הודות לפעילות נוגדת חמצון, נוגדת דלקת ואנטי מוטגנית, אך לרוב מדובר במחקרים מצומצמי היקף וקצרי טווח. כמו כן, ישנו מספר מצומצם יחסית של מחקרים קליניים, לרוב בעלי איכות מתודולוגית ירודה, המצביעים על הפוטנציאל של הצמח לבדו (לעתים בשילוב רכיבים צמחיים נוספים) או בשילוב טיפולים קונבנציונאליים בטיפול בסרטן, אך העובדה כי לא תמיד נבחנה השְפעת הצמח על המצב המחלתי אלא על מרקרים שונים לדלקת או לעקה חמצונית, לא מאפשרת הסקת מסקנות חד משמעית לגבי יעילות הצמח. לבסוף, מספר מחקרים קליניים מעידים על התרומה של כורכום ורכיביו (לרוב באפליקציה חיצונית או בשילוב עם צמחים נוספים בנטילה פנימית) למניעת תופעות הלוואי המתלוות לסרטן עצמו ולטיפולים הקונבנציונאליים: כיבים ברירית חלל הפה ורגישות עורית ודרמטיטיס כתוצאה מטיפולי הקרנות, עייפות, בחילות והקאות, שלשול או עצירות, אובדן תאבון וירידה במשקל, פגיעה בזכרון או שינויים קוגניטיביים, רגישות לזיהומים/אלח דם, נויטרופניה, תסמינים של פגיעה לבבית כתוצאה מהמצב המחלתי ומתרופות כימותרפיות. גם במקרה זה האיכות המתודולוגית הירודה של חלק מהמחקרים והעובדה שכורכום ניתן בשילוב עם רכיבים נוספים פוגמת בהסקת מסקנות חד משמעיות לגבי יעילות הצמח בהפחתת תופעות הלוואי.
מחקרים קליניים
מניעה | טיפול | תופעות לוואי
סרְטן - מניעה
מחקר קליני ראשוני (2001) בחן את בטיחות ויעילות הנטילה של כורכומין במינון גבוה כאמצעי למניעת סרטן בקרב 25 נבדקים בסיכון גבוה. 25 נבדקים (טווח גילאים 36-77) המוגדרים בסיכון גבוה לפתח סרטן. לנבדקים היו בין השאר נגעים טרום סרטניים בשלפוחית השתן, מחלת בואן של העור (שלב מוקדם ושטחי של סרטן תאי הקשקש), נגעים טרום ממאירים בצוואר הרחם, קרנת בוהקת (לויקופלקיה בחלל הפה), ומטפלזיה אינטסטינלית בקיבה (השתנות תאי האפיתל בקיבה למצב הדומה לתאי המעי). הנבדקים טופלו באמצעות תמצית תקנית של כורכום (מתוקננת להכיל 99.3% כורכומין בכל טבליה) במשך שלושה חודשים כאשר המינון ההתחלתי היה 500 מ"ג ליום והועלה בהדרגה ל-12 גרם ליום. בתום ההתערבות נבדקת אחת מתוך 4 נבדקות עם נגעים טרום סרטניים בצוואר הרחם, ונבדק אחד מתוך שבעה עם קרנת בוהקת בחלל הפה פיתחו סרטן למרות הטיפול בכורכומין. לעומת זאת, נצפה שיפור היסטולוגי במצב הנגעים הטרום סרטניים בקרב 1 מתוך 2 נבדקים עם נגעים בשלפוחית השתן, 2 מתוך 7 נבדקים עם קרנת בוהקת (לויקופלקיה) בחלל הפה, 1 מתוך 6 נבדקים עם מטפלזיה אינטסטינטלית בקיבה, 1 מתוך 4 נבדקות עם נגעים טרום סרטניים בצוואר הרחם ו-2 מתוך 6 נבדקים עם מחלת בואן של העור. תופעות רעילות דווחו החל ממינון של 8 גרם ליום, כשמתחת למינון זה כורכומין נסבל היטב והיה בטוח לשימוש. סך הכל נצפה שיפור היסטולוגי בקרב 7 מתוך 25 נבדקים (28%). השיפור נצפה בכל המינונים שנבדקו(38).
מחקר קליני (2016) אקראי כפול סמיות ומבוקר פלסבו בחן את יעילות כורכומין (BCM95–Biocurcumax) בנטילה פומית בטיפול בלויקופלקיה. 223 נבדקים הסובלים מקרנת בוהקת (לויקופלקיה – נגעים טרום סרטניים) בחלל הפה חולקו אקראית לקבלת כורכומין במינון 3.6 גרם ליום או פלסבו במשך שישה חודשים. תוסף הכורכומין הכיל תמצית תקנית מתוקננת להכיל 88% כורכומנואידים ו-7% שמנים אתריים המופקים מצמח הכורכום. בתום ההתערבות שיעור הנבדקים שחוו שיפור קליני מלא היה 67.5% בקבוצת הכורכומין בהשוואה ל-55.3% בקבוצת הפלסבו (p=0.03). כעבור שישה חודשים מתום ההתערבות שיעור המטופלים שלא חוו הישנות של הנגעים היה 88.9% בקבוצת הכורכומין בהשוואה ל-87.5% בקבוצת הפלסבו. לא נצפו הבדלים מובהקים בין כורכומין ובין פלסבו בבדיקה ההיסטולוגית (p=0.71), אך בשילוב התגובה הקלינית וההיסטולוגית לטיפול הודגם יתרון מובהק לכורכומין על פני פלסבו (p=0.02). המשך הטיפול בקרב נבדקים עם שיפור חלקי כעבור שישה חודשי טיפול לא הדגים שיפור נוסף. הטיפול באמצעות כורכומין היה בטוח(233).
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2010) בחן את יעילות השילוב של כורכומין ואיזופלבונים למניעת סרטן הערמונית בקרב נבדקים בסיכון גבוה. 85 נבדקים עם רמות אנטיגן ספציפי לערמונית PSA גבוהות ללא סרטן או השתנות טרום סרטנית חולקו אקראית לקבלת פלסבו או תוסף המשלב כורכומין במינון 100 מ"ג ליום ואיזופלבון סויה במינון 40 מ"ג ליום במשך שישה חודשים. בתום ההתערבות, בתת קבוצה של נבדקים עם ערכי PSA≥10 נצפתה ירידה מובהקת בערכי ה-PSA בהשוואה לפלסבו (p=0.01). החוקרים משערים כי שליטה ברמות הדלקת בערמונית, כפי שבאו לידי ביטוי ברמות האנטיגן הספציפי PSA היא שמונעת את התפתחות הסרטן(234).
מחקר קליני חד סמיות מבוקר פלסבו במבנה מוצלב (2009) בחן את יעילות כורכומין במניעת מיאלומה נפוצה בקרב נבדקים בשלב טרום סרטני (MGUS-Monoclonal gammopathy of undetermined significance). ב-MGUS תאי הפלסמה מהווים פחות מ-10% מתאי מח העצם ואין תסמיני מחלה. 26 נבדקים עם MGUS חולקו אקראית לשתי קבוצות ביחס של 2:1 לנטילת כורכומין במינון 4 גרם ליום (כורכומין 3600 מ"ג, DMT במינון 320 מ"ג, BDMT במינון 80 מ"ג) או פלסבו למשך שלושה חודשים ולאחר מכן הוצלבו הנבדקים לקבלת הטיפול הנגדי למשך שלושה חודשים נוספים. בתום ההתערבות נמצא שכורכומין הפחית את רמות הנוגדן החד שבטי (המיוצר על ידי תאי הפלסמה, מהווה סמן להתפתחות המחלה) בקרב עשרה מהחולים בקבוצת הכורכומין עם רמות נוגדן גבוהות מ-20 גרם/לדציליטר (הפחתה של 12-30% בקרב חמישה מהם). בקרב שאר הנבדקים שנטלו כורכומין (שבעה) לא חלה ירידה ברמת הנוגדן ובקרב הנבדקים שנטלו פלסבו (תשעה) לא חלה ירידה ובחלקם אף חלה עליה ברמת הנוגדן. בנוסף, בקרב 27% מהנבדקים בקבוצת הכורכומין חלה הפחתה של למעלה מ-25% בפירוק העצם (לפי הסמן N-telopeptide of type I collagen בשתן). מנגנון הפעולה של התוסף והשְפעתו על חלק מהנבדקים אך לא על כולם אינם ברורים מן המחקר(235).
מחקר קליני מבוקר פלסבו (2005) בחן את יעילות כורכומין בטיפול בדלקת לבלב כרונית (tropical pancreatitis). מדובר בדלקת כרונית האופיינית לאזורים אקלימיים טרופיים שמהווה גורם סיכון להתפתחות סרטן הלבלב. ישנה סברה שעקה חמצונית היא הגורמת להופעת הדלקת הכרונית בלבלב. 20 נבדקים נטלו כורכומין במינון 500 מ"ג ליום בשילוב עם פיפרין במינון 5 מ"ג ליום או פלסבו במשך שישה שבועות. בעקבות נטילת הכורכומין חלה ירידה מובהקת בחמצון השומנים (לפי רמת המלונדיאלדהידים) ועליה מובהקת ברמת הגלוטטיון בתאי הדם האדומים בהשוואה למצב הבסיס. עם זאת, לא נצפו שינויים ברמת הכאב שדווחו הנבדקים(236).
מחקר קליני מצומצם ובלתי מבוקר (2006) בחן את יעילות תוסף המשלב כורכומין וקוורצטין במניעת סרטן של המעי והחלחולת בקרב נבדקים הסובלים מתסמונת פוליפוזיס משפחתית (Familialadenomatous polyposis). זוהי תסמונת תורשתית המתאפיינת בהופעת מאות פוליפים במעי הגס ובחלחולת ומהווה גורם סיכון להתפתחות סרטן. חמישה נבדקים (בני 22-54) שעברו ניתוח שבו הוסר חלק מהמעי הגס ושאינם נוטלים סטרואידים נטלו כורכומין (סוג מיצוי לא צוין) במינון 1440 מ"ג וקוורצטין במינון 60 מ"ג ליום במשך שישה חודשים. בתום ההתערבות מספר הפוליפים פחת ב-60.4% (p=0.043) וגודלם פחת ב-50.9% (p=0.039) בהשוואה למצב הבסיס. הטיפול נסבל היטב ונרשמו תופעות לוואי קלות בלבד(237).
מחקר קליני לא מבוקר (2011) בחן את יעילות כורכומין בטיפול בנגעים מיקרוסקופיים טרום סרטניים במעי הגס (ACF-colonic aberrant crypt foci) בקרב מעשנים. 44 נבדקים מעשנים עם נגעים טרום סרטניים במעי הגס נטלו כורכומין במינון 2 או 4 גרם ליום במשך 30 ימים. 41 נבדקים השלימו את ההתערבות. בתום ההתערבות, בעקבות נטילה של שני המינונים לא נצפה שינוי ברמות איקוסנואידים פרו-קרצינוגנים (PGE2, 5-HETE) בדגימה של רקמת מעי נקייה מנגעים וברקמת מעי נגועה, אך נצפתה הפחתה מובהקת של 40% במספר הנגעים בעקבות נטילת כורכומין במינון הגבוה (p<0.005). כורכומין נסבל היטב בשני המינונים, אך דרושים מחקרים נוספים כדי לקבוע את מנגנון הפעולה של כורכומין במניעת סרטן המעי הגס בקרב מעשנים(238).
מחקר קליני אקראי מבוקר (2010) במערב בנגל בחן את יעילות כורכומין במניעת נזקי DNA בעקבות חשיפה לארסן. דגימות דם של 286 נבדקים בריאים (ללא תופעות רעילות) בני 25-55 באזורים החשופים לזיהום ארסן מתמשך הדגימו נזק משמעותי ל-DNA וכן יצירת ROS וחמצון שומנים. הנבדקים חולקו אקראית לקבוצת התערבות וקבוצת פלסבו. קבוצת ההתערבות נטלה כורכומין בשילוב פיפרין (יחס של 20:1) במינון של 2.5 גרם ליום במשך שלושה חודשים. בתום ההתערבות נמצא שכורכומין הפחית (p<0.001) את נזקי ה-DNA, רמות ה-ROS ואת חמצון השומנים בדמם של הנבדקים והגביר את פעילות האנזימים נוגדי החמצון (Catalase, SOD, glutathione reductase, glutathione S-tranferase, glutathione peroxidase) ואת רמות נוגדי החמצון הלא אנזימתיים בהשוואה לפלסבו(239).
במחקר קליני מבוקר (1992) נבחנה ההשפעה האנטי-מוטגנית של כורכום בקרב מעשנים. 16 מעשנים כרוניים נטלו אבקת כורכום במינון 1.5 גרם ליום במשך 30 ימים. בתום ההתערבות נצפתה הפחתה מובהקת בכמות החומרים המוטגנים המופרשים בשתן. לחילופין, בקרב שישה נבדקים לא מעשנים בריאים ששימשו כקבוצת ביקורת לא נצפה שינוי בהפרשת המוטגנים בשתן. לנטילת הכורכום לא היתה השפעה מובהקת על תפקודי הכבד (לפי רמות אנזימי הכבד בסרום AST ו-ALT) והכליה (לפי רמת הקריאטינין), ועל רמות הגלוקוז ופרופיל שומני הדם. מסקנת החוקרים היתה כי כורכום הנצרך בתזונה עשוי להיות יעיל בהפחתת גורמים מוטגנים ובמניעת סרטן(240).
מחקר קליני לא מבוקר (1998) בחן את יעילות הטיפול באמצעות כורכום למניעת סרטן החך בעקבות עישון הפוך (reverse smoking)*. נמצא שצריכת כורכום במינון של 1 גרם ליום במשך תשעה חודשים הפחיתה במובהק את מספר הנגעים הטרום סרטניים(241).
* מנהג הודי של החזקת הקצה הבוער של הסיגריה בתוך הפה.
סרְטן - טיפול
סקירה (2015) בחנה את כלל העדויות ביחס להשפעה האנטי-סרטנית של תרכובות פנוליות שונות, תוך התמקדות בכורכומין, רזברטרול, איזופלבונים, EGCG, אבקת פטל שחור, מיצוי אוכמניות שחורות, מיצוי ג'ינג'ר ומיצוי רימון. ממחקרי מעבדה ובעלי חיים עולה כי כורכומין הינו הרכיב התזונתי המבטיח ביותר כטיפול תומך בסרטן קולורקטלי כאנטי דלקתי, נוגד חמצון, משרה אפופטוזיס, מונע שגשוג נדידה ופלישה של תאים ומפחית נזקים ל-DNA. מתוך 17 מחקרים קליניים רשומים, תשעה פורסמו ורק חמישה מתוכם הצביעו על יעילות של כורכומין או כורכומינואידים במניעת תהליכים או הפחתת סמנים הקשורים בהתפתחות סרטן קולורקטלי. החוקרים סבורים שהסיבה לכך קשורה בזמינות הביולוגית הנמוכה של כורכומין ובחוסר היציבות הכימית שלו. החוקרים מסכמים כי באופן כללי מחקרים קליניים מספקים תמיכה קלושה לגבי היעילות של תרכובות פנוליות כנגד סרטן קולורקטלי ומסבירים כי נדרשים מינונים גבוהים מאוד על מנת לגרום להשפעה בעלת משמעות קלינית(242).
מחקר קליני(243) אקראי כפול סמיות ומבוקר פלסבו (2014) בחן את יעילות הטיפול בסרטן באמצעות תוסף כורכומנואידים המתווסף לטיפול הכימותרפי. שמונים נבדקים חולי סרטן בעלי גידולים מוצקים (solid tumors) המטופלים בטיפול כימותרפי חולקו אקראית לנטילת תוסף כורכומנואידים עם זמינות ביולוגית משופרת (סוג מיצוי לא ידוע) במינון 180 מ"ג ליום או פלסבו במשך שמונה שבועות. בתום ההתערבות נמצא כי תוסף הכורכומנואידים היה יעיל יותר במובהק מפלסבו בשיפור איכות החיים של הנבדקים (p<0.001) ובהפחתת (p<0.001) מדדי הדלקת TNFΑ, הפחתת (p<0.001) גורם הגדילה TGFβ, הפחתת (p<0.001) החלבון הכימוטקטי למונוציטים MCP-1, CRP, והפחתת (p=0.005) מדדי הכאב substance P, והפחתת (p<0.001) הפפטיד הקשור לגן הקלציטונין CGRP. בנוסף, לתוסף הכורכומנואידים נצפה יתרון לא מובהק (p=0.061) על פני פלסבו בהפחתת רמת הציטוקין הפרו דלקתי IL-6. עם זאת, לפלסבו נצפה יתרון מובהק (p=0.012) על פני תוסף הכורכומנואידים בהפחתת רמת הציטוקין IL-8.
מחקר קליני אקראי מבוקר פלסבו (2011) בחן את יעילות כורכומין בטיפול בסרטן המעי הגס והחלחולת. 126 נבדקים שאובחנו כסובלים מסרטן המעי הגס והחלחולת לפני ניתוח חולקו אקראית לנטילת כורכומין (סוג מיצוי לא צוין) במינון 1080 מ"ג ליום או פלסבו למשך 10-30 ימים. נמצא שנטילת כורכומין העלתה את משקל הגוף של הנבדקים (p<0.05), הפחיתה (p<0.05) את רמת ה-TNFɑ, העלתה את ביטוי הגן נוגד הגידולים p53 ברקמת הגידול (p<0.05) והגבירה אפופטוזיס של תאים סרטניים (p<0.05) בהשוואה לפלסבו(244).
מחקר קליני בלתי מבוקר (2001) בחן את יעילות מיצוי כורכום בטיפול בסרטן המעי הגס והחלחולת. 15 נבדקים עם סרטן המעי הגס והחלחולת בשלב מתקדם שלא מגיב לטיפול כימותרפי טופלו בתמצית תקנית של כורכום במינון הולך ועולה של 440-2200 מ"ג ליום (מינון שווה ערך ל-36-180 מ"ג כורכומין) במשך 2-4 חודשים. בעקבות הטיפול הושגה מחלה יציבה בחמישה מהמטופלים והפחתה משמעותית ברמות האנטיגן הקרצינואמבריוני (מדד לממאירות במערכת העיכול) במטופל אחד(245).
מחקר קליני לא מבוקר (2008) בחן את ההשפעה האנטי דלקתית והאנטי סרטנית של כורכומין בקרב חולי סרטן לבלב מתקדם. עשרים וחמישה נבדקים החולים בסרטן לבלב מתקדם נטלו כורכומין במינון 8 גרם ליום עד להתקדמות המחלה, כאשר בכל חודשיים שלב המחלה הוערך מחדש. 21 נבדקים השלימו את ההתערבות. מתוכם נטילת כורכומין הדגימה יעילות קלינית מובהקת בשני מטופלים בלבד: באחד מהם הושגה מחלה יציבה למשך למעלה מ-18 חודשים ובשני חלה נסיגה קצרת טווח אך משמעותית בגידול (73%) לצד עליה מובהקת (פי 4-35) ברמות הציטוקינים בסרום (IL-6, IL-8, IL-10 ו-IL-1). כורכומין הדגים אף הדגים פעילות נוגדת דלקת על ידי הפחתת הביטוי הגנטי של NFkB, Cox2 ועיכוב מסלול האיתות של גורם השעתוק STAT3 בתאים המונונוקליארים בדגימות הדם הפריפריות של הנבדקים (שהיו מוגבהים לפני ההתערבות בהשוואה לנבדקים בריאים). נטילה פומית של כורכומין נסבלה היטב אך נצפתה שונות גבוהה בזמינות הביולוגית של כורכומין בקרב הנבדקים(246).
במחקר פיילוט קליני אקראי כפול-סמיות מבוקר פלסבו (2017) נבדקה ההשפעה של טיפול ברכיבים טבעיים (כורכום, רזברטרול, תה ירוק ונבטי ברוקולי) על קצב עליית המדד PSA בקרב גברים עם הישנות ביוכימית של סרטן הערמונית, המאופיינים בעלייה בינונית ב-PSA. במחקר השתתפו 22 גברים עם זמן הכפלת PSA של 4-15 חודשים וללא עדות לגרורות. הנבדקים חולקו אקראית לקבוצת הטיפול או לקבוצת הפלסבו למשך 12 שבועות. הטיפול כלל נטילת 4 טבליות ליום מתוסף טבעי המכיל 100 מ"ג כורכומין, 30 מ"ג רזברטרול ו-100 מ"ג תה ירוק לטבליה, וכן 4 כמוסות ליום של נבטי ברוקולי מרוכזים (שווה ערך ל-8 גרם ליום נבטים טריים). בתום ההתערבות נמצא כי העמידה בפרוטוקול המחקר הייתה טובה מאוד והטיפול נסבל היטב, ללא הבדל בין הקבוצות ביחס להשפעות השליליות.
החוקרים מציינים כי לא הייתה ציפייה במחקר הפיילוט להבדלים מובהקים בין הקבוצות ביחס ל-PSA ולמדדים הקליניים. עם זאת, בניגוד למצופה, בקבוצת הטיפול נמצאה החמרה בזמן הכפלת ה-PSA, אך החוקרים מציינים כי ההבדל אינו מובהק סטטיסטית וטווח הטעות הינו גדול כך שהם מציעים להמשיך ולבחון את השפּעת תוספים אלה במחקר מבוקר בהיקף גדול יותר(247).
מחקר קליני לא מבוקר (1987) בחן את יעילות כורכום בנטילה פומית ובמריחה חיצונית בהקלה על תסמיני סרטן הפה ולויקופלקיה (נגעים טרום סרטניים המתאפיינים בשכבה לבנה מעובה ברירית חלל הפה). 62 נבדקים עם סרטן או נגעים טרום סרטניים בחלל הפה שלא הגיבו לטיפול הקונבנציונלי נטלו מיצוי אתנולי של כורכום (ריכוז המיצוי ומינון הנטילה אינם ידועים) ובנוסף מרחו משחה המכילה כורכומין על גבי הנגעים. נמצא שהטיפול באמצעות המיצוי והמשחה הפחיתו את הריח הנלווה לנגעים ב-90% מהמקרים והפחיתו את הגרד וההפרשות כמעט בכל המקרים. נגעים יבשים נצפו ב-70% מהמקרים, אך עוצמת הכאב ועובי הנגעים פחתו רק ב-10% מהמקרים. בקרב רבים מהנבדקים השְפעת הטיפול נמשכה מספר חודשים לאחר הפסקתו. תגובת לוואי לא רצויה נצפתה רק במטופל אחד(16).
סרְטן – הפחתת תופעות לוואי
מחקר קליני מבוקר (2014) בחן את יעילות ובטיחות השימוש בתוסף כורכומין פוספוליפידי (Meriva) לטיפול בתופעות הלוואי הנובעות מטיפולים כימותרפיים ורדיותרפיים בסרטן. במחקר השתתפו 160 נבדקים חולי סרטן בני 35-70 לאחר ניתוח המוגדרים במצב גופני נפשי ותפקודי טוב (ציון של 70 ומעלה בסולם קרנופסקי) ללא מחלות לב, סוכרת או תסמונת מטבולית, העוברים טיפולי כימותרפיה (5-fluorouracil, cisplatin, vinblastine, gemicitabine, CCNU, MOPP/ABVD/COPP) (סהכ 80 נבדקים) ורדיותרפיה (80 נבדקים). הנבדקים חולקו אקראית לנטילת תוסף כורכומין פוספוליפידי (המכיל 100 מ"ג כורכומנואידים ביחס DMT:BDMT:curcumin של 1:8:33 בהתאמה ו-200 מ"ג לציטין סויה) במינון 1500 מ"ג ליום או פלסבו במשך עד ארבעה חודשים (מתוכם לפחות 60 ימים ברציפות). 158 נבדקים השלימו את ההתערבות (2 נבדקים מקבוצת הכימותרפיה נשרו מסיבות לוגיסטיות שאינן קשורות לטיפול). בקבוצת הכימותרפיה נטילת כורכומין הפחיתה במובהק את תופעות הלוואי של הטיפול בהשוואה לקבוצת הביקורת: בחילות והקאות, שלשול או עצירות, אובדן תאבון וירידה במשקל, פגיעה בזכרון או שינויים קוגניטיביים, רגישות לזיהומים/אלח דם, נויטרופניה, תסמינים של פגיעה לבבית, צורך בנטילת תרופות לטיפול בתופעות הלוואי (p<0.05). בנוסף, כורכומין הפחית במובהק את העקה החמצונית בדמם של הנבדקים בעקבות הטיפול בהשוואה לקבוצת הביקורת (P<0.022) ובהשוואה למצב הבסיס (p<0.021). בקבוצת הרדיותרפיה נטילת כורכומין הפחיתה במובהק את תופעות הלוואי של הטיפול בהשוואה לקבוצת הביקורת: פגיעה ברקמות אפיתל, פגיעה בפה, גרון ושט ומעיים, כאבים וכיבים בפה ובגרון, קושי בבליעה, כאבים בושט, שלשול ובחילה, נפיחות/בצקת בגפיים התחתונות, עייפות כללית, חולשה, צורך בתרופות לטיפול בתופעות הלוואי (p<0.05). בנוסף, כורכומין הפחית במובהק את העקה החמצונית בדמם של הנבדקים בעקבות הטיפול בהשוואה לקבוצת הביקורת (p<0.022) ובהשוואה למצב הבסיס (p <0.021). הטיפול באמצעות כורכומין נסבל היטב והיה נטול תופעות לוואי(225).
מחקר קליני(248) אקראי כפול סמיות ומבוקר פלסבו (2013) בחן את יעילות כורכומין בהפחתת דלקת עור חמורה הנובעת מטיפולי רדיותרפיה (severe radiation dermatitis) בחולות סרטן השד. 30 נבדקות (גיל ממוצע 58.1) החולות בסרטן שד המוגדר כסרטן שד לא דלקתי או קרצינומה in situ והמטופלות בטיפולי רדיותרפיה (ללא כימותרפיה) חולקו אקראית לנטילה פומית של כורכומין במינון 6 גרם ליום או פלסבו במהלך הטיפולים. בתום ההתערבות נמצא כי כורכומין הפחית במובהק את חומרת הדלקת (לפי מדד RDS) בהשוואה לפלסבו (p=0.008). שיעור הנבדקות שסבלו מקילוף לח של העור (moist desquamation) בעקבות הטיפול היה נמוך יותר במובהק בקבוצת הכורכומין בהשוואה לקבוצת הפלסבו (28.6% לעומת 87.5%, p=0.002).
מחקר קליני (2013)(249) השוואתי אקראי חד סמיות ומבוקר בחן את היעילות של כורכום למניעה והקלה על מוקוזיטיס בפה כתופעת לוואי של טיפולי קרינה או כימותרפיה בחולי סרטן ראש וצוואר. 80 חולים חולקו אקראית לקבלת כורכום לגרגור (אבקת כורכום במינון 400 מ"ג מומסת ב-80 מ"ל מים מורתחים ומצוננים, מינון לשטיפה 10 מ"ל מן התמיסה) או טיפול תרופתי (פובידון יודין) במהלך טיפולי הקרינה/ כימותרפיה. במחקר נמצא כי שטיפת פה המכילה כורכום יעילה יותר מהטיפול התרופתי לדחייה ולהפחתת מוקוזיטיס בפה (p<0.001), כמו גם לשמירה על סדירות הטיפולים בארבעת השבועות הראשונים לטיפול (p<0.01) (מעבר לארבעה שבועות, לא נצפה הבדל מובהק בין הקבוצות) ושמירה על משקל הגוף (p<0.001).
מחקר קליני(250) אקראי ומבוקר (2014) בחן את היעילות של אבקת כורכום בשילוב עם דבש למניעה והקלה על מוקוזיטיס בפה כתופעת לוואי של טיפולי קרינה או כימותרפיה בחולי סרטן. 60 נבדקים חולקו לקבוצת התערבות שטופלה במריחה חיצונית של אבקת כורכום ודבש על הנגעים ולקבוצת ביקורת שלא טופלה במשך עשרה ימים. בתום ההתערבות נצפה יתרון מובהק לטיפול בהשוואה למצב הבסיס ולקבוצת הביקורת (p<0.05).
מחקר קליני לא מבוקר (2013) בחן את יעילות ובטיחות השימוש בתכשיר לשטיפת הפה המכיל כורכומין (Curcumall) לטיפול במוקוזיטיס של הפה בעקבות טיפולי כימותרפיה מבוססת doxorubicin בקרב ילדים חולי סרטן. שבעה ילדים ונערים חולי סרטן בני חמש ומעלה (בתנאי שטופלו ביחידה האונקולוגית פידיאטרית, גיל ממוצע 15.2) גרגרו 20 טיפות ליום של תכשיר לשטיפת הפה (שהכיל תמצית כורכומין C3 בריכוז 95% ומיצויים של כורכום וג'ינג'ר מומסים בגליצרין ובאלכוהול בריכוז 0.4%, מינון שווה ערך ל-330 מ"ג כורכומין ליום) בנוסף לתכשיר לשטיפת הפה הסטנדרטי chlorhexidine 0.2% במהלך טיפולי הכימותרפיה במשך 21 ימים. ארבעה מתוך חמישה נבדקים פיתחו מוקוזיטיס של הפה אך בדרגת חומרה קלה. בקרב כל הארבעה חומרת המוקוזיטיס פחתה בהשוואה למצב ההתחלתי ולחומרה המדווחת הספרות. החוקרים מציינים כי בהעדר קבוצת ביקורת לא ניתן ליחס את התוצאות לכורכומין בוודאות ולא למאפיין אחר של האוכלוסיה כגון התחדשות תאים מהירה בקרב ילדים(251).
מחקר פיילוט לא מבוקר (2015) בחן האם השילוב של צמחי מרפא הידועים כמעוררי תיאבון מסייעים להפחתת אנורקסיה בחולי סרטן מתקדם, שאינם מטופלים בכימותרפיה. במחקר השתתפו 17 חולים אשר נטלו 1 גרם ג'ינג'ר (Zingiber officinalis) ו-1 גרם כורכום (Curcuma longa) פעמיים ביום, וכן 1 מ"ל מיצוי אלכוהולי של ג'נטיאן (Gentiana lutea) שלוש פעמים ביום, למשך 14 ימים. 3 חולים נוספים נטלו ג'ינג'ר וכורכום במינונים זהים, ללא ג'נטיאן. מתוך 20 המשתתפים, רק 7 סיימו 14 ימי טיפול; שאר המשתתפים הפסיקו את הטיפול לאחר כמה ימים, בעיקר בשל תופעות לוואי. תופעת הלוואי השכיחה ביותר הייתה בחילה, כאשר המשתתפים דיווחו גם על הקאות, חולשה, שלשול וחוסר נוחות בבטן. יתרה מכך, הטיפול לא נמצא יעיל לשיפור התיאבון. החוקרים מציעים כי במחקרים עתידיים יש לצמצם את הרכיבים או המינונים על מנת להפחית את תופעות הלוואי(252).
מנגנוני פעולה
הקדמה
בשלל מחקרי בעלי חיים ומחקרי מעבדה כורכום ורכיביו הפעילים הדגימו פעילות אנטי סרטנית כנגד סוגי סרטן רבים: המעי הגס, הערמונית, הכבד, הקיבה, הריאות, המוח, לויקמיה, הלבלב, העור, השחלות, השד, הראש והצוואר.
מנגנוני הפעולה של כורכום במניעה ובטיפול בסרטן כוללים פעילות ציטוטוקסית ישירה, עיכוב שגשוג תאים והשריית אפופטוזיס, מניעת אנגיוגנזה ופולשנות תאים סרטניים, פעילות נוגדת דלקת ונוגדת חמצון וחיזוק ההגנה החיסונית.
בנוסף, כורכום מסייע בהגברת יעילות הטיפול הקונבנציונלי ובמניעת תופעות לוואי על ידי חיזוק ההשפעה הציטוטוקסית, מניעת רעילות לבבית, הפחתת עקה חמצונית ונזקים חמצוניים, ומניעת עמידות תאים סרטניים לטיפול תרופתי ע"י עיכוב מנגנון P-gp (ראו כאן).
פעילות ציטוטוקסית ישירה
במחקרי מעבדה ובמחקרים בעלי חיים נמצא כי כורכומין מעכב התפתחות גידולים בסוגי סַרטן שונים: סַרטן המעי הגס, סַרטן הערמונית, סַרטן הכבד, סַרטן הקיבה, סַרטן הריאות, סַרטן המוח, לויקמיה, סַרטן הלבלב, סַרטן העור, סַרטן השחלות וסַרטן השד(253). זאת על ידי הארכת שלב המיטוזה (חלוקת התא) ופגיעה ב-DNA במהלכו(254), על ידי העלאת ביטוי גנים של חלבונים מדכאי גידולים (P53, p21) בתגובה לנזקי DNA והשריית אפופטוזיס ואוטופגיה(255-256).
בנוסף, כורכומנואידים במעבדה העצימו את ההשפעה הפוטוטוקסית של הקרנות בתחום האור הגלוי (visible light) על ידי השריית ייצור ROS במיטוכונדריה, פגיעה ב-DNA והשריית מוות תאי בשורות של תאים סרטניים אנושיים (תאי סַרטן צוואר הרחם, תאי סַרטן הכבד, תאי סַרטן השד, תאי סַרטן שונים מסוג קרצינומה ותאי סַרטן אפיתליים)(257).
עיכוב שגשוג תאים והשריית אפופטוזיס
כורכומין מעלה את הביטוי הגנטי של קולטנים על ממברנת התא הרגישים לסיגנלים לאפופטוזיס(258) כגון TNF אלפא, TRAIL (הידוע גם כ-TNF related apoptosis-inducing ligan) ו-FAS.
כורכומין מעכב מסלולים של קינאזים וגורמים מיטוגניים (STAT3, Akt, MAPK (p38, JNK1/2, ERK1/2 המגיבים לגירויי עקה חוץ תאיים, ציטוקינים וגורמי גדילה ומעודדים את הישרדות התאים ואת שגשוגם וכן מעכב את הפעלת המסלולים של גורמי השעתוק NFkB ו-AP-1 ועל ידי כך מעודד את עצירת מחזור החיים התאי ומשרה אפופטוזיס בתאים הסרטניים. כורכומין אף מפעיל את קולטן הגרעין וגורם השעתוק PPARγ המדכא את הפעלת NFkB, מעכב את שגשוג התא ומשרה אפופטוזיס(259-262).
כורכומין(242,263) מעלה את העקה החמצונית בתא (מעלה ROS) ועל ידי כך משרה גרימת נזק ל-DNA בתאים סרטניים, גורם עקה חמצונית ברשת התוך פלסמתית (ER) ומעודד אפופטוזיס מושרה על ידי המיטוכונדריה (שחרור ציטוכרוֹם C) דרך הפעלה של מסלול השעתוק JNK והעלאת ביטוי החלבון מדכא הגידולים p53.
כורכומין משרה הפחתת ביטוי של חלבונים נוגדי אפופטוזיס כגון Bcl-2 ו-Bcl-XL והגברת ביטוי חלבונים משרי אפופטוזיס כגון BAX שמובילים להפעלת קספאזות (אנזימים מפרקי תא) דרך עיכוב מסלול גורם השעתוק STAT3. הוא אף משפיע על ביטוי גנים של חלבונים המווסתים את שגשוג התא הסרטני: מפחית את ביטוי surviving ו-cdk1 המעודדים את שרידות התאים ומונעים אפופטוזיס. כל זאת על ידי עיכוב מסלול האיתות של חלבוני Notch המשרים שגשוג בתאים סרטניים(242,261-262).
עיכוב פלישת תאים סרטניים ומניעת אנגיוגנזה
כורכומין מעלה ביטוי של גנים (GSK-3b) המובילים לפירוק של בטא קטנין ומונעים את הצטברותו בגרעין התא. בטא-קטנין הוא רכיב במסלול איתות מולקולרי שבמצב תקין מאפשר לתא לזהות ולהיצמד לתאים דומים לו וליצור רקמה תקינה. כאשר בטא-קטנין נודד מפני שטח התא אל תוך התא ומצטבר בו בכמות חריגה, הוא מסייע להפעלת אונקוגנים (גנים סרטניים) כגון ציקלינים (המווסתים את מחזור חיי התא) ומטריקס מטלופרוטאינזות (המאפשרים נדידת תאים והתפתחות גרורות)(256,264-265).
כורכומין בעל השפעה מעכבת על אנזימים המזרזים סינתזה של חומצות שומן (Fatty acid synthase - FAS). במרבית הגידולים הסרטניים ישנו ביטוי יתר של אנזימים אלה והם קשורים בהתקדמות תהליכים סרטניים, ברמת האגרסיביות של הגידול ובהתפתחות גרורות. כורכומין משרה מוות של תאים סרטניים (אפופטוזיס) באמצעות עיכוב סינתזה של חומצות שומן (266-268).
כורכומנואידים ורכיבים נוספים בשמן הנדיף המופק מצמח הכורכום (tumerones) מונעים נדידה ופלישה של תאים סרטניים(269), על ידי עיכוב מסלולי הקינאזים MAPK (p38, JNK, ERK), PKC המובילים לעיכוב מסלול השעתוק של NFkB, STAT3 ו-AP-1, הפחתת הביטוי של חלבון האיתות Notch1 הקשור בשגשוג ובהתמיינות של תאים סרטניים(234), עיכוב של מטלופרוטאינזות MMP2 ו-MMP9 (מפרקי מטריקס בין תאי), עיכוב של vimentin (סיבים חלבוניים היוצרים את התשתית החלבונית של התא ומעורבים בשגשוג התא הסרטני), עיכוב מעבר של תאי אפיתל לתאים מזנכמליים (המאפשר את הפיכתם לתאים נודדים) ועיכוב ביטוי מולקולות הצמדות (N-cadherin, fibronectin, ICAM-1) המאפשרות הצמדות ופלישה של תאים סרטניים(256-257,261,270-271).
עיכוב המסלולים NFkB ו-STAT3 מוביל אף לעיכוב אנגיוגנזה(272-273) על ידי על ידי כך שהוא מעכב את גורם השעתוק HIF-1 הידוע גם כHypoxia-inducible factor-1, אשר ביטוי מוגבר שלו (בעקבות ירידה בזמינות החמצן בסביבה התאית) גורם לשעתוק גנים המעורבים באנגיוגנזה כגון ניטריק אוקסיד מושרה דרך ביטוי האנזים iNOSו-Cox-2, וגורמי גידול כגון גורם גידול תאים פיברובלסטים (FGF-β), וגורם גידול וסקולרי אנדותלי (VEGF).
פעילות נוגדת דלקת ונוגדת חמצון
כורכומין פועל כנוגד חמצון באופן ישיר(263,274) על ידי נטרול רדיקליים חופשיים ובאופן עקיף על ידי הפעלת אנזימים נוגדי חמצון אנדוגניים (כגון SOD, קטלאז, גלוטטיון פרוקסידאז וגלוטטיון רדוקטאז) ואנזימי הפאזה השניה בכבד המנטרלים רעלים ומפנים אותם מן הגוף, על ידי הפעלת מסלול השעתוק של חלבון Nrf2 והגברת ביטוי גנים של חלבונים המשתייכים למערך ההגנה מפני עקה חמצונית בתאים (Heme oxygenase-1, Heat shock proteins).
בנוסף, לכורכום ולכורכומין פעילות נוגדת דלקת נרחבת(275-279):
עיכוב הפעלה של גורם השעתוק NFkB – כורכום וכורכומין מעכבים הפעלה של גורם השעתוק NFkB האחראי לשעתוק גנים המעורבים בתגובות חיסוניות, בדלקת ובסרטן. בצורתו הלא פעילה NFkB קשור לחלבון IkB. בהשפּעת גורמים שונים בסביבת התא (לדוגמא גורמים מחמצנים, קרינת UV, ציטוקינים פרו דלקתיים המפעילים קולטני שער על ממברנות תאי חיסון במערכת החיסון המולדת) IkB מתפרק ו-NFkB נודד לגרעין התא, נקשר לרצף ה-DNA ומשפיע על ביטוי גנים פרו דלקתיים כגון COX2, פרוסטגלנדין (E2 (PGE2 וציטוקינים שונים המשפעלים את תאי מערכת החיסון. נמצא כי כורכומין מעכב את הפעלת NFkB על ידי TNFɑ דרך עיכוב זירחון ופירוק של IkB.
עיכוב ביטוי גנטי וייצור של מתווכים וציטוקינים דלקתיים - דרך עיכוב גורמי השעתוק NFkB ו-AP-1 כורכומין מעכב ביטוי גנטי וייצור של מתווכים דלקתיים (TNFɑ, הפחתת ייצור PGE2 דרך הפחתת ביטוי COX2, הפחתת ייצור LTB4 דרך הפחתת ביטוי 5-LOX, הפחתת ייצור ניטריק אוקסיד מושרה דרך הפחתת ביטוי ניטריק אוקסיד סינתאז) ושל ציטוקינים פרו דלקתיים (IL-1b, IL-2, IL-4, IL-5, IL-6, IL-8, IL-12, IL-13 , INFɣ) ומגביר ייצור של ציטוקינים הבולמים את התגובה החיסונית (IL-10).
כורכומין הוא אומנם הרכיב הנחקר ביותר בכורכום, אך בשנים האחרונות נחקרים(280-281) רכיבים ארומתיים נוספים בשורש כבעלי פעילות נוגדת דלקת ונוגדת סרטן כגון: β-יsesquiphellandrene ו-Turmerone.
חיזוק ההגנה החיסונית
פוליסכרידים שמוצו מן המיצוי המימי של צמח הכורכום השרו במעבדה פעילות בתאים מונונוקליארים פריפריאליים ועיכבו שגשוג בשורות של תאים סרטניים(282). נגזרת שהכילה כורכומנואידים ופוליסכרידים נמצאה יעילה כטיפול משלים לחולי סרטן שמערכת החיסון שלהם דוכאה בעקבות הטיפול הכימותרפי. בנוסף, כורכומנואידים וססקוויטרפנים שמוצו מהשמן האתרי של הצמח ( α-turmerone and Ar-turmerone) הפעילו במעבדה תאים מונונוקליארים פריפריים אנושיים, השרו ייצור ציטוקינים ועכבו שגשוג תאי סרטן הכבד והשד באופן תלוי מינון(257,283).
ויסות חיסוני כללי
הקדמה | מחקרים קליניים | מנגנוני פעולה
הקדמה
בחינה של המחקרים הקליניים, שלל מחקרי בעלי החיים ומחקרי המעבדה מעלה כי עיקר הפעילות של כורכום היא מווסתת חיסון ונוגדת דלקת, וההשפעה הממריצה על מערכת החיסון היא שולית ביותר ונוטה להגברת פעילות זרוע החיסון Th1 כלפי תאים סרטניים (ראו גם מנגנוני פעולה בסרטן, כאן). במצבי תגובתיות יתר של מערכת החיסון עיקר ההשפעה של כורכום היא דיכוי פעילות מונוציטים/מקרופג'ים ותאים דנדריטיים (של מערכת החיסון המולדת) והפחתת יכולתם להשרות תגובה חיסונית מאוקטבת (Th1/Th17/Th2) של מערכת החיסון הנרכשת. בנוסף, כורכום מווסת תגובות יתר חיסוניות של זרועות החיסון Th1 ו-Th17 (לדוגמא טרשת נפוצה, סוכרת סוג 1, דלקת מפרקים שגרונית וקרוהן) ו-Th2 (לדוגמא בקוליטיס, בנזלת אלרגית ובאסתמה) בהתאם לצורך. מנגנון הפעולה העיקרי של כורכום בויסות חיסוני הוא עיכוב מסלול גורם השעתוק NFkB ועיכוב פעילות האנזימים Cox2 ו-5-LOX.
מחקרים קליניים
פירוט המחקרים מופיע בסעיפים נפרדים, ראו להלן דלקות מפרקים, מחלות מעִי דלקתיות, טרשת נפוֹצה, מחלוֹת ריאה, נזלת אלרגִית.
מנגנוני פעולה
הגברת פעילות חיסונית | ויסות חיסוני ופעילות נוגדת דלקת
הגברת פעילות חיסונית
במעבדה פוליסכרידים שמוצו מן המיצוי המימי של צמח הכורכום השרו פעילות בתאים מונונוקליארים פריפריאליים ועכבו שגשוג בשורות של תאים סרטניים(282). נגזרת שהכילה כורכומנואידים ופוליסכרידים נמצאה יעילה כטיפול משלים לחולי סרטן שמערכת החיסון שלהם דוכאה בעקבות הטיפול הכימותרפי. בנוסף, במעבדה כורכומנואידים וססקוויטרפנים שמוצו מהשמן האתרי של הצמח (α-turmerone and Ar-turmerone) הפעילו תאים מונונוקליארים פריפריים אנושיים, השרו ייצור ציטוקינים ועכבו שגשוג תאי סרטן הכבד והשד באופן תלוי מינון(257,283).
ויסות חיסוני ופעילות נוגדת דלקת
לכורכום וכורכומין פעילות נוגדת דלקת נרחבת שבאה לידי ביטוי בויסות פעילות יתר הן של מערכת החיסון המולדת (מונוציטים/מקרופג'ים, תאים דנדריטיים) דרך עיכוב ביטוי של קולטני שער (TLR) על גבי תאים מציגי אנטיגנים וויסות הציטוקינים TNFɑ, IL-6 ו-IL-8, והן של מערכת החיסון הנרכשת (תאים לימפוציטים T ו-B, תאי NK) דרך השפעה על התמיינות תאי T מסייעים (Th) ותאי T רגולטוריים (Treg). כמו כן, כורכום וכורכומין יעילים בויסות פעילות חיסונית עודפת הן בזרוע החיסון התאית (זרועות חיסון Th1 וTh17-: ציטוקינים INFɣ, IL-1β, IL-2, IL-12, IL-17, IL-23) הבאה לידי ביטוי במחלות אוטואימוניות שונות כגון טרשת נפוצה, סוכרת סוג 1, דלקת מפרקים שגרונית, וקרוהן, ובמידה פחותה יותר בויסות פעילות חיסונית עודפת בזרוע החיסון ההמורלית (זרוע חיסון Th2: ציטוקינים IL-4, IL-5, IL-6, IL-10, IL-13) הבאה לידי ביטוי בקוליטיס, באלרגיות ובאסתמה. עם זאת בזאבת, המתבטאת אף היא בדומיננטיות של זרוע החיסון Th2 לא נמצאה השפעה על פעילות חיסונית הגורמת ליצירת נוגדנים עצמיים(284-286).
להלן פירוט המנגנונים העיקריים ויעדי ההשפעה של כורכום וכורכומין(284,286-288):
כורכומין מעכב מעכב את האנזים פוספורילאז קינאז ועל ידי כך מעכב מסלולי קינאזים STAT, MAPK (יERK, P38, JNK) וגורמי שעתוק דלקתיים AP-1, NF-κB ומגביר פעילות של גורמי שעתוק מפחיתי דלקת PPAR-γ. כתוצאה מכך מפחית כורכומין ייצור והפרשה של ציטוקינים דלקתיים (IL-1b, IL-2, IL-4, IL-5, IL-6, IL-8, IL-12, IL-13 TNFɑ,,INFɣ) ומגביר ייצור והפרשה של ציטוקינים נוגדי דלקת (IL-10), וכן מפחית ביטוי של גורמים כימוטקטיים ומולקולות הצמדות לתאים חיסון.
כורכומין מעכב את האנזים פוספוליפאז A2 המשחרר חומצה ארכידונית (המשמשת חומר מוצא לאיקוסנואידים: פרוסטגלנדינים, לויקוטריאנים ותרומבוקסנים) ממברנות התאים, מפחית את הביטוי הגנטי של האנזים COX2 (ובעקבותיו את ייצור PGE2), ושל האנזים 5-LOX (ובעקבותיו את ייצור LTB4), וכן מעכב את האנזים iNOS ויצור של ניטריק אוקסיד המושרה על ידי ציטוקינים.
דלקת מפרקִים נִיוונית/שגרונִית
הקדמה | סקירות שיטתיות | מחקרים – ניוונית | מחקרים - שגרונית | מנגנוני פעולה
הקדמה
חמש סקירות שיטטיות ושלושה עשר מחקרים קליניים שבחנו את יעילות תכשירי כורכום לבדם או בשילוב רכיבים נוספים בטיפול בדלקת מפרקים ניוונית הדגימו יעילות מובהקת בשיפור התסמינים (כאב, נוקשות, תפקוד) בהשוואה לפלסבו, במידה המשתווה לטיפול תרופתי בנוגדי דלקת לא סטרואידיים (NSAID’s) וללא תופעות הלוואי האופייניות לשימוש בתרופות, אך חלק מהמחקרים סבלו מבעיות מתודולוגיות והעדר בקרה הפוגמים בתוקף הממצאים. יעילות הכורכום יוחסה לפעילותו כנוגד דלקת וכמפחית עקה חמצונית. מחקר יחיד הדגים יעילות של תוסף כורכומנואידים בטיפול בתסמיני המחלה ובמדדי הדלקת. כמו כן, שני מחקרים שהשוו את יעילות כורכומין לטיפול התרופתי בטיפול בדלקת מפרקים שגרונית הדגימו יעילות המשתווה לתרופות ואף עולה עליהן בשיפור התסמינים, ומחקר אחד בחן את השְפעת הכורכומין גם על מדדי הדלקת והדגים יעילות בהפחתת מדד ה-CRP אף יותר מאשר בעקבות הטיפול התרופתי.
סקירות שיטתיות
במטה-אנליזה וסקירה שיטתית של מחקרים אקראיים מבוקרים (אוגוסט 2016) נבדקה התרומה של תוספי כורכום ורכיביו הפעילים (כורכומין, כורכומנואידים, פוליסכרידים) על תסמיני דלקת מפרקים ניוונית ודלקת מפרקים שגרונית. בסקירה נכללו שמונה מחקרים קלינים אקראיים מבוקרים, בשישה מהם נבדקה ההשפעה של אבקת כורכומין לעומת פלסבו ובארבעה מהם בוצעה השוואה לשימוש בתרופות נוגדות כאב. מינון הכורכום והכורכומין במחקרים השונים היה 1000-1500 מ"ג/יום בחלוקה ל-1-6 מנות ליום. מחקר אחד בחן יעילות תמצית של כורכום המתוקננת לפי תכולת הפוליסכרידים (12.5%) במינון 1000 מ"ג ליום. שלושה מחקרים דיווחו על הפחתה מובהקת (p<0.00001) בכאב המדווח על ידי הנבדקים בהשוואה לפלסבו (באמצעות סולם אנלוגי חזותי Pain visual analogue scale), ומטא אנליזה שכללה ארבעה מחקרים הדגימה הפחתה מובהקת בתסמיני המחלה על פי מדד WOMAC בעקבות הטיפול בכורכום/כורכומין בהשוואה לפלסבו (p=0.009). כמו כן, לפי מטא אנליזה שכללה חמישה מחקרים לא נצפה הבדל מובהק בין יעילות כורכום/כורכומין בהפחתת הכאב לבין תרופות קונבנציונאליות לשיכוך כאבים. 8 המחקרים שנכללו במטא אנליזה היו בעלי סיכון נמוך עד בינוני להטיה בממצאים. החוקרים מסכמים כי תוצאות המחקר תומכות ביעילות של כורכום/כורכומין במינון של כ-1,000 מ"ג/יום לטיפול בדלקות מפרקים, אולם על סמך המחקרים הקיימים (בשל מספרם, גודלם ואיכותם המתודולוגית) לא ניתן לקבוע מסקנות חד-משמעית ונדרשים מחקרים נוספים על מנת לאשש ממצאים אלה(289).
סקירה שיטתית (ינואר 2017) בחנה את יעילות כורכום בטיפול בדלקת מפרקים ניוונית. 8 מחקרים קלינים נכללו בסקירה. נמצא שבכל המחקרים מלבד אחד, תכשירים הכוללים כורכום היו יעילים במובהק בשיפור תסמיני דלקת מפרקים ניוונית (כאב, נוקשות, תפקוד) בהשוואה לפלסבו. השְפעת כורכום היתה דומה להשְפעת תרופות נוגדות דלקת לא סטרואידליוֹת ולגלוטמין. למרות המובהקות הסטטיסטית שהושגה במרבית המחקרים, גודל האפקט הקטן ומגבלות מתודולוגיות שונות אינם מאפשרים הסקת מסקנות חד משמעית(290).
סקירה (ינואר 2016) בוחנת את העדויות הקליניות והפרה קליניות ליעילות טיפול באמצעות חומרים נוגדי חמצון שונים בדלקת מפרקים ניוונית של הברך. 11 מחקרים קליניים מתייחסים לשימוש בכורכומין, חלקם סובלים מבעיות מתודולוגיות, חוסר אחידות בהגדרת המחלה ואבחונה וקושי בהסקת מסקנות בשל קושי באיתור המולקולות הפעילות, הבדלים במשך ההתערבות ובמספר הנבדקים, והעדר בקרה וסמיות. כל המחקרים מצביעים על יעילות בשימוש בכורכומין מלבד מחקר אחד שבו לא הושגה מובהקות בשל שונות גבוהה בין הנבדקים. בחלק מהמחקרים הושוותה יעילותו של כורכומין ליעילותן של תרופות נוגדות דלקת לא סטרואידיות (NSAID’s), כאשר כורכומין נמצא לא פחות יעיל, ולא גרם לתופעות הלוואי האופיניות לטיפול התרופתי. ביקורת עיקרית על המחקרים היא שמרביתם לא דיווחו על רמות הכורכומין בדמם של הנבדקים, על אף שהתייחסו לבעיית הספיגה והזמינות הביולוגית של כורכומין(291).
בסקירה שיטתית ומטה-אנליזה (2018)(292) של מחקרים אקראיים מבוקרים הוערכה היעילות והבטיחות של תוספיכורכומין ולבונה (Boswellia) - בהשוואה לפלסבו או לתרופות ממשפחת NSAIDs - לטיפול בדלקת מפרקים ניוונית בברך. בסקירה נכללו 11 מחקרים הכוללים בסך הכל 1,009 משתתפים, מתוכם חמישה מחקרים בהם נבדקה ההשפעה של תוספי כורכומין במינון 1,000-1,500 מ"ג/יום לעומת פלסבו, ארבעה מחקרים בהם נבדקה ההשפעה של תוספי לבונה במינון 100-1,000 מ"ג/יום לעומת פלסבו ושני מחקרים בהם נבדקה ההשפעה של מיצוי כורכום (Curcuma domestica) במינון 1,500-2,000 מ"ג/יום לעומת איבופרופן. באופן כללי, החוקרים מעריכים את איכות המחקרים כנמוכה, כאשר במרבית המחקרים נכללו פחות מ-100 משתתפים. בניתוח כולל של הנתונים נמצא כי הן תוספי כורכומין והן תוספי לבונה היו יעילים יותר מפלסבו להקלה על כאב ולשיפור התפקוד, ללא הבדלים מובהקים בהתייחס להיבטים של בטיחות. כמו כן, תוספי כורכום היו בעלי יעילות דומה ל-NSAID, אולם היו מלווים בשיעור נמוך יותר של הפרעות בדרכי העיכול. החוקרים מסכמים כי ממצאים אלה תומכים בשימוש בתוספי כורכומין ולבונה כחלק מהטיפול בדלקת מפרקים ניוונית בברך לשיפור יעילות הטיפול ולצמצום השפעות שליליות. עם זאת, נדרשים מחקרים נוספים באיכות מתודולוגית טובה על מנת לגבש המלצות לשימוש קליני ולבחון את ההשפעה הסינרגיסטית של תוספים אלה עם טיפולים נוספים.
סקירה (ספטמבר 2016) מדווחת על העדויות הפרה-קליניות והקליניות ליעילות מיצויים שונים של כורכום, כורכומנואידים וכורכומין בטיפול בדלקת מפרקים ניוונית. 15 מחקרים קליניים נכללו בסקירה. מתוכם 13 מחקרים קליניים מבוקרים, חמישה השוו את יעילות כורכומין לפלסבו, ארבעה השוו את יעילות כורכומין לתרופות נוגדות דלקת לא סטרואידליוֹת (ibuprofen, celecoxib, diclofenac sodium), שניים השוו את יעילות כורכומין לטיפול הקונבנציונלי המקובל, אחד השווה את יעילות כורכומין לכונדרויטין ואחד נוסף השווה את יעילות כורכומין לגלוקוזאמִין ולפלסבו. שני המחקרים הנותרים לא כללו קבוצת ביקורת. בחלק מהמחקרים ניתן מיצוי כורכום לבדו, או בשילוב עם לבונה (Boswellia serrata), תוסף כורכומנואידים לבדו או בשילוב עם פיפרין, ותוסף כורכומנואידים עם זמינות ביולוגית משופרת. טווח המינונים של הכורכומין במחקרים נע בין 180 מ"ג ל-2000 מ"ג ליום. משך ההתערבות נע בין 4 שבועות עד 8 חודשים. החוקרים מסכמים שעל אף שחלק מהמחקרים כללו מספר מועט של נבדקים ומשך ההתערבות היה קצר, רוב המחקרים מדווחים על יעילות תוסף כורכומין בהפחתת כאב ובשיפור התפקוד של חולים בדלקת מפרקים ניוונית כבר לאחר 4 שבועות. יעילות התוסף לא היתה פחותה מזו של תרופות נוגדות דלקת (NSAIDs) וגלוקוזאמִין. ההשפעה המיטיבה של כורכומין בטיפול בדלקת מפרקים ניוונית מיוחסת לפעילותו נוגדת החמצון ונוגדת הדלקת(293).
מחקרים - דלקת מפְרקים ניוונית
מחקר קליני(80) מבוקר (יוני 2010) בחן את יעילות תוסף כורכומין פוספוליפידי (Meriva®) בטיפול בדלקת מפרקים ניוונית של הברך. 25 נבדקים הסובלים מדלקת מפרקים ניוונית של הברך שאובחנה בצילום רנטגן נטלו תוסף כורכומין עטוף בפוספוליפיד פיטוזומלי (כורכומין ופוספטידיל כולין ביחס 1:2) במינון 200 מ"ג ליום במשך שלושה חודשים ומצבם הושווה למצבם של 25 נבדקים בקבוצת ביקורת שלא טופלה. בתום ההתערבות, בקבוצת הטיפול באמצעות כורכומין חלה ירידה של 58% במדד המחלה הכללי (WOMAC) בהשוואה למצב הבסיס (p<0.05), וכן הוארך במובהק מרחק ההליכה על הליכון (p<0.05). בנוסף בקרב תת קבוצה של נבדקים בעלי CRP גבוה, נטילת כורכומין הפחיתה במובהק (p<0.05) את רמות ה-CRP.
במחקר קליני(81) מבוקר המשכי (דצמבר 2010) נבחנה יעילות התוסף על 50 נבדקים שאובחנו בצילום רנטגן כסובלים מדלקת מפרקים ניוונית של הברך ונטלו כורכומין עטוף בפוספוליפיד פיטוזומלי (כורכומין ופוספטידיל כולין ביחס 1:2 (במינון 200 מ"ג ליום במשך למעלה משמונה חודשים ומצבם הושווה למצבם של 50 נבדקים בקבוצת ביקורת שלא טופלה בכורכומין (אך טופלה בטיפול קונבנציונלי – פיזיותרפיה ותרופות). 89 נבדקים השלימו את ההתערבות. בתום ההתערבות בקבוצת הכורכומין חלה ירידה מובהקת בהשוואה למצב הבסיס במדד המחלה (WOMAC), ברמת מדדי הדלקת (אינטרלוקינים IL-1β, IL-6,שקיעת הדם ESR, אנטיגן מסיס CD40 ומולקולת ההצמדות לאנדותל-VCAM-1), בבצקות ובשיעור התלונות על אי נוחות עיכולית. וכן בשימוש בנוגדי דלקת לא סטרואידלים (NSAIDs), במשככי כאבים ובתרופות אחרות, בפניה לטיפולים לא תרופתיים, באשפוזים, יעוצים ובדיקות, ובעלויות הטיפול במחלה (p<0.05 בכל המדדים). בנוסף, בקבוצת הכורכומין חלה עליה מובהקת בהשוואה למצב הבסיס במרחק ההליכה על הליכון ובמצב התפקודי (ע"פ סולם קרנופסקי). לעומת זאת, בקבוצת הביקורת חל שיפור מובהק רק במרחק ההליכה על ההליכון בהשוואה למצב הבסיס (p<0.05).
*הערת מערכת: חסרונם של שני המחקרים האחרונים הוא העדר טיפול פלסבו ואי השוואה סטטיסטית בין הקבוצות בתום ההתערבות (between groups) שמאפשרת לבחון באיזו מידה הטיפול באמצעות כורכומין יעיל יותר מהעדרו/מהטיפול בקבוצת הביקורת.
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2016) בחן את יעילות תוסף כורכומנואידים בהפחתת העקה החמצונית בדלקת מפרקים ניוונית של הברך. 40 נבדקים הסובלים מדלקת מפרקים ניוונית של הברך בדרגה קלה עד בינונית חולקו אקראית לקבלת תוסף כורכומנואידים במינון 1500 מ"ג ליום בשילוב פיפרין במינון 15 מ"ג ליום או פלסבו במשך שישה שבועות. בתום ההתערבות נצפתה עליה מובהקת ברמות האנזים SOD בסרום (p<0.001), עליה כמעט מובהקת בריכוז הגלוטטיון (p=0.064) והפחתה מובהקת בחימצון השומנים MDA (P=0.044) בעקבות הטיפול באמצעות תוסף הכורכומנואידים בהשוואה לפלסבו(294).
מחקר קליני כפול סמיות מבוקר פלסבו (נובמבר 2014) בחן את יעילות תוסף כורכומנואידים בתוספת פיפרין (C3 complex) בטיפול בדלקת מפרקים ניוונית של הברך קלה עד בינונית. 53 נבדקים שגילם נמוך מ-80 חולקו אקראית לנטילת תמצית תקנית של כורכומנואידים (מתוקננת להכיל 95% כורכומנואידים לפחות) במינון 1500 מ"ג ליום משולבת עם מיצוי פיפרין (bioperine) במינון 15 מ"ג ליום או פלסבו במשך שישה שבועות. 40 נבדקים השלימו את ההתערבות. בתום ההתערבות נמצא כי כורכומינואידים יעילים יותר מפלסבו בהקלה על תסמיני דלקת מפרקים ניוונית של הברך (הפחתה (p=0.001) לפי מדד המחלה WOMAC , דיווח הנבדקים (p<0.001) באמצעות הסולם האנלוגי החזותי VAS , ומדד (p=0.013) הכאב והתפקוד LPFI). במסגרת מדד המחלה (WOMAC= Western Ontario and McMaster Universities Osteoarthritis Index) השיפור המובהק ביותר נצפה במדדי הכאב והתפקוד הפיסי (p<0.001), אך לא נצפה שיפור במדד נוקשות המפרקים (stiffness, p>0.05). הטיפול נסבל היטב ולא דווח על תופעות לוואי לא רצויות(295).
מחקר תצפיתי רטרוספקטיבי (אוקטובר 2014) בחן את יעילות תוסף כורכומין בעל זמינות ביולוגית גבוהה (Flexofytol®) לטיפול בדלקת מפרקים ניוונית. התוסף נועד לשפר את המסיסות של כורכומין בתנאי המעי ולשפר את ספיגתו על ידי שילוב תמצית כורכומין (מתוקננת להכיל 42 מ"ג כורכומין) עם חומר מתחלב (polysorbate 80) ליצירת מיקרו-אמולסיות בקיבה ובמעי לאחר עיכול הכמוסה. 820 נבדקים נטלו את התוסף במינון 4-6 כמוסות ליום למשך למעלה משישה חודשים. בתום שישה חודשים נמצא שהנבדקים חשו בשיפור מובהק בכאב, בתנועתיות המפרק ובאיכות החיים (p<0.0001). רוב הנבדקים (77.1%) חשו בשיפור כבר בתוך שישה שבועות. הטיפול נסבל היטב עם תופעות לוואי מעטות (לרוב עיכוליות), וכמחצית מהנבדקים הפסיקו ליטול משככי כאבים ותרופות נוגדות דלקת (p<0.0001). בתום שישה חודשים 79% מהנבדקים הביעו שביעות רצון מן הטיפול ו-41.7% הביעו נכונות להמשיך בטיפול למעלה משישה חודשים(296).
מחקר קליני(297) השוואתי אקראי חד סמיות מבוקר (אוגוסט 2009) בחן את יעילות תוסף כורכומנואידים בהשוואה לתרופה ibuprofen (תרופה ממשפחת ה-NSAID’s) בטיפול בדלקת מפרקים ניוונית של הברך. 107 נבדקים בני חמישים ומעלה הסובלים מדלקת מפרקים ניוונית של הברך מאובחנת עם דרגת כאב של חמש ומעלה (מתוך סולם בטווח של 0-10), חולקו אקראית לקבלת תמצית כורכום (המכילה 1 גרם כורכומנואידים) במינון 2 גרם ליום (52 נבדקים) או ibuprofen במינון 800 מ"ג ליום (55 נבדקים) במשך שישה שבועות. כל הנבדקים הונחו להפסיק כל טיפול תרופתי בדלקת המפרקים (NSAIDs, גליקוזמינוגליקנים) שבוע לפני ההתערבות. 45 נבדקים (86.5%) בקבוצת הכורכום ו-46 נבדקים (83.6%) בקבוצת התרופה השלימו את ההתערבות. בתום ההתערבות נצפה שינוי מובהק בשתי הקבוצות בהשוואה למצב הבסיס בכאב בהליכה במישור ובטיפוס במדרגות, במשך הזמן שנדרש ללכת 100 מטרים ולעלות ולרדת במדרגות (נתוני מובהקות ביחס למצב הבסיס לא צוינו). לא נצפו הבדלים מובהקים בין כורכום ובין ibuprofen בכל המדדים למעט במדד הכאב בעליה במדרגות, שם נצפה יתרון מובהק לכורכום (p=0.016). לא נרשמו הבדלים בין הקבוצות בדיווחים על תופעות לוואי לא רצויות (דיספפסיה, p<0.36) ובשביעות הרצון של הנבדקים מן ההתערבות (p<0.15). מסקנת החוקרים היתה שתוסף כורכום יעיל ובטוח לשימוש באותה מידה כמ וibuprofen בטיפול בדלקת מפרקים ניוונית של הברך. עם זאת, חשוב לציין שהיה הבדל מובהק בהיענות הנבדקים לטיפול, כאשר בקבוצת הטיפול התרופתי היענות הנבדקים היתה גבוהה יותר במובהק בהשוואה לקבוצת הכורכום (90.1% לעומת 80.4%, p<0.001).
*הערת מערכת: למחקר מספר מגבלות מתודולוגיות שעשויות להטות את הממצאים –מינון תת טיפולי של איבופרופן (800 מ"ג ליום), היענות לא שווה של הקבוצות לטיפול בגלל מספר שונה של כמוסות לנטילה ביום (2 כמוסות תרופה לעומת 4 כמוסות כורכום), וחד סמיות – מודעות הנסיין לטיפול שניתן לנבדקים.
המגבלות המתודולוגיות הללו קיבלו מענה במחקר המשך של אותה קבוצת חוקרים:
מחקר קליני(298) השוואתי אקראי כפול סמיות ומבוקר (מרץ 2014) בחן את יעילות ובטיחות תוסף כורכום בהשוואה לתרופה ibuprofen בהפחתת כאב ובשיפור התפקוד בדלקת מפרקים ניוונית של הברך. 367 נבדקים בני חמישים ומעלה (גיל ממוצע 60) הסובלים מדלקת מפרקים ניוונית של הברך מאובחנת רדיולוגית עם דרגת כאב של חמש ומעלה (מתוך סולם בטווח של 0-10), חולקו אקראית לנטילת תמצית כורכום (שתוקננה להכיל 75-85% כורכומנואידים) במינון 1500 מ"ג ליום (185 נבדקים) או ibuprofen במינון 1200 מ"ג ליום (182 נבדקים) במשך ארבעה שבועות. 331 נבדקים (160 בקבוצת התרופה ו-171 בקבוצת הכורכום) השלימו את ההתערבות. בתום ההתערבות, חל שיפור מובהק במדד המחלה (WOMAC Western Ontario and McMaster Universities Osteoarthritis Index) בשתי הקבוצות בהשוואה למצב הבסיס (p<0.001) ללא הבדל מובהק בין קבוצת הכורכום ובין קבוצת ה-ibuprofen במצב המחלה הכללי (p=0.326), בכאב (p=0.531), בנוקשות המפרקים (p=0.522) ובתפקוד (p=0.278). בשתי הקבוצות דווח על שיעור דומה של תופעות לוואי (35.7% בקבוצת התרופה לעומת 29.7% בקבוצת הכורכום, p=0.222), אך שיעור תופעות הלוואי העיכוליות או הבטניות בקבוצת ה-ibuprofen היה גבוה במובהק מאשר בקבוצת הכורכום (p=0.046). לא נרשם הבדל בין הקבוצות בהיענות הנבדקים לטיפול (p=0.202), בצורך בתרופות חירום לשיכוך כאבים (p=0.449) ובשביעות הרצון מהטיפול (p=0.707).
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (דצמבר 2016) בחן את השְפעת תוסף כורכום על מדדי דלקת ועקה חמצונית בדלקת מפרקים ניוונית של הברך. 160 נבדקים חולקו אקראית לקבלת תמצית כורכום (סוג מיצוי לא ידוע) במינון 1000 מ"ג ליום או פלסבו בנוסף לטיפול התרופתי (Diclofenac) במשך ארבעה חודשים. בתום ההתערבות נצפה יתרון מובהק של תמצית הכורכום על פני פלסבו בהפחתת תסמיני המחלה (WOMAC, Visual analog scale) בד בבד עם הפחתת מדדי הדלקת (IL-1beta) והעקה החמצונית (ROS, מלונדיאלדהידים)(p<0.05 בכל המדדים)(299).
מחקר אקראי כפול סמיות מבוקר פלסבו (ינואר 2012) בדק את השפּעת כורכומין בשילוב עם הטיפול הרגיל בנוגדי דלקת מסוג NSAIDS לטיפול בדלקת מפרקים ניוונית (OA) ראשונית בברכיים. 88 נבדקים חולקו אקראית לקבלת (NSAIDS (diclofenac 75 mg בשילוב עם פלסבו, או (NSAIDS (diclofenac 75 mg בשילוב עם כורכומין במינון 1000 מ"ג ליום במשך שלושה חודשים. 73 נבדקים השלימו את ההתערבות. בתום התקופה נמצא כי אלו שקיבלו תוספת כורכומין סבלו פחות מכאבים בברכיים, ודיווחו על איכות חיים משופרת, אם כי ללא מובהקות סטטיסטית(86).
מחקר קליני(300) השוואתי אקראי חד סמיות ומבוקר (אפריל 2012) בחן את השְפעת ג'ל כורכומנואידים שהופקו מכורכום בהשוואה לג'ל וולטרן (Diclofenac sodium) על הייצור וההפרשה של האנזים הפרו דלקתי COX2 מתאים מונוציטים בנוזל הסינוביאלי של נבדקים הסובלים מדלקת מפרקים ניוונית. 80 נבדקים (52 נשים ו-28 גברים, גיל ממוצע 64) הסובלים מדלקת מפרקים ניוונית של הברך בדרגה קלה עד בינונית חולקו אקראית למריחת ג'ל כורכומנואידים (100 מ"ג תמצית אתנולית יבשה למיליליטר ג'ל סיליקה) במינון 90 מ"ג ליום או וולטרן במינון 75 מ"ג ליום במשך ארבעה שבועות. 73 נבדקים השלימו את ההתערבות (34 בקבוצת הכורכומנואידים ו-39 בקבוצת הוולטרן). בתום ההתערבות, נצפתה ירידה מובהקת ברמות האנזים COX2 בשתי הקבוצות בהשוואה למצב הבסיס (p<0.001) ללא הבדל מובהק בין הקבוצות (p=0.89).
מחקר קליני השוואתי (אוגוסט 2013) בחן את היעילות של פורמולת צמחים מרפא שמכילה כורכום (Curcuma longa) ולבונה (Boswellia spp) לטיפול בדלקת מפרקים ניוונית. כל כמוסה של תוסף הצמחים הכילה 350 מ"ג תמצית תקנית של כורכום שתוקננה להכיל 70% כורכומין, 21.5% כורכומנואידים נוספים (demethoxycurcumin 17%, bis-demethoxycurcumin 3.5%) ו-7.5% שמנים נדיפים שמוצו משורש הכורכום, ובנוסף 150 מ"ג תמצית תקנית של לבונה שתוקננה להכיל 75% boswellic acid ו-10% Beta-boswellic acid, keto-beta-boswellic acid, acetyl-keto-beta-boswellic acid) AKBA). במחקר השתתפו 28 נבדקים (בני 18-65) הסובלים מדלקת מפרקים ניוונית של הברך בדרגה בינונית ויציבה. הם חולקו אקראית לנטילת הפורמולה הצמחית במינון 1 גרם ליום או התרופה Celecoxib ממשפחת ה-NSAID’s במינון 200 מ"ג ליום במשך 12 שבועות. בתום ההתערבות, הטיפול באמצעות הפורמולה נמצא יעיל יותר מנטילת התרופה במדדים של כאב (21.43% מהנבדקים בקבוצת הפורמולה הצמחית לעומת -50% מהנבדקים בקבוצת התרופה דיווחו על כאב בינוני עד חמור בתום ההתערבות), מרחק הליכה עד לכאב (92.86% מהנבדקים בקבוצת הפורמולה הצמחית לעומת 85.71% בקבוצת התרופה הצליחו מרחק הליכה של מעל לקילומטר ללא כאב) ורגישות המפרק למגע (92.85% מהנבדקים בקבוצת הפורמולה הצמחית לעומת 78.57% מהנבדקים בקבוצת התרופה דיווחו על שיפור ברגישות למגע), אך ללא הבדל מובהק בין קבוצות הטיפול בכל המדדים. כמו כן, הטיפול הצמחי היה יעיל באותה מידה כמו התרופה בהפחתת החריקות במפרקים והגדלת טווח התנועה. לא נצפתה השפעה של הטיפול הצמחי והתרופתי על מדדים של נפיחות, חום, צורת הליכה והיקף הירך מעל הברך. הטיפול בצמחי המרפא נמצא יעיל ובטוח לשימוש(301).
מחקר קליני פתוח ובלתי מבוקר (2014) בחן את ההשפעה של טיפול צמחי לטיפול בכאב עקב דלקת מפרקים ניוונית. במחקר נבדקו תוסף (AINAT) שהכיל מיצוי של ציפורני השטן (Harpagophytum procumbens) במינון 300 מ"ג (מתוכם 18 מ"ג harpagosides), כורכום (Curcuma longa) (מתוקנן להכיל 95% כורכומין) במינון 200 מ"ג וברומלין שמקורו באננס (סוג מיצוי לא צוין) במינון 150 מ"ג. 42 מטופלים (גיל ממוצע 67) הסובלים מכאב כרוני (למעלה משלושה חודשים) או אקוטי (פחות מ-15 ימים) התבקשו ליטול את התוסף במינון 3.9 גרם ליום לסובלים מכאב אקוטי (שתי כמוסות שלוש פעמים ביום), או 2.6 גרם ליום לסובלים מכאב כרוני (שתי כמוסות פעמיים ביום), למשך 15 יום לכאב אקוטי ו-60 יום לכאב כרוני. כל המשתתפים חוו הקלה מובהקת בכאב, גם מכאב כרוני (p<0.001) וגם מכאב אקוטי (p<0.001) בהשוואה למצב הבסיס, ללא תופעות לוואי. בתום התקופה כל המשתתפים דיווחו על מידת כאב שהופחתה עד כדי שנהייתה סבירה בעיני המשתתפים. החוקרים מסכמים כי השימוש בתוסף עשוי להיות אלטרנטיבה יעילה ובטוחה לטיפול תרופתי להפחתת כאב בחולי אוסטאוארטריטיס(302).
מחקר קליני(303) אקראי חד-סמיות ומבוקר פלסבו (דצמבר 2012) בחן את יעילות ובטיחות הנגזרת הפוליסכרידית שמוצתה מצמח הכורכום (Turmacin™) לטיפול בכאבים הנובעים מדלקת מפרקים ניוונית בברכיים. 120 נבדקים (בני 40 ומעלה) הסובלים מ-OA למשך תקופה של חצי שנה לפחות חולקו אקראית לקבלת פלסבו במינון 800 מ"ג ליום, תמצית תקנית של כורכום (מתוקננת להכיל %12.6 פוליסכרידים) במינון 1000 מ"ג ליום, או גלוקוזאמִין סולפט במינון 1500 מ"ג ליום, לבד או בשילוב עם מיצוי הכורכום, כל זאת למשך 42 יום. המחקר הראה כי השימוש בכורכום הראה הפחתה מובהקת ברמות הכאב ממנו סבלו המטופלים (p<0.05).
מחקרים - דלקת מפְרקים שגרונית
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (אוקטובר 2017) בחן את יעילות תוסף (Acumin) שיוצר בטכנולוגיית PNS (polar non-polar sandwich) בטיפול בדלקת מפרקים שגרונית. זהו למעשה סוג של ליפוזום שבו הכורכומנואידים עטופים בשמנים האתריים של צמח הכורכום עצמו ובתווך הנגזרת המימית הפולארית של הצמח. 36 נבדקים שאובחנו כסובלים מדלקת מפרקים שגרונית שאינם נוטלים תרופות חולקו אקראית לקבלת פלסבו או תוסף הכורכומנואידים במינון 250 או 500 מ"ג במשך 90 ימים. בתום ההתערבות נצפה שיפור מובהק בתסמינים הקליניים בעקבות נטילת המינון הנמוך והמינון הגבוה של התוסף בהשוואה למצב הבסיס (p<0.001 בשניהם) ובהשוואה לפלסבו (p<0.01). כמו כן נצפו שינויים מובהקים במדדי הדלקת הכלליים (ESR, CRP) והספציפיים למחלה (RF- rheumatoid factor) בהשוואה למצב הבסיס (p<0.001 בכל המדדים) ובהשוואה לפלסבו (p<0.01) בשתי קבוצות המינון. הטיפול נסבל היטב ולא דווח על תופעות לוואי בלתי רצויות(304).
מחקר קליני(305) השוואתי אקראי וכפול סמיות במבנה מצולב (אפריל 1980) בחן את יעילות הטיפול בדלקת מפרקים שגרונית באמצעות כורכומין בהשוואה לתרופה phenylbutazone ממשפחת נוגדי הדלקת הלא סטרואידיים (NSAID’s). שמונה עשר (18)נבדקים (טווח גילאים 22-48) שאובחנו כסובלים מדלקת מפרקים שגרונית חולקו אקראית לנטילת כורכומין (סוג מיצוי לא צוין) במינון 1200 מ"ג ליום או phnylbutazone במינון 300 מ"ג ליום במשך שבועיים. ארבעה ימים לפני ההתערבות הורו לנבדקים להפסיק ליטול טיפול תרופתי נוגד דלקת. בתום ההתערבות נצפה שיפור מובהק בנוקשות הבוקר, במשך ההליכה עד כאב ובנפיחות המפרקים בהשוואה למצב הבסיס בשתי הקבוצות (p<0.05), ללא הבדל מובהק ביניהן. הטיפול התרופתי שיפר בנוסף את משך הזמן מהקימה בבוקר ועד לדיווח על תחושת עייפות (p<0.05). שיפור מובהק במצב המפרקים הוערך על ידי הנסיין רק בקבוצת הכורכומין (p<0.05), ועל ידי הנבדקים רק בקבוצת הטיפול התרופתי (p<0.05).
במחקר קליני(83) אקראי חד סמיות (נובמבר 2012) נבחנה יעילות ובטיחות כורכומין (BCM-95®) לבדו ובשילוב עם התרופה וולטרן (diclofenac sodium) בטיפול בדלקת מפרקים שגרונית פעילה. טיפול תרופתי בסטרואידים, נוגדי דלקת לא סטרואידיים ומשככי כאבים הופסק בין חודש לשבועיים לפני ההתערבות. 45 נבדקים (גיל ממוצע 47.88) שאובחנו כסובלים מדלקת מפרקים שגרונית חולקו אקראי לקבלת תמצית תקנית של כורכומין (מתוקננת להכיל 86% כורכומנואידים ו-7-9% שמנים אתריים מצמח הכורכום) במינון 500 מ"ג, diclofenac sodium (במינון 50 מ"ג) או שילוב של שניהם למשך שמונה שבועות. 38 נבדקים השלימו את ההתערבות. בתום ההתערבות נצפו שינויים מובהקים סטטיסטית במדד פעילות המחלה (Disease activity score) בכל קבוצות הטיפול בהשוואה למצב הבסיס (p<0.05), ללא הבדל מובהק בין הקבוצות. יש לציין שאחוזי השיפור הגבוהים ביותר במדד פעילות המחלה (44.5%), במדד הכאב לפי סולם אנלוגי חזותי (59.9%) ובמדדי הכאב והנפיחות במפרקים (לפי קריטריונים של הקולג' האמריקני לראומטולוגיה) נרשמו בקבוצת הכורכומין (p<0.05). כמו כן, רק בקבוצת הכורכומין חלה ירידה מובהקת (53%) ברמת ה-CRP בסרום (p<0.05). לעומת זאת, אחוז השינוי הגבוה ביותר (13.3%) במדד שקיעת הדם ESR נצפה בקבוצת הטיפול המשולב, אך שינוי זה לא היה מובהק (p>0.05).
מנגנוני פעולה
כורכומין מסייע בטיפול בדלקות מפרקים הודות לפעילותו נוגדת הדלקת ונוגדת החמצון(148,291,293,306).
כורכומין מעכב מסלולים קינאזים (MAPK (ERK, P38, JNK וגורמי שעתוק AP-1, STAT, and NF-κB וכתוצאה מכך מעכב ייצור ציטוקינים דלקתיים בתאים כונדרוציטים (TNF-α, IL-1β, IL-2, IL-6, IL-8), מפחית ביטוי אנזימים פרו דלקתיים כגון COX2 המייצר PGE2 וניטריק אוקסיד סינתאז המייצר ניטריק אוקסיד, מפחית ביטוי מטלופרוטאינים המעורבים בפירוק המטריקס הבן תאי (MMP-3, MMP-9), ומונע אפופטוזיס (המושרה על ידי IL-1β ו-TNFα) בתאים כונדרוציטים על ידי הגברת ביטוי חלבונים מעכבי אפופטוזיס (Bcl-2, Bcl-XL) והפחתת ביטוי אנזימים מפרקי תא (caspase 3).
כורכומין אף מפחית עקה חמצונית המגבירה את תהליכי ההרס והשחיקה של המפרקים(306-308) על ידי נטרול רדיקלים חופשיים (ROS) והגברת פעילות אנזימים נוגדי חמצון (קטלאז, סופראוקסיד דיסמוטאז), ועיכוב ייצור ניטריק אוקסיד על ידי עיכוב האנזים NOS.
בנוסף להשְפעת כורכומין בהפחתת עקה חמצונית ועיכוב גורמי שעתוק המובילים לייצור מוגבר של ציטוקינים דלקתיים. כורכומין ממלא תפקיד בוויסות התגובה החיסונית האופיינית לדלקת מפרקים שגרונית:
דלקת מפרקים שגרונית היא תולדה של תגובת יתר חיסונית המתבטאת בדומיננטיות של זרוע החיסון (Th1 (IL-2, and TNF-α ו- (Th17 (IL-17A, IL-6, TNF-α על פני זרוע החיסון (Th2, IL-4, IL-10) ותאי T רגולטורים (Treg) המווסתים את התגובה החיסונית(309). כורכומין מסייע בהשבת האיזון בין זרועות החיסון(310) על ידי הפחתת רמות הציטוקינים TNF-α, IL-2, IL-6, IL-17 והעלאת רמת הציטוקין IL-10.
מחלות מעי דלקְתיות
הקדמה | מחקרים קליניים | מנגנוני פעולה
הקדמה
חמישה מחקרים מעידים על יעילות מסוימת של כורכום בשילוב עם הטיפול התרופתי בהקלה בתסמיני קוליטיס קלה עד בינונית (שיפור היציאות, הפחתת כאבים), בהשגת הפוגה מהמחלה ובשמירה על הפוגה, בשיפור מצב המעי ובהפחתת מדדי דלקת. עם זאת, לא ברורה יעילות הצמח לבדו. כמו כן, שני מחקרים בלבד מתייחסים לטיפול באמצעות כורכום במחלת הקרוהן, ולפי המחקרים הללו נראה כי הצמח עשוי להועיל להקלה בתסמינים ולשיפור מדדי הדלקת הודות לפעילותו מווסתת החיסון.
מחקרים קליניים
סקירה (מרץ-אפריל 2013) בדקה את השימושים השונים של מיצוי כורכומין (Curcuma longa). מהסקירה עולה כי ישנן השפעות מטיבות על דיספפסיה, אולקוס, IBD, RA, OA ועוד. כורכומין לרוב בטוח לשימוש עם תופעות לוואי אפשריות של בחילה או שלשול(15).
מסקירה של פעילות הכורכומין, הרכיב הפעיל בכורכום (יוני 2009), נמצא כי לצמח ישנה השפעה נוגדת דלקת, אשר הוכחה במחקרים קליניים כיעילה נגד מחלות כמו IBD, דלקת לבלב ועוד. עוד על פי הסקירה כורכומין נמצא כמפחית שלשולים בעקבות קוליטיס כיבית מושרית בעכברים. כורכומין אף מפחית את הפגיעה ברירית המעי, ומפחית הסננה של נויטרופילים והפעלה של NFkB ברירית המעי הגס(148).
סקירה (מאי 2015) המסכמת את העדויות המחקריות הבוחנות שימוש בתוספי תזונה לטיפול במחלות מעי דלקתיות. הסקירה בין השאר כוללת התייחסות לכורכומין, לבונה (Boswellia serrata), אלוורה (Aloe vera) ומיץ עשב חיטה. החוקרים מסכמים כי ישנם ממצאים מבטיחים ביחס ליעילות של תוספים טבעיים לטיפול במחלות מעי דלקתיות. בין ממצאי הסקירה נמצא כי הרכיבים הצמחיים כורכומין ולבונה הינם גורמים אנטי-דלקתיים אשר משפיעים על מגוון קולטנים. עם התפתחות המחקר בכיוון של רפואה מותאמת אישית, החוקרים מציעים להמשיך ולבחון איזה מהחולים יגיבו באופן המיטבי לכל אחד מהתוספים וכיצד ניתן לשלב בין התוספים לבין הרפואה הקונבנציונאלית על מנת להגביר את יעילות הטיפול(311).
סקירה נרחבת (אוקטובר 2013) העוסקת ביעילות השימוש בצמחי מרפא במחלות מעי דלקתיות. בסקירה נכללו 21 מחקרים מבוקרים, 14 מהם נערכו על חולי קוליטיס ו-7 על חולי קרוהן. בהקשר לקוליטיס, נמצא כי ג'ל אלוורה, מיץ עשב חיטה, מיצוי אנדרוגרפיס (Andrographis paniculata) וטיפול צמחי סיני (Xilei-san) הינם יעילים להשגת רמיסיה של המחלה, בעוד שכורכומין יעיל כטיפול מונע ולשמירה על רמיסיה. שרף לבונה (Boswellia serrata) וזרעי פלנטגו (Plantago ovata) נמצאו יעילים במידה דומה לטיפול תרופתי אנטי-דלקתי (mesalazine). השימוש בשמן נר הלילה או באומגה 3 היה דומה בהתייחס לשיעור ההתלקחויות. בהתייחס לקרוהן, לענת האבסינת (Artemisia absinthium) והצמח הסיני Tripteryginum wifordii נמצאו יעילים להשגת רמיסיה ולמניעת הישנות המחלה לאחר ניתוח. עם זאת, חשוב לזכור כי המחקרים הינם מוגבלים וקיימת שונות מתודולוגית גבוהה ביניהם ולכן נדרשים מחקרים בהיקף גדול יותר על מנת לאשש את הממצאים ולבסס את השימוש הקליני בצמחים אלה(312).
סקירה (יוני 2015)(313) אשר בוחנת את העדויות ממחקרים בחיות מעבדה לגבי ההשפעה של פוליפנוֹלים שמקורם בתזונה במחלות מעי דלקתיות, קרוהן וקוליטיס. במחקרים רבים נבדקה התרומה של פוליפנוֹלים שונים למניעת קוליטיס, העיקריים שבהם הינם פירות יער, פוליפנוֹלים מתה ירוק, כורכומין ותרכובות סטילבניות (כגון רזברטרול). מרבית הפוליפנוֹלים שנחקרו נמצאו יעילים בעיכוב קוליטיס, אולם מינונים גבוהים של EGCG ותה ירוק, איזופבונים, זרעי פשתן ואלפא מנגוסטין דווקא החמירו את מצב המחלה. למרות הממצאים המבטיחים, החוקרים מציינים כי ישנם הבדלים הקשורים במינון ובהשפעה של העיכול וחיידקי המעי המגבילים את יישום הממצאים בבני אדם.
בסקירה (דצמבר 2016)(314) מוצגים הממצאים העדכניים בנוגע לטיפול באמצעות צמחי מרפא במחלות מעי דלקתיות (IBD), תוך דיון בתועלות הטיפול, בסיכונים ובמנגנוני הפעולה. החוקרים מפרטים בהרחבה את הממצאים העוסקים בקנאביס רפואי (Cannabis sativa), כולל פירוט של מאפייני הצמח, ההשפעה הפיזיולוגית, הרפואית והחיסונית שלו. תוצאות ממחקרים קליניים מצביעות בעיקר על תרומתו להקלה בתסמינים, אולם אין עדויות התומכות בהשפּעתו על מהלך המחלה ועל המצב הדלקתי. רכיבים תזונתיים נוספים שעשויים לתרום לטיפול ב-IBD המפורטים בסקירה כוללים כורכומין, תוסף פרה-ביוטי של נבטי שעורה (Germinated barley foodstuff) ואנדרוגרפיס (Andrographis paniculata).
סקירה שיטתית (ינואר 2015) שנועדה לבחון את היעילות של שיטות שונות מתחום הרפואה המשלימה לטיפול במחלות מעי דלקתיות. בסקירה נכללו 19 מחקרים קליניים העוסקים ביעילות הטיפול באמצעות צמחי מרפא וביניהם שני מחקרים על כורכומין, הרכיב הפעיל בכורכום (Curcuma longa). על פי הסקירה נמצאו ראיות התומכות בשימוש בכורכומין בחולי קוליטיס. עם זאת, מדובר במספר קטן של מחקרים באיכות מתודולוגית משתנה ולכן נדרשים מחקרים נוספים על מנת לאשש את הממצאים(315).
סקירה (2014)(316) בחנה את ההתקדמות בתחום הטיפול הצמחי בקוליטיס. הסקירה כללה 8 מחקרים קליניים מבוקרים (מתוכם 5 אקראיים וכפולי סמיות), בנוסף למחקר עוקבה (קוהורט) מבוקר אחד. במחקרים נבדק הטיפול באמצעות ג'ל אלוה, מיץ נבט חיטה, Butyrate (חומצת שומן קצרת שרשרת), תמצית tormentil (מהצמח Potentilla erecta) וכורכומין. המחקרים ארכו בין 3-8 שבועות, וכללו סך של 242 משתתפים. על פי שני מחקרים קליניים שעסקו בכורכומין נראה כי נטילת כורכומין במינון 2 גרם ליום הדגימה יעילות טיפולית בשילוב עם תרופות קונבנציונליות (5-ASA, sulfasalazine, mesalamine).
מחקר קליני לא מבוקר (מרץ 2013) בחן את יעילות ובטיחות הטיפול באמצעות כורכום בשילוב עם הטיפול הרפואי הסטנדרטי במחלות מעי דלקתיות בקרב ילדים. אחד עשר נבדקים (7 בנים ו-4 בנות, טווח גילאים 11-18) הסובלים מקרוהן (שישה נבדקים) או מקוליטיס כיבית (חמישה נבדקים) בשלב ההפוגה מהמחלה או הסובלים מתסמינים קלים (PCDAI<30, PUCAI<34*) והנוטלים טיפול תרופתי סטנדרטי (mesalamine וטיפול ביולוגי נוגד TNFɑ) נטלו 1 גרם כורכומין ליום במשך שלושה שבועות. לאחר מכן הועלה המינון בהדרגה ל-2, ול-4 גרם ליום כשכל מינון ניטל במשך שלושה שבועות. תשעה נבדקים השלימו את ההתערבות. הטיפול נסבל היטב למעט שני נבדקים שדווחו על עליה באי נוחות בטנית. בקרב שלושה נבדקים חל שיפור במדד תסמיני המחלה, כאשר שניים מהם החולים בקוליטיס עברו ממחלה פעילה קלה לנסיגה מהמחלה. אף לא אחד מהנבדקים חווה החמרה של התסמינים במהלך ההתערבות(317).
*Pediatric Crohn's Disease Activity Index, Ulcerative Colitis Activity Index
מחקר קליני כפול-סמיות מבוקר פלסבו (פברואר 2015) מצביע על היעילות של כורכומין (Cur-cure™), הרכיב הפעיל בכורכום, להשגת רמיסיה (הפוגה) ולהקלה על התסמינים בחולי קוליטיס כיבית. במחקר השתתפו 50 חולי קוליטיס (טווח גילאים 18-70) במצב קל עד בינוני (SCCAI* ≥ 5 and <12) אשר נטלו טיפול תרופתי אנטי-דלקתי (Mesalamine) שהיה מוגבל ביעילותו. בנוסף לטיפול התרופתי, מחצית מהמשתתפים נטלו תמצית תקנית של כורכום (מתוקננת להכיל 95% כורכומין) במינון של 3 גרם ליום או מינון זהה של פלסבו למשך חודש. 47 נבדקים השלימו את ההתערבות. מהתוצאות עולה כי לאחר חודש, אף אחד מהחולים בקבוצת הפלסבו לא הגיע לרמיסיה קלינית או אנדוסקופית ורק בקרב 13% חלה הקלה בתסמינים. לעומת זאת, 54% מהחולים בקבוצת הכורכומין הגיעו לרמיסיה קלינית (p=0.01) ו-38% לרמיסיה אנדוסקופית (p=0.043) ובקרב 65% נצפתה הקלה בתסמינים (p<0.001) בהשוואה לפלסבו. תופעות הלוואי היו זניחות ודומות בשתי קבוצות המחקר. החוקרים מסכמים כי השימוש בכורכומין עשוי להוות אסטרטגיה יעילה ובטוחה לטיפול בחולים עם מחלת קוליטיס מורכבת כאשר השימוש בתרופות חזקות יותר עלול לגרום לתופעות לוואי משמעותיות(79).
* Clinical Colitis Activity Index.
מחקר קליני(318) אקראי כפול סמיות ומבוקר פלסבו (2014) בחן את יעילות תמיסת חוקן המכילה כורכומנואידים (NCB-02) לטיפול בקוליטיס כיבית דיסטלית קלה עד בינונית. 45 נבדקים שאובחנו כסובלים מקוליטיס כיבית באזור פי הטבעת והחלחולת (אזור דלקת <25 ס"מ) עם פעילות מחלה המוגדרת קלה עד בינונית והנוטלים את התרופה 5-ASA, חולקו אקראית לביצוע חוקן המכיל תמצית תקנית של כורכומנואידים (מתוקננת להכיל 78% כורכומנואידים, מתוכם 72% כורכומין) או פלסבו בנוסף לטיפול התרופתי במשך שמונה שבועות. ההיענות לטיפול לא היתה גבוהה, אך לא שונה במובהק בין הקבוצות (56.5% לעומת 36.4%, p=0.175). בתום ההתערבות בקרב הנבדקים שהשלימו את ההתערבות (מספרם לא ידוע) נצפו הבדלים מובהקים בקבוצת הכורכום בהשוואה לפלסבו בשיעור התגובה הקלינית (92.9% לעומת 50%, p=0.01), הנסיגה הקלינית (71.4% לעומת 31.3%, p=0.03) ובשיפור מצב המעי בבדיקה אנדוסקופית (85.7% לעומת 50%, p=0.04).
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2006) בחן את יעילות הטיפול כורכומין במניעת התקפי קוליטיס כיבית. 89 נבדקים חולי קוליטיס כיבית הנמצאים בהפוגה ממחלה פעילה חולקו אקראית לנטילת כורכומין במינון 2 גרם ליום או פלסבו בנוסף לטיפול התרופתי (Sulfasalazine או mesalamine) במשך שישה חודשים. בתום ההתערבות נערכו עוד שישה חודשי מעקב. 82 נבדקים השלימו את ההתערבות והמעקב. בתום ההתערבות נמצא כי כורכומין היה יעיל בהשוואה לפלסבו במניעת הישנות המחלה (4.65% בקבוצת הכורכומין לעומת 20.51% בקבוצת הפלסבו חוו חזרה של המחלה הפעילה, p=0.04). כמו כן, כורכומין שיפר במובהק את התסמינים הקליניים (p=0.038) ואת מצב התמונה ההיסטולוגית של המעי לפי אנדוסקופיה (p=0.0001) בהשוואה למצב הבסיס. בתקופת המעקב, שבה כל הנבדקים נטלו רק את הטיפול התרופתי, שמונה נבדקים בקבוצת הכורכומין ושישה נבדקים בקבוצת הפלסבו חוו הישנות של המחלה הפעילה. מסקנת החוקרים היתה שכורכומין בשילוב עם הטיפול התרופתי יעיל לטיפול בקוליטיס כיבית ובהארכת ההפוגה מהמחלה הפעילה(78).
מחקר פתוח (2005) בחן את יעילות הטיפול באמצעות כורכומין בשילוב הטיפול התרופתי הסטנדרטי במחלות מעי דלקתיות. לחמישה חולי דלקת חלחולת כיבית ulcerative proctitis בני 28-54 שטופלו בתרופות נוגדות דלקת קונבנציונאליות (5-ASA, Fasalazine, Prednisone, Azathioprine או Budesonide) ניתן במקביל כורכומין במינון 1100 מ"ג ליום במשך חודש, ולאחר מכן במינון 1650 מ"ג במשך חודש נוסף. כמו כן, לחמישה חולי קרוהן ניתן כורכומין במינון 1080 מ"ג במשך חודש, ולאחר מכן מינון של 1440 מ"ג במשך חודשיים נוספים. כל חולי דלקת החלחולת הכיבית חוו הטבה בתסמיניהם, בעיקר במספר ואיכות היציאות (p<0.02), שני נבדקים הפסיקו את השימוש בתרופה 5-ASA ושניים נוספים הפחיתו ממינוני התרופות נוגדות הדלקת וחלקם אף הפסיקו את השימוש בהן. בקרב חולי הקוליטיס מדדי הדלקת, מדד ה-CRP וה-ESR חזרו לטווח התקין ולא חל שינוי בתפקודי הכבד והכליות. בקרב כל חולי הקרוהן חלה הטבה בתסמינים (הפחתה במספר היציאות, יציאות מוצקות יותר ופחות כאבים ועוויתות בבטן) והפחתה במדד ה-CRP וה-ESR. נבדק אחד מתוך החמישה דיווח על הרעה קלה בתסמינים עם הופעת פיסטולה(77).
סקירה שיטתית (2017) בחנה את יעילות ובטיחות כורכומין בשילוב עם התרופה remicade לטיפול במחלת קרוהן בקרב מבוגרים. בסקירה נכללו 16 מחקרים קליניים שנערכו על מטופלים מעל גיל 18 עם מחלת מעי דלקתית. התרופה רמיקייד מפחיתה רמת TNFɑ בקרב חולי קרוהן, אך נוטה להפסיק להשפיע כאשר רמת הציטוקין IL-1 עולה ואז גובר הסיכון להתפתחות ממאירות. חולי קרוהן שנטלו כורכומין במינון של כ-1000 מ"ג ליום הפחיתו במובהק את מדד פעילות המחלה (CDAI-מדד לכימות תסמיני המחלה), את רמת IL-1 ואת רמת חלבון הפאזה האקוטית CRP, בנוסף להפחתה ברמת ה- TNFɑ. החוקרים מסכמים כי שילוב של התרופה עם כורכומין עשוי להפחית את אבדן התגובה לתרופה (Loss Of Response) ולהפחית את הסיכון לפיתוח ממאירויות(108).
מנגנוני פעולה
מחלות מעי דלקתיות מאופיינות בפעילות חריגה של מערכת החיסון המולדת והנרכשת (זרועות החיסון Th1, Th2 ו-Th17). ישנה סברה שאיזון שהופר בפלורה של המעי מפר את הסבילות החיסונית (Immune tolerance) של החולים ומהווה טריגר לפעילות הדלקתית. הפעילות המוגברת של הציטוקינים משרה אפופטוזיס בתאי אפיתל המעי הגס ופגיעה במחסום האפיתלי של המעי(316,319). כורכומין מסייע לטיפול במחלות מעי דלקתיות הודות לפעילותו נוגדת החמצון, נוגדת הדלקת ומווסתת החיסון. כורכומין מפחית את הפגיעה במחסום המעי על ידי הגברת פעילות האנזים אלקליין פוספטאז המשמש כגורם מנטרל רעלנים ומעודד את התחדשות תאי החיפוי של המעי. בנוסף, לכורכומין פעילות אנטי בקטריאלית כנגד חיידקי גראם שליליים וחיוביים התורמת לאיזון הפלורה(320). כורכומין מפחית עקה חמצונית(284,316,319,321-323) על ידי נטרול רדיקלים חופשיים והגברת פעילות אנזימים נוגדי חמצון אנדוגניים. כורכומין אף מווסת את התגובה הדלקתית על ידי עיכוב מסלולי הקינאזים PI3K-Akt, JNK ו-P38-MAPK ועיכוב גורמי השעתוק NFkB, AP-1 ו-STAT3. כורכומין אף מפעיל את גורם השעתוק PPARɣ המדכא הפעלה של NFkB. עיכוב מסלולי השעתוק הדלקתיים מובילים להפחתת אפופטוזיס, לעיכוב ביטוי של קולטני שער (TLR) על גבי תאים מציגי אנטיגנים, להפחתת הפעלה של מקרופג'ים ותאים דנדריטיים, להפחתת ביטוי האנזימים הדלקתיים COX2, 5-LOX ו-NOS המשפיעים על חדירות כלי הדם והסננה של נויטרופילים ותאי T מופעלים למוקד הדלקת, להפחתת ביטוי הציטוקינים הדלקתיים הכלליים IL-1β, IL-6, TNFɑ והספציפיים לכל אחת מזרועות החיסון (INFɣ, IL-2, IL-5, IL-8, IL-12, IL-13, IL-17) ולהגברת ייצור והפרשה של הציטוקין נוגד הדלקת IL-10, וכן להפחתת ביטוי של אנזימים מפרקי מטריקס בין תאי (MMP-3, MMP-9).
גסטרִיטיס/כיבים פפטיים/הליקובקטר
הקדמה | מחקרים קליניים | מנגנוני פעולה
הקדמה
במספר מחקרים קליניים שבהם ניתנו כורכום או כורכומין כתוספת לטיפול התרופתי (סותרי חומצה והטיפול האנטיביוטי המשולש) הודגמה יעילות של משלב התרופות והצמח בשיפור תסמיני דיספפסיה, אך לא היה לצמח ערך מוסף במיגור חיידק ההליקובקטר פילורי. לעומת זאת, נתקבלו ממצאים סותרים בין מחקרים שונים לגבי יעילות כורכום בשיפור התסמינים ובריפוי הכיבים הפפטיים כשהצמח ניתן לבדו. מחקרי מעבדה ובעלי חיים הדגימו עיכוב ואף סילוק של חיידק ההליקובקטר פילורי על ידי עיכוב גידולו והיצמדותו לסעיפי הקיבה.
מחקרים קליניים
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (1998) בחן את יעילות הנטילה הפומית של כורכום בטיפול בכיב בתריסריון. 118 נבדקים שאובחנו כסובלים מכיב בתריסריון בקוטר של 5 מ"מ לפחות על ידי אנדוסקופיה או רדיוגרפיה חולקו אקראית לנטילת אבקת כורכום במינון 6 גרם ליום או פלסבו במשך שמונה שבועות. במהלך ההתערבות לא הורשו הנבדקים ליטול תרופות לטיפול בכיב (תרופות החוסמות את הקולטן להיסטמין, תרופות אנטיכולינרגיות או אחרות), בתום ההתערבות לא נצפה יתרון לטיפול באמצעות כורכום על פני פלסבו בריפוי כיבים בתריסריון. שיעור ההחלמה בתום שמונה שבועות היה 27% בקבוצת הכורכום בהשוואה ל-29% בקבוצת הפלסבו. הטיפול נסבל היטב, ללא תופעות לוואי(324).
מחקר קליני לא מבוקר (2001) בדק את השפּעת כורכום על החלמת כיבים פפטיים. 25 מטופלים (בגילאי 16-60) השתתפו במחקר לאחר שאובחנו באנדוסקופיה עם כיבים בקיבה ובתריסריון. כל המשתתפים נטלו אבקת כורכום במינון 3 גרם ליום, בשעות קבועות ובין חצי שעה לשעה לפני ארוחות למשך ארבעה שבועות. בתום ההתערבות נמצא שב-48% מהמקרים הכיב הפפטי נעלם, ושאר המטופלים החלימו מן הכיבים תוך 8 (72%) עד 12 (76%) שבועות. 20 מטופלים נוספים שלא אובחנו עם כיבים או לא עברו אנדוסקופיה אך סבלו מגסטריטיס או דיספפסיה, טופלו אף הם וכאבי הבטן ואי הנוחות נעלמו בין השבוע הראשון לשני(325).
הערת מערכת: המחקר אינו כולל קבוצת ביקורת ולפיכך לא ניתן לייחס את החלמת הכיבים הפפטיים לטיפול באמצעות כורכום.
מחקר קליני (2017) אקראי ומבוקר בחן את השְפעת כורכומין על עקה חמצונית ושינויים היסטולוגיים בקיבה בעקבות זיהום כרוני בחיידק הליקובקטר פילורי. 100 נבדקים בריאים (בני 18-70) הסובלים מגסטריטיס כרוני מאובחן בעקבות זיהום HP חולקו אקראית לנטילת הטיפול המשולש בשילוב כורכומין או הטיפול המשולש לבדו במשך. הטיפול המשולש כלל טיפול בשתי תרופות אנטיביוטיות, Amoxicillin במינון 2 גרם ליום, ו-Metronidazole במינון 1600 מ"ג ליום, בשילוב עם התרופה סותרת החומצה Omeprazole (במינון 40 מ"ג ליום) במשך שבוע. כורכומין (סוג מיצוי לא צוין) ניתן בנוסף לקבוצת ההתערבות במינון 2100 מ"ג ליום במשך ארבעה שבועות. כעבור שמונה שבועות בקבוצת הטיפול המשולב, חלה ירידה מובהקת בעקה החמצונית בסרום (ירידה במלונדיאלדהידים ובגלוטטיון פרוקסידאז, עליה במדד נוגדי החמצון הכללי) ובנזק החמצוני ל-DNA ברקמת הקיבה בהשוואה למצב הבסיס ולטיפול התרופתי לבדו (p<0.05 בכל המדדים). בנוסף, הטיפול המשולב הפחית במובהק את כל מדדי הדלקת, ואת השינויים ההיסטולוגיים לרקמת הקיבה לפי תוצאות הבדיקה האנדוסקופית, והגביר במובהק את שיעור מיגור החיידק (86.4% לעומת 74.5%) בהשוואה לטיפול התרופתי לבדו (p<0.05 בכל המדדים)(326).
מחקר קליני השוואתי (2010) בחן את השְפעת תוסף כורכום על ייצור ציטוקינים פרו-דלקתיים בקרב חולי דלקת הקיבה (גסטריטיס) כתוצאה מזיהום חיידקי בהליקובקטר פילורי. הנבדקים חולקו אקראית לנטילת טיפול תרופתי אנטיביוטי בשילוב תרופה סותרת חומצה (Omeprazole, Amoxicillin, Metronidazole) במשך שבוע או תוסף כורכום במינון 2100 מ"ג ליום (מינון שווה ערך ל-120 מ"ג כורכומין) במשך ארבעה שבועות. שיעור מיגור החיידק בקבוצת הטיפול התרופתי היה גבוה במובהק בהשוואה לקבוצת הכורכומין (78.9% בהשוואה ל-5.9%)(מובהקות לא ידועה). רמות הביטוי הגנטי של האינטרלוקין IL-8 פחתו במידה מובהקת בקבוצת הטיפול התרופתי ללא השפעה על שאר הציטוקינים (IL-1β, TNF-alpha, Cox2). בקבוצת הכורכומין לא נצפתה השפעה מובהקת על רמות הציטוקינים. מסקנת החוקרים היתה שהטיפול באמצעות כורכומין לבדו הוא בעל השפעה אנטי בקטריאלית מוגבלת על החיידק, וחסר השפעה על ייצור ציטוקינים פרו-דלקתיים(327).
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו במבנה מקביל (Parallel group trial) (2016) בחן את יעילות כורכומין בשילוב הטיפול האנטיביוטי המשולש במיגור זיהום חיידק הליקובקטר פילורי ותסמיני דיספפסיה בקרב הסובלים מכיב פפטי. נבדקים (מספרם לא ידוע) שאובחנו כסובלים מכיב פפטי חולקו אקראית לקבלת הטיפול המשולש (clarithromycin 500 mg, amoxicillin 1000 mg, pantoprazole 40 mg) בשילוב כורכומין (סוג מיצוי אינו ידוע) במינון 500 מ"ג ליום או פלסבו במשך ארבעה שבועות. בתום ההתערבות, הטיפול באמצעות כורכומין היה יעיל יותר במובהק בשיפור תסמיני הדיספפסיה בהשוואה לפלסבו (p<0.001). שיעור הנבדקים שדיווחו על החלמה מתסמיני הדיספפסיה היה גבוה במובהק בקבוצת הכורכומין (27.6%( בהשוואה לקבוצת הפלסבו (6.7%) (p=0.042). עם זאת, שיעור מיגור החיידק על פי תבחין הנשיפה בשתי הקבוצות היה שווה (73.3%). מסקנת החוקרים היתה כי תוספת כורכומין לטיפול המשולש יעילה בשיפור תסמיני דיספפסיה אך אין לה ערך מוסף במיגור חיידק ההליקובקטר פילורי(328).
במחקר קליני אקראי כפול סמיות ומבוקר (2015) בוצעה השוואה בין טיפול תרופתי לבין טיפול צמחי בחיידק הליקובקטר פילורי. במחקר השתתפו 210 חולים מבתי חולים בפקיסטן, אשר חולקו ל-2 קבוצות: קבוצת נבדקים אחת קיבלה טיפול תרופתי הכולל 4 סוגי תרופות (Omeprazole, Amoxicillin, Metronidazole, Bismuth) למשך 7 ימים, קבוצת הנבדקים השנייה קיבלה 500 מ"ג מהתוסף הצמחי Pylorex Plus למשך 15 יום (התוסף מכיל את הצמחים Curcuma longa, Mallotus philippensis, Glycyrrhiza glabra, Zingiber officinale). נמצא כי החיידק נכחד בקרב כ-62% מהנבדקים בקבוצת הטיפול התרופתי ובכ-56% מהנבדקים בקבוצת הטיפול הצמחי. בנוסף, בשתי הקבוצות נמצאה ירידה בתסמינים של מערכת העיכול בשבוע השני לטיפול וכחודש לאחר סיום הטיפול (p<0.0001 בקבוצת התוסף הצמחי ו-p<0.001 בקבוצת הטיפול התרופתי), אולם רק בקרב הקבוצה שנטלה את התוסף הצמחי (p<0.001), נצפה שיפור בתסמינים במערכת העיכול גם בקרב חולים שעדיין סבלו מנוכחות החיידק(329).
מחקר קליני לא מבוקר (2011) בחן את השְפעת הטיפול באמצעות כורכום בכיב פפטי. 55 נבדקים (בני 22-50) הסובלים מכיב פפטי, מתוכם 35 שאובחנו כסובלים מזיהום הליקובקטר פילורי טופלו בכורכום טחון לאבקה במינון 2 גרם ליום במשך שמונה שבועות. בתום שמונה שבועות נרשמה החלמה מן הכיב הפפטי בקרב 87% מהנבדקים. עשרים נבדקים מתוך ה-35 שאובחנו כסובלים מזיהום הליקובקטר פילורי (57%), לא הראו נוכחות של הנגיף בצואה בתום ההתערבות(330).
מנגנוני פעולה
כורכומין מסייע בטיפול ובהקלה על התסמינים של גסטריטיס וכיבים פפטיים על ידי פעילות נוגדת חמצון (נטרול רדיקלים חופשיים, והגברת פעילות אנזימים נוגדי חמצון) ונוגדת דלקת (עיכוב NFkB, הורדת רמות ציטוקינים דלקתיים TNFɑ, IL-1β, IL-6, עיכוב COX2 ו-NOS), הפחתת הפרשת יתר של חומצת קיבה, הפחתת חומציות נוזל הקיבה ועיכוב שחרור פפסין(331-334). על אף שלא הוכחה במחקרים קליניים פעילות אנטי בקטריאלית של כורכומין כנגד החיידק הליקובקטר פילורי, מחקרי מעבדה ובעלי חיים מדגימים עיכוב ואף סילוק של החיידק על ידי עיכוב גידולו והצמדותו לסעיפי הקיבה(335). גם מבלי להשמיד לבדו את החיידק, כורכומין יעיל בשילוב עם טיפול אנטיביוטי היות שהוא מונע את הנזק לרקמות שגורם החיידק על ידי מניעת שחרור מטלופרוטאינים הגורמים לנזק רקמתי, והוא אף מסייע בשיקום רקמות שניזוקו בעקבות דלקת או זיהום חיידקי ובפעילות אנטי סרטנית המונעת סיבוכים אפשריים של דלקת כרונית(336-337). פוליסכרידים שמוצו משורש הצמח הדגימו אף הם הגנה על רירית הקיבה, עיכוב גידול החיידק הליקובקטר פילורי והצמדותו לסעיפי הקיבה ופעילות נוגדת חמצון במעבדה ובמודלים של כיבי קיבה בבעלי חיים(337-338).
תסמונת המעי הרגִיש
הקדמה | מחקרים קליניים | מנגנוני פעולה
הקדמה
מספר מצומצם של מחקרים מעיד על יעילות כורכום לבדו או בשילוב עם רכיבים צמחיים נוספים בהקלה על תסמיני דיספפסיה ומעי רגיש, אך שילוב צמחים נוספים בפורמולה ובעיות מתודולוגיות בתכנון המחקרים לא מאפשרים הסקת מסקנות חד משמעית לגבי הכורכום לבדו. לכורכום השפעה נוגדת עווית במערכת העיכול דרך השפעה ישירה על פעילות מתווכים עצביים (היסטמין, אצטיל כולין וסרוטונין) במעי, והוא מעודד הפרשת אנזימי עיכול מהלבלב ומצי מרה מכיס המרה. פעילות זו מיוחסת לרכיבים המרירים ארומתיים בצמח. הפעילות נוגדת החמצון ונוגדת הדלקת של כורכום ושל כורכומין תומכת בעקיפין בפעילות סרוטונין במערכת העיכול ובתקשורת שבין מערכת העיכול והמוח. לבסוף, לכורכום פעילות אנטי מיקרוביאלית כנגד מגוון רחב של חיידקים, טפילים ופטריות שעלולים לגרום או להחריף תסמיני דיספפסיה ויש לו השפעה משמעותית על הרכב חיידקי המעי.
מחקרים קליניים
סקירה (מרץ-אפריל 2013) בדקה את השימושים השונים של מיצוי כורכומין (Curcuma longa). מהסקירה עולה כי לצמח ישנן השפעות מטיבות על דיספפסיה, אולקוס, IBD, RA, OA ועוד וכי כורכומין לרוב בטוח לשימוש עם תופעות לוואי אפשריות של בחילה או שלשול(15).
סקירת מאמרים (יוני 2011) שמטרתה להעריך את יעילות הטיפול ברפואה משלימה בסובלים מ-IBS, מצאה כי כ-50% מהמטופלים עם IBS מדווחים על שימוש ברפואה משלימה על מנת להקל על תסמינים, לאחר שלא הצליחו למצוא פתרונות יעילים ברפואה קונבנציונאלית. לפי הסקירה מיצוי כורכום סטנדרטי נמצא כיעיל מאוד ומשפר איכות חיים(339).
סקירה (2001) שכללה מספר מחקרים מבוקרים בהן בוצעו עם שילובי צמחים ביניהם כורכום (Curcuma longa), זנגוויל (Zingiber officinale), שמן מנתה ושמן קימל(340). במחקרים אלו התרופות הצמחיות הראו פעילות משמעותית בטיפול בהשוואה לפלסבו והראו יעילות דומה לתרופות פרוקינטיות (תרופות המשפרות את תנועתיות מערכת העיכול, מקלות על תסמינים ומשפרות תפקוד).
מחקר קליני אקראי חד סמיות ובלתי מבוקר (2004) בחן את יעילות כורכום בטיפול בתסמונת המעי הרגיש. 207 נבדקים בריאים שדיווחו כי הם סובלים מתסמיני IBS חולקו אקראית לנטילת כמוסה אחת או שתיים של תמצית תקנית של כורכום (סוג מיצוי לא צוין) במינון במשך שמונה שבועות. כל כמוסה הכילה 72 מ"ג מיצוי כורכום (מינון מקביל ל-1.8 גרם שורש כורכום טחון). בתום ההתערבות חלה ירידה של 60% בשכיחות תסמיני ה-IBS בקבוצת המינון הגבוה (144 מ"ג תמצית) וירידה של 53% בקבוצת בשכיחות תסמיני ה-IBS בקבוצת המינון הנמוך (72 מ"ג תמצית)(p<0.001 בשתי הקבוצות). אי הנוחות הבטנית פחתה ב-22% וב-25% בקבוצת המינון הנמוך והגבוה בהתאמה, אך ללא מובהקות סטטיסטית (p=0.071). שתי קבוצות המינון דיווחו על שיפור של 5%-36% בכל מדדי איכות החיים לפי מדד IִBSQOL. כשני שלישים מהנבדקים (67% בקבוצת המינון הנמוך ו-70% בקבוצת המינון הגבוה) דיווחו על שיפור מובהק בתסמינים בעקבות הטיפול (מלבד נבדק אחד שדיווח על החמרה) ועל שינוי לטובה בדפוסי היציאות בהשוואה למצב הבסיס (p<0.001), ללא הבדל מובהק בין הקבוצות(341).
הערת מערכת: חסרונו העיקרי של המחקר הוא העדר קבוצת פלסבו שבלעדיה לא ניתן ליחס בוודאות את השיפור בתסמינים לטיפול בכורכום.
מחקר קליני רב-מרכזי אקראי כפול סמיות ומבוקר פלסבו (1987) בחן את יעילות כורכום בהשוואה לתוסף ייעודי בטיפול בדיספפסיה (כאב בטן, אי נוחות אפיגסטרית, גזים או גיהוקים). 116 נבדקים בריאים (בני 12 ומעלה) חולקו אקראית לקבלת פלסבו, תוסף המכיל אבקת כורכום (250 מ"ג אבקה לכמוסה, בכל כמוסה 0.02 מ"ל שמנים נדיפים ו-0.024 מ"ג כורכומנואידים) או תוסף ייעודי Flatulence (שהכיל תמצית יבשה של cascara במינון 65 מ"ג, nux vomica במינון 16 מ"ג, asofoetida במינון 0.325 מ"ג, אבקת capsicum במינון 8 מ"ג, אבקת ginger במינון 48 מ"ג, ו-diastase במינון 3 מ"ג). מספר הנבדקים בקבוצות לא היה שווה: 41 נבדקים בקבוצת הפלסבו, 36 נבדקים בקבוצת התוסף הייעודי ו-39 נבדקים בקבוצת הכורכום. מינון הנטילה לכל הנבדקים היה 2 כמוסות 4 פעמים ביום במשך 7 ימים (מינון כולל של אבקת כורכום 2 גרם ליום). עשרה נבדקים (9%) לא השלימו את ההתערבות. בתום ההתערבות, 83% מהנבדקים בקבוצת הכורכום ו-87% בקבוצת התוסף הייעודי דיווחו על שיפור כללי בתסמינים (Overall favorable outcome) בהשוואה ל-53% בקבוצת הפלסבו (p=0.008). שיעור הנבדקים שחוו שיפור כללי בתסמינים בקבוצת הכורכום לעומת קבוצת הפלסבו היה 86% לעומת 49% (p<0.005). תופעות הלוואי היו קלות ללא הבדל מובהק בין הקבוצות. כמו כן, לא נצפה הבדל מובהק בין הקבוצות בשביעות הרצון של הנבדקים מהטיפול (47% בקבוצת הפלסבו, 50% בקבוצת הכורכום ו-57% בקבוצת התוסף הייעודי)(342).
במחקר אקראי מבוקר (ינואר 2016) נבדקה היעילות והסבילות של תוסף משולב, המכיל כורכומין ושמן אתרי שומר (Foeniculum vulgare) בקרב מטופלים עם תסמונת המעי הרגיש (IBS). במחקר נכללו 121 נבדקים הסובלים מתסמיני IBS ברמה קלה עד בינונית, אשר נטלו באופן אקראי את התוסף המשולב (שם מסחרי: CU-FEO) במינון יומי של 168 מ"ג כורכום ו-70 מ"ג שמן שומר (מחולק לשתי מנות) או פלסבו למשך 30 ימים. נמצא כי נטילת התוסף הייתה יעילה להפחתת התסמינים, בטוחה ונסבלה היטב. ציון התסמינים הכולל ירד בכ-50% בממוצע בקבוצת הטיפול לעומת 26% בקבוצת הפלסבו (p<0.001), ומגמה דומה נמצאה גם באופן ספציפי בהתייחס לכאבי הבטן. עוד נמצא כי שיעור המשתתפים עם הקלה מלאה בתסמינים היה גבוה יותר בקבוצת הטיפול לעומת הפלסבו (26% לעומת 7%, p=0.005). כמו כן, נמצא שיפור בכל תחומי שאלון איכות החיים, עם ציון כולל של 17.4 בקבוצת הטיפול לעומת 7.7 בקבוצת הפלסבו (p=0.003). החוקרים מסכמים כי התוסף תרם באופן מובהק לשיפור בהיבט הקליני ובאיכות החיים של מטופלים עם תסמונת המעי הרגיש(343).
במחקר אקראי מבוקר מוצלב (יוני 2016) נבדקה היעילות והבטיחות של פורמולת צמחים איורוודית למטופלים הסובלים ממעי רגיש המאופיין בשלשול. במחקר נכללו 32 מטופלים, אשר חולקו אקראית לארבע קבוצות כאשר כל קבוצה קיבלה בסדר אקראי פורמולת צמחים או פלסבו - כל התערבות למשך ארבעה שבועות עם הפרדה של שבוע בין כל התערבות (פלסבו-פלסבו-צמחים, פלסבו-צמחים-צמחים, צמחים-פלסבו-פלסבו, צמחים-צמחים-פלסבו). הפורמולה ניתנה בצורת אבקה שהכילה 3 צמחי מרפא: עלי קארי (Murraya koenigii), קליפת רימון (Punica granatum) ושורש כורכום (Curcuma longa) ביחס של 6:3:1. המשתתפים הונחו למהול 5 גרם אבקה ב-100 מ"ל מים חמים פעמיים ביום, בהפרדה מהארוחה. בסיום המחקר לא נמצאו הבדלים מובהקים בין הקבוצות ברמת התסמינים וכן במדדי איכות החיים ורמת החרדה והדיכאון. החוקרים מציינים כי ההיענות לטיפול הייתה טובה והפורמולה נמצאה בטוחה, אולם כשליש מהמשתתפים דיווחו על השפעה שלילית קלה, אשר עלולה להיות קשורה לשימוש בפורמולה, כגון הפרעות בדרכי העיכול, פריחה עורית, הזעה מוגברת וירידה בתיאבון(344).
במחקר קליני מבוקר מוצלב (ספטמבר 2017) נבדקה ההשפעה של תוסף כורכומין על הפגיעה ברירית המעי ועל התגובה הפיזיולוגית בעקבות פעילות גופנית תחת תנאי חום. במחקר נכללו 8 מתנדבים אשר ביצעו שני מבדקי ריצה בעצימות בינונית (65% VO2max) למשך שעה תחת תנאי חום (37 מעלות), פעם אחת לאחר נטילת תוסף כורכומין (500 מ"ג/יום למשך 3 ימים) ופעם אחת לאחר נטילת פלסבו. בהשוואה לפלסבו, נמצאה השפעה מיטיבה לנטילת כורכומין על המדד I-FABP (ובשמו המלא Intestinal fatty acid binding protein) להערכת הפגיעה ברירית המעי (עליה של 18% לעומת 58% בעקבות פלסבו, p=0.05), על מדדי דלקת (עליה גדולה יותר של הציטוקין נוגד הדלקת IL-1RA בתגובה לעליה בIL-1 בעקבות פלסבו לעומת כורכומין, עליה מובהקת של הציטוקין TNFɑ בעקבות פלסבו אך לא בעקבות כורכומין, p=0.01), והשפעה מטיבה (P<0.01) על המדד PSI (ובשמו המלאPhysiological Strain Index) להערכת התגובה הפיזיולוגית למאמץ. החוקרים מסכמים כי לנטילת תוסף כורכומין עשויה להיות תרומה בטווח הקצר להפחתת הסיכון למכת חום כתוצאה ממאמץ גופני(345).
במחקר פיילוט(346) כפול-סמיות מבוקר פלסבו (2018) הוערכה ההשפעה של שני תוספי כורכום (Curcuma longa) על פלורת המעי. במחקר נכללו 30 מתנדבים, אשר חולקו לשלוש קבוצות מחקר: 1) טבליות פלסבו 2) טבליות המכילות 1,000 מ"ג כורכום ו-1.25 מ"ג פיפרין 3) טבליות המכילות 1,000 מ"ג כורכומין ו-1.25 מ"ג פיפרין (Curcumin C3 Complex). המשתתפים נטלו 3 טבליות פעמיים ביום עם הארוחה למשך 8 שבועות (סה"כ 6,000 מ"ג ליום). בבדיקה של פלורת המעי זוהו 172 עד 325 זנים של חיידקים. בקבוצת הפלסבו נצפתה ירידה של כ-15% במגוון הזנים, בקבוצת הכורכום נצפתה עלייה קלה של 7% במגוון הזנים, כאשר בקבוצת הכורכומין נצפתה עלייה של 69% במגוון הזנים. משתתפים שהגיבו לטיפול אופיינו בעלייה בזנים: Clostridium , Bacteroides , Citrobacter , Cronobacter , Enterobacter , Enterococcus , Klebsiella , Parabacteroides , Pseudomonas וירידה בריכוזי החיידקים מהזנים Blautia ו-Ruminococcus. החוקרים מסכמים כי בקרב כלל המטופלים חלו שינויים בפלורת המעי לאורך זמן ובתגובה לטיפול, כאשר הן כורכום והן כורכומין היו בעלי השפעה דומה על השינויים בהרכב החיידקים ולכן משוער שכורכומין הינו הגורם המשמעותי לשינוי בפלורת המעי בקרב המשתתפים שנטלו כורכום.
מנגנוני פעולה
כורכום וכורכומין מסייעים להקלה בתסמיני IBS בזכות פעילותם נוגדת החמצון (נטרול רדיקלים חופשיים, והגברת פעילות אנזימים נוגדי חמצון) ונוגדת הדלקת (עיכוב NFkB, הורדת רמות ציטוקינים דלקתיים TNFɑ, IL-1β, IL-6, עיכוב COX2 ו-NOS), והשְפעתם על הפרשת סרוטונין במערכת העיכול ובמערכת העצבים האנטרית, המקשרת בין מערכת העיכול ובין מערכת העצבים המרכזית(347). בנוסף, לכורכומין השפעה משמעותית על שינוי פלורת המעי(346) , ופעילות אנטימיקרוביאלית כנגד מגוון רחב של פתוגנים במערכת העיכול שעשויים לגרום להופעת התסמינים, לרבות חיידקים כגון הליקובקטר פילורי, טפילים ופטריות (להרחבה ראו כאן) כמו כן, שמנים אתריים בעלי טעם מריר (ארומטיים מרירים) בצמח הכורכום מגרים לפעולה את בלוטות מערכת העיכול להפריש אנזימי לבלב ומיצי מרה(348-352) דרך גירוי עצב הואגוס ועל ידי גירוי ישיר של רירית מערכת העיכול ושחרור של ההורמון secretin. ולבסוף, לשמנים האתריים שבכורכום יש השפעה ישירה נוגדת עווית ומשככת כאב על שרירי צינור העיכול(343) דרך השפעה מעכבת על ידי קישור לא תחרותי לקולטנים כולינרגים, סרוטינרגים והיסטמינרגים(353).
מחלות כבד וכיס המרה
הקדמה | מחקרים קליניים | מנגנוני פעולה
הקדמה
מספר מחקרים קליניים מלמדים על השפעה מיטיבה של כורכום על פעילות הכבד וכיס המרה. כורכום מסדיר הפרעות בתפקוד הכבד הודות לפעילות נוגדת חמצון ונוגדת דלקת ומשפר מדדים מטבוליים בכבד שומני, מעודד את כיווציות כיס המרה ומסדיר את הפרשת המרה. מחקרים פרה-קליניים מדגימים הגנה על הכבד מפני שחמת, לייפת (פיברוזיס) והשפעות רעילות של חומרים שונים.
מחקרים קליניים
סקירה (2012) שבחנה את הפעילות הרפואית של כורכום (Curcuma longa) מצאה כי לצמח ישנה השפעה מטיבה במצבים רבים, בהם דלקות כיס ודרכי מרה, כמו גם השפעה מגינה על הכבד. פעילות הצמח הוכחה כנוגדת דלקת, מפחיתה רמות שומנים, ומשפרת תפקודי כבד(354).
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2013) בחן את ההשפעה של אבקת שורש כורכום מותסס על תפקודי הכבד של נבדקים עם אנזימי כבד (ALT) גבוהים בדם. 60 נבדקים בני 20 ומעלה עם עליה באנזימי כבד (40≥ ALT ≥200 יחידות לליטר) חולקו אקראית לנטילת אבקת שורש כורכום מותסס במינון 3 גרם ליום או פלסבו במשך 12 שבועות. 12 נבדקים לא השלימו את ההתערבות בשל חוסר היענות לטיפול, תופעות לוואי או פרישה מרצון. בתום ההתערבות נצפתה הפחתה מובהקת ברמת ה-ALT בקבוצת הכורכומין בהשוואה לפלסבו (p=0.019). בנוסף, חלה ירידה מובהקת (p=0.02) ברמות האנזים הכבדי AST בעקבות נטילת כורכום לעומת פלסבו, ומגמת ירידה לא מובהקת באנזים הכבדי GGT. לא חל שינוי ברמות האנזים ALP, בבילירובין הכללי ובפרופיל השומנים בדם בעקבות הטיפול. הטיפול נסבל היטב, ולא גרם לתופעות לוואי ולחריגות במדדים כגון גלוקוז בדם, ובמדדים נוספים של תפקוד הכבד והכליות: חלבון כללי, אלבומין, שתנן (BUN) וקריאטינין(355).
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2017) בחן את יעילות תוסף כורכום בהפחתת תנגודת לאינסולין וללפטין בכבד שומני לא אלכוהולי. 46 נבדקים שאובחנו כסובלים מכבד שומני לא אלכוהולי (טווח גילאים 20-60, BMI 24.9-40) חולקו אקראית לנטילת כמוסות אבקת כורכום במינון 3 גרם ליום או פלסבו במשך 12 שבועות. בתום ההתערבות נמצא כי כורכום הפחית במובהק את רמות הגלוקוז, האינסולין, את מדד התנגודת לאינסולין ואת רמות הלפטין (p<0.05 בכל המדדים) בהשוואה לפלסבו. שינויים במשקל, במדד מסת הגוף ורמות אנזימי הכבד בעקבות נטילת תוסף הכורכום לא היו מובהקים בהשוואה לפלסבו(356).
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2016) בחן את השְפעת הנטילה של כורכומין על תכולת השומן הכבדי ועל המדדים המטבוליים בכבד שומני. 77 נבדקים עם כבד שומני שאובחן בבדיקת אולטרסאונד ותסמיני התסמונת המטבולית (היקף מותניים≥ 102 ס"מ בגברים או ≥88 ס"מ בנשים, לחץ דם ≥130/85 מילימטר כספית, טריגליצרידים ≥1.7 מילימול לליטר, HDL ≤1.03 מילימול לליטר בגברים ו-1.29 בנשים, גלוקוז בצום≥6.1 מילימול לליטר) שאינם נוטלים תרופות חולקו אקראית לקבלת תוסף כורכומין במינון 500 מ"ג ליום (מינון שווה ערך ל-70 מ"ג כורכומין) או פלסבו במשך שמונה שבועות. בהשוואה לפלסבו, נטילת כורכומין הפחיתה במובהק את תכולת השומן הכבדי (ירידה של 78.9% לעומת 27.5%)(p<0.001), את משקל הגוף (p<0.001), את מדד מסת הגוף (p=0.002), את רמות (p<0.001) הכולסטרול הכללי וה-LDL (בשניהם), הטריגליצרידים (p=0.014), אנזימי הכבד (AST p=0.002, ALT p=0.001), רמות הגלוקוז בסרום (p=0.048) וההמוגלובין המסוכרר (p<0.001). רמת ה-HDL עלתה במובהק בקבוצת הכורכומין בהשוואה למצב הבסיס (p<0.01) אך לא בהשוואה לפלסבו. הטיפול באמצעות כורכומין היה בטוח ונסבל היטב(357).
מחקר קליני מבוקר פלסבו (1999) בחן את יעילות כורכום בטיפול בדיסקינזיה של דרכי המרה (Biliary dyskinesia). זוהי הפרעה תפקודית הגורמת לכיווץ דרכי המרה ולירידה בהפרשת מרה ומתבטאת בכאבים עוויתיים בצד הימני העליון של הבטן. 76 נבדקים הסובלים מכאבי בטן אופייניים כתוצאה מהפרעה בדרכי המרה חולקו לנטילת תמצית כורכום (סוג התמצית ומינונה אינם ידועים) או פלסבו במשך שלושה שבועות. בעקבות נטילת הכורכום חלה הפחתה מהירה יותר בכאב בהשוואה לפלסבו וזו ניכרה כבר בשבוע הראשון לטיפול. עם זאת לא נצפה יתרון לכורכום על פני פלסבו בשיפור המדדים המשניים של ההפרעה: אי סבילות למזון, בחילות, הקאות והתנפחות הבטן כתוצאה מגזים. הטיפול נסבל היטב, ללא תופעות לוואי. פרטים נוספים אינם ידועים היות שהמאמר המלא אינו נגיש לקריאה(358).
מחקר קליני אקראי כפול סמיות במבנה מצולב (1999) בחן את השְפעת הנטילה של כורכומין על נפח כיס המרה של נבדקים בריאים. 12 נבדקים בני 24-48 חולקו אקראית לנטילת כורכומין (סוג מיצוי לא צוין) במינון 20 מ"ג או פלסבו. נפח כיס המרה נמדד בבדיקת אולטרסאונד. נמצא שבעקבות נטילת הכורכומין חלה ירידה בנפח כיס המרה בהשוואה לפלסבו כתלות בזמן שחלף מן הנטילה (p<0.05). מידת ההפחתה בנפח כיס המרה כעבור חצי שעה, שעה, שעה וחצי ושעתיים מנטילת הצמח הייתה בשיעור של 11.8%, 16.8%, 22% ו-29.3% בהתאמה (מובהקות בהשוואה לפלסבו החל משעה לאחר הנטילה p=0.03 וכעבור שעה וחצי ושעתיים מנטילת הצמח p<0.001). מסקנת החוקרים היתה שכורכומין מעודד התכווצות של כיס המרה ומפחית את הסיכון להיווצרות אבני מרה(350).
מנגנוני פעולה
במחקרי בעלי חיים הדגימו כורכומין ושאר כורכומנואידים הגנה על הכבד מפני שחמת ולייפת. כורכומנואידים שמוצו מצמח הכורכום אף מגנים על הכבד מפני רעלים, תרופות שונות (תרופות כימותרפיות, תרופות נגד שחפת, להרחבה ראו כאן וכאן), הרעלת אלכוהול, מתכות רעילות, חלקיקי דלק, ניקוטין ועוד, על ידי פעילות נוגדת חמצון (נטרול רדיקלים חופשיים והפחתת ROS, העלאת רמות אנזימים נוגדי חמצון אנדוגניים: גלוטטיון, SOD, קטלאז, והפחתת חמצון שומנים על ידי הפעלת גורם השעתוק Nrf2), הגברת פעילות אנזימי הפאזה השניה בכבד המנטרלים רעלים ומפנים אותם מן הגוף, פעילות נוגדת דלקת (עיכוב מסלול השעתוק הדלקתי של NFkB והפעלת מסלול השעתוק האנטי דלקתי של PPARɣ, הפחתת רמות ציטוקינים דלקתיים INFɣ, TNFɑ, IL-1β, IL-6, ואנזימים פרו דלקתיים iNOS, COX2), עיכוב אפופטוזיס תאי (הפחתת רמות האנזים קספאז 3 והעלאת ביטוי Bax) ועיכוב אנזימים מפרקי מטריקס בין תאי (מטלופרוטאינים)(359-360).
כורכום ורכיביו מגינים מפני כבד שומני על ידי הפחתת הצטברות שומנים בכבד דרך הגברת ביטוי גורם השעתוק PPARɣ והפעלת חיישן האנרגיה התוך תאי AMPK (להרחבה ראו כאן), וכן מגן מפני אבני מרה ובעיות בזרימת המרה על ידי השריית כיווציות בכיס המרה(350). בנוסף, שמנים אתריים בעלי טעם מריר (ארומטיים מרירים) בצמח הכורכום מגרים לפעולה את בלוטות מערכת העיכול להפריש מיצי מרה(348-352) דרך גירוי עצב הואגוס ועל ידי גירוי של רירית מערכת העיכול ושחרור של ההורמון secretin.
סוכרֶת והתסמונת המטבוֹלית
הקדמה | מחקרים קליניים | מנגנוני פעולה
הקדמה
ממצאי המחקרים הקליניים אינם תומכים בהשפעה ההיפוגליקמית של כורכום, אולם כורכום וכורכומין נמצאו יעילים במניעת סוכרת בקרב נבדקים טרום סוּכרתיים על ידי הגברת הפרשת האינסולין מתאי הלבלב, הפחתת תנגודת לאינסולין והעלאת רמת האדיפונקטין.
כמו כן, כורכום לבדו או בשילוב עם רכיבים צמחיים נוספים נמצא יעיל בהפחתת סיבוכי סוכרת כגון נוירופתיה, נפרופתיה, כבד שומני, ירידה בתפקוד קוגניטיבי, מחלת כלי הדם הקטנים, וטרשת עורקים הודות לפעילות נוגדת דלקת ונוגדת חמצון. עם זאת, קיימת מחלוקת במחקרים לגבי יעילות כורכום וכורכומין לירידה במשקל ובייחוד להפחתת השומן הבטני, לאיזון רמות הכולסטרול והטריגליצרידים ולהפחתת הסיכון לתחלואה קרדיווסקולרית.
מחקרים קליניים
שימוש פנימי
טיפול בסוכרֶת | מניעת נזק חמצוני | מניעת טרשת עוֹרקים | עודף שוּמנים בדם
טיפול בסוכרֶת
סקירה (2013) שנערכה על כורכום (Curcuma longa) והשפּעת הצמח על סוכרת וסיבוכי סוכר מראה כי שימוש בכורכום מסייע להפחתת חמצון שומנים, הפחתת גלוטתיון ומדדי דלקת שונים ושמירה על מערכת העצבים בקרב חולי סוכרת. דרך כל זאת, נמצא כי כורכום מסייע למנוע סיבוכי סוכרת, בהם נוירופתיה סוכּרתִית, כבד שומני, השמנה, נפרופתיה ומחלות כלי דם(100).
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2012) בחן את יעילות תוסף כורכומין בדחיית ההופעה של סוכרת בקרב נבדקים טרום סוּכרתיים(14). 240 נבדקים (טווח גילאים 30-64) שאובחנו כטרום סוּכרתיים חולקו אקראית לקבלת תמצית יבשה של כורכום (תכולת כורכומנואידים של 75-85%) במינון 1500 מ"ג ליום או פלסבו במשך תשעה חודשים. בתום ההתערבות 16.4% מהנבדקים בקבוצת הביקורת פיתחו סוכרת ואילו בקבוצת הכורכומין אף לא אחד מן הנבדקים אובחן במחלה (p<0.001). כמו כן, כורכומין היה יעיל יותר במובהק מפלסבו בשיפור תפקוד תאי בטא (HOMA-β)(p<0.01), בהפחתת (p<0.001) התנגודת לאינסולין (HOMA-IR) והפחתת (p<0.05) כמות האינסולין המופרשת מתאי הלבלב (פפטיד C) ובהעלאת רמת האדיפונקטין (p<0.05).
מחקר קליני(361) אקראי ומבוקר פלסבו במבנה מצולב (crossover trial) (2010) בחן את השְפעת הנטילה של כורכום על מדדים גליקמיים לאחר מבחן העמסת גלוקוז בקרב נבדקים בריאים. 14 נבדקים חולקו אקראית לנטילת כמוסות אבקת כורכום במינון 6 גרם או פלסבו לפני מבחן העמסת גלוקוז (75 גרם). לא נצפתה השפעה מובהקת על רמות הגלוקוז בסרום בעקבות נטילת כורכום בהשוואה לפלסבו, עם זאת רמות האינסולין היו גבוהות במובהק שעתיים לאחר מבחן העמסת הגלוקוז (p<0.02). מסקנת החוקרים היתה שלכורכום עשויה להיות השפעה על כמות האינסולין המופרשת בתגובה לעלייה ברמות הגלוקוז.
מניעת נזק חמצוני
במחקר כפול-סמיות מבוקר פלסבו (2017) נבדקה היעילות של תוסף כורכומינואידים לשיפור הפעילות נוגדת החמצון בקרב חולי סוכרת סוג 2. במחקר השתתפו 118 חולי סוכרת סוג 2, אשר חולקו באופן אקראי לקבוצת הטיפול או לקבוצת הפלסבו למשך 8 שבועות. המשתתפים בקבוצת הטיפול נטלו 1,000 מ"ג כורכומינואידים יחד עם 10 מ"ג פיפרין ליום. נמצא כי בהשוואה לפלסבו, בקרב משתתפים שנטלו את התוסף חל שיפור מובהק בפעילות נוגדת החמצון (p<0.001). באופן ספציפי, חלה עלייה מובהקת במדדים TAC הנקרא גם: total antioxidant capacity ו-SOD, הידוע כ-superoxide dismutase וירידה (p<0.001) ב-MDA הידוע כ-malondialdehyde. שיפור זה היה בלתי תלוי ב-BMI וברמת האינסולין בצום של המשתתפים. ממצאי המחקר מצביעים כי לנטילת תוסף כורכומינואידים השפעה משמעותית על הפעילות נוגדת החמצון ויש להמשיך ולבחון מהי התרומה של כך להפחתת הסיכון הקרדיווסקולרי וסיבוכי הסוכרת(362).
מחקר קליני כפול-סמיות מצומצם (2014) בדק האם לכורכום וקינמון השפעה על התפקוד הקוגניטיבי בקרב משתתפים במצב טרום סוכרת שאינם מקבלים טיפול תרופתי. 48 משתתפים בגילאי 60 ומעלה שאובחנו זה לא מכבר בטרום סוכרת ( BMI=18.5-30, גלוקוז בצום 100-125) חולקו באופן אקראי לאחר צום לילה לקבלת פלסבו, 1 גרם כורכום, 2 גרם קינמון או כורכום+קינמון. התפקוד הקוגניטיבי של הנבדקים נבדק לפני הנטילה ושש שעות אחריה. בעקבות נטילת התוספים לא נצפו שינויים מובהקים ברמות הגלוקוז והאינסולין בדמם של הנבדקים לאחר הארוחה. החוקרים מצאו כי תוספת הכורכום הובילה לשיפור זיכרון העבודה (p=0.05), וכן לשיפור העמידות לאינסולין (p<0.01) אך לא לשינוי במרקרים של מחלת האלצהיימר (APP, PS1, PS2, GSK-3β). לא נצפתה תרומה מובהקת של קינמון לשינוי המדדים(363).
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2011) בחן את יעילות הטיפול בנפרופתיה סוכּרתִית באמצעות כורכום(105). 40 נבדקים החולים בנפרופתיה סוכּרתִית כתוצאה מסוכרת סוג 2 בעלי ערכי לחץ דם מאוזנים תרופתית (מעכבי ACE, חוסמי הקולטן לאנגיוטנסין) חולקו אקראית לנטילת תוסף כורכום במינון 1500 מ"ג ליום (מינון שווה ערך ל-66.3 מ"ג כורכומין) במשך חודשיים. בתום ההתערבות נמצא שכורכום יעיל בהפחתת מדדי הדלקת, עקה חמצונית ולייפת (TGF-β, TNF-α ו-IL-8) ובהפחתת החלבון והקריאטינין בשתן בנפרופתיה סוכּרתִית בהשוואה למצב הבסיס (TGF-β p<0.006, TNF-α לא מובהק, IL-8 p<0.02, פרוטאינוריאה p<0.001, קריאטינין לא מובהק) ובהשוואה לפלסבו (TGF-β p<0.006, TNF-α p<0.007, IL-8 לא מובהק, פרוטאינוריאה p<0.03, קריאטינין p<0.02).
מחקר קליני מבוקר(101) (2011) בחן את השְפעת הטיפול באמצעות תוסף כורכומין פוספוליפידי (Meriva) במחלת כלי דם קטנים בסוכרת (diabetic microangiopathy). במחקר, 25 נבדקים סוּכרתיים הסובלים ממחלת כלי הדם הקטנים לפחות חמש שנים ומקבלים טיפול תרופתי להפחתת רמת הסוכר בדם (לא מפורט במאמר) אך אינם מטופלים באינסולין נטלו תוסף כורכומין עטוף בפוספוליפיד במבנה פיטוזומלי (כורכומין ופוספטידיל כולין ביחס 1:2 (במינון 1 גרם ליום בנוסף לטיפול הקונבנציונאלי (תרופות לטיפול בסוכרת) במשך ארבעה שבועות. קבוצה דומה של נבדקים סוּכרתיים ששימשה כקבוצת ביקורת טופלה באמצעים קונבנציונאליים. בתום ההתערבות בקבוצת הכורכומין בהשוואה לקבוצת הביקורת נצפו שיפור במוליכות העור הכף הרגל (p<0.05 skin flux), שיפור ברפלקס כיווץ כלי הדם הפריפריים בעמידה (p<0.05 venoarteriolar response) הפחתה בבצקתיות (p<0.05 edema), ועליה בלחץ החמצן ברקמה התת עורית (p<0.05 PO2). לא נצפו תופעות לוואי או אינטראקציות עם התרופות.
מניעת טרשת עוֹרקים
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2014) בחן את השְפעת תוסף כורכומין על גורמי סיכון להתפתחות טרשת עורקים בקרב חולי סוכרת(364). 240 נבדקים חולי סוכרת (בני 35 ומעלה, גלוקוז בצום ≥126, גלוקוז ≥200 מ"ג לדציליטר שעתיים לאחר מבחן סבילות לגלוקוז, HbA1c ≥6.5) שאינם נוטלים תרופות חולקו אקראית לקבלת מיצוי כורכומין (תמצית יבשה עם תכולת כורכומנואידים של 75-85%) במינון 250 מ"ג או פלסבו במשך שישה חודשים. בתום ההתערבות נמצא כי בהשוואה לפלסבו, מיצוי הכורכומין הפחית במובהק את מהירות גל הדופק (Pulse wave velocity, מדד לקשיון העורקים)(p<0.01), את מדד התנגודת לאינסולין (HOMA-IR)(p<0.01), את רמות הלפטין (p<0.01), הטריגליצרידים (p<0.01), חומצת השתן (p<0.01), השומן הבטני (p<0.05) והשומן הכללי (p<0.01) והעלה במובהק את רמות האדיפונקטין (p<0.01). עוד נצפתה מגמה לא מובהקת של הפחתה ב-BMI וביחס ההשמנה הבטנית להיקף המותניים, ברמות ה-LDL, הכולסטרול הכללי והאנזים הכבדי ALT, ועליה לא מובהקת ברמת ה-HDL. מסקנת החוקרים היתה שהטיפול באמצעות כורכומין יעיל לשיפור מדדים מטבוליים ולהפחתת גורמי סיכון להתפתחות טרשת עורקים בקרב חולי סוכרת.
עודף שוּמנים בדם
בסקירה (2019)(365) מפורטים רכיבים טבעיים, שנמצאו במחקרים פרה-קליניים וקליניים בעלי תרומה להורדת רמת ליפופרוטאין (a) בדם, שכן רמה גבוהה נמצאה קשורה בסיכון מוגבר לתחלואה קרדיווסקולרית. לגבי כורכומנואידים שמוצו מצמח הכורכום נכתב כי הם בעלי יכולת מוכחת מחקרית להורדת רמות הכולסטרול והטריגליצרידים ולהעלאת ה-HDL בפלסמה על ידי ויסות ביטוי גנים ופעילות של אנזימים המעורבים בחילוף חומרים של ליפופרוטאינים. כמו כן מחקר קליני אקראי מבוקר שבחן את יעילות תוסף כורכומנואידים (C3 complex) בשיפור פרופיל הליפידים בקרב נבדקים הסובלים מהתסמונת המטבולית, מצא כי נטילה של תוסף כורכומנואידים במינון של 1 גרם ליום בשילוב תמצית פיפרין (בריכוז 100:1) למשך שמונה שבועות הפחיתה את רמות הליפופרוטאין (a) בסרום ב-9.7% בהשוואה למצב הבסיס.
בסקירה (ינואר 2018) הוערכו העדויות ממחקרים פרה-קליניים וקליניים בנוגע ליעילות של כורכומין לשיפור פרופיל השומנים בדם, בהשוואה לסטטינים(366). מהסקירה עולה כי כורכומין יעיל בעיקר להפחתת רמת טריגליצרידים, בעוד שסטטינים יעילים בעיקר להפחתת LDL. בנוסף, בסקירה מפורטת ההשפעה של כורכומין ושל סטטינים על מגוון גורמים מולקולריים ומטבוליים הקשורים בפעילות הכולסטרול והשומנים בגוף, כאשר באופן כללי לכורכומין ולסטטינים השפעה על אותם גורמים. כמו כן לשניהם השפעה על אותם מסלולים הקשורים בפעילות הכולסטרול, כולל ספיגת הכולסטרול מהתזונה, פינוי הכולסטרול מהדם, נשיאת הכולסטרול ופינוי הכולסטרול מהרקמות ההיקפיות.
בהתייחס לפעילות נוגדת חמצון, נמצא כי הפעילות של כורכומין לנטרול רדיקלים חופשיים מגבילה את חמצון הכולסטרול ובכך מסייעת למניעת תגובה דלקתית שהינה הבסיס לטרשת עורקים ותחלואה קרדיווסקולרית. החוקרים מסכמים כי כורכומין הינו בטוח ונסבל היטב, כאשר טיפול משולב של כורכומין וסטטינים עשוי להיות יעיל יותר מאשר טיפול בסטטינים בלבד להורדת השומנים בדם ולהפחתת הסיכון הקרדיווסקולרי.
מטה-אנליזה (2014) אשר כללה חמישה מחקרים קליניים אקראיים ומבוקרים (133 נבדקים בקבוצות הכורכומין ו-90 בקבוצות הביקורת) מצאה כי נטילת תוספי כורכום אינה יעילה לשיפור פרופיל השומנים בדם (כולסטרול כללי p=0.19, כולסטרול p=0.12 LDL, כולסטרול p=0.28 HDL, וטריגליצרידים p=0.75) ולהפחתת הסיכון הקרדיווסקולרי לאור הטרוגניות גדולה בתוצאות המחקרים(367).
להלן פירוט שלושה מהמחקרים שנכללו במטא אנליזה:
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2007) בחן את השְפעת הנטילה של כורכומין על פרופיל השומנים של נבדקים מבוגרים. 36 מבוגרים בני חמישים ומעלה חולקו אקראית לנטילת כורכומין בכמוסות או באבקה לנטילה עם המזון (סוג מיצוי לא צוין) במינון 4 גרם ליום, 1 גרם ליום או פלסבו למשך שישה חודשים. הנבדקים המשיכו ליטול את הטיפול התרופתי שלהם לאורך תקופת ההתערבות ובנוסף נטלו כמוסה אחת ליום של תמצית עלי גינקו בילובה (מתוקננת להכיל 24% גִינקולידים ו-6% בילובלידים) במינון 120 מ"ג ליום. ריכוז הכורכומין בפלסמה היה גבוה יותר בממוצע בעקבות נטילת כמוסות בהשוואה לאבקה. בתום ההתערבות לא נמצאה השפעה מובהקת של כורכומין בכל המינונים על רמות הטריגליצרידים, הכולסטרול הכללי, ה-LDL וה-HDL. עם זאת נצפה מתאם חיובי מובהק בין ריכוז הכורכומין בפלסמה ובין רמות הכולסטרול בסרום. מכאן שליעילות הספיגה של כורכומין יש חשיבות מכרעת במידת ההשפעה של הצמח על רמות הכולסטרול(368).
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2008)בחן את השְפעת הנטילה של כורכומין על פרופיל השומנים בקרב חולים בתסמונת כלילית חריפה (Acute coronary syndrome). שבעים וחמישה (75) נבדקים שאובחנו בתסמונת כלילית חריפה חולקו אקראית לנטילת פלסבו או כורכומין במינון 45, 90 או 180 מ"ג ליום במשך חודשיים. הנבדקים הונחו להמשיך ליטול טיפול תרופתי במהלך ההתערבות (מעכבי ACE, סטטינים, ותרופות נגד סוכרת). 63 נבדקים השלימו את ההתערבות. בתום ההתערבות לא נצפתה השפעה מובהקת של כורכומין על רמות הכולסטרול הכללי, ה-LDL וה-HDL בהשוואה לפלסבו. עם זאת, נצפתה מגמה לא מובהקת של הפחתה ברמות הכולסטרול הכללי וה-LDL והעלאה של רמות ה-HDL, ומגמת ההפחתה הגבוהה ביותר היתה בקבוצת המינון הנמוך בהשוואה לקבוצת המינון הבינוני וקבוצת המינון הגבוה. לגבי רמות הטריגליצרידים, מגמת ההפחתה הלא מובהקת היתה גבוהה יותר בקבוצת המינון הגבוה בהשוואה לקבוצת המינון הנמוך וקבוצת המינון הבינוני(369) .
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2008) בחן את השְפעת תוסף כורכומנואידים (NCB-02) על תפקוד וסקולרי-אנדותלי לקוי בקרב חולי סוכרת. 72 נבדקים חולי סוכרת לא תלוית אינסולין עם תפקוד וסקולרי-אנדותלי לקוי חולקו אקראית לנטילת תוסף המכיל תמצית תקנית של כורכומנואידים (מתוקננת להכיל 78% כורכומנואידים, מתוכם 72% כורכומין) במינון 300 מ"ג ליום, Atrovastatin (במינון 10 מ"ג ליום) או פלסבו במשך שמונה שבועות. 67 נבדקים השלימו את ההתערבות. בהשוואה למצב הבסיס נצפה שינוי מובהק בתפקוד האנדותלי, והפחתה בעקה החמצונית (לפי רמות המלונדיאלדהידים), ברמות הפפטיד אנדותלין 1 (המכווץ את כלי הדם) וברמות הציטוקינים הדלקתיים אינטרלוקין 6 ו-TNFɑ בקבוצת הכורכומנואידים ובקבוצת ה-Atrovastatin אך לא בקבוצת הפלסבו(370).
במחקר קליני כפול-סמיות מבוקר פלסבו (2017) נבדקה היעילות של תוסף כורכומנואידים בתוספת תמצית פלפל שחור (פיפרין) להגברת הספיגה (Curcuminoids C3 Complex ®, Sabinsa), לשיפור פרופיל השומנים בקרב חולי סוכרת סוג 2. במחקר נכללו 118 מטופלים, אשר חולקו באופן אקראי לקבלת תוסף הכורכומין (1,000 מ"ג/יום + 10 מ"ג/יום פיפרין) או פלסבו, בנוסף לטיפול הסטנדרטי, למשך 12 שבועות. נמצא כי בהשוואה לפלסבו, נטילת תוסף הכורכומין הייתה מלווה בירידה מובהקת (p<0.05) ברמת הכולסטרול הכללי, ברמת הכולסטרול שאינו HDL וברמת ליפופרוטאין a וכן בעלייה ברמת HDL. לא נמצאו הבדלים בין הקבוצות ביחס לרמת ה-LDL והטריגליצרידים (p>0.05). החוקרים מסכמים כי נטילת תוסף כורכומין עשויה לתרום לשיפור פרופיל השומנים בקרב חולי סוכרת סוג 2 ובכך להפחית את הסיכון הקרדיווסקולרי(371).
הערת מערכת: המחקר מומן ע"י קרן מחקר איראנית, כאשר אחד החוקרים הוא המייסד של חברת Sabinsa המייצרת את התוסף וסיפקה אותו למחקר.
מחקר קליני (2016) אקראי ומבוקר פלסבו בחן את השְפעת כורכומין על המדדים המטבוליים הנלווים לכבד שומני. 102 נבדקים הסובלים מכבד שומני מאובחן (בדרגה 1-3 לפי בדיקת אולטרסאונד של הכבד) חולקו אקראית לנטילת תוסף כורכומין עטוף בפוספוליפיד במבנה פיטוזומלי (כורכומין ופוספטידיל כולין ביחס 1:2, תכולת כורכומין 20% בערך) במינון 1000 מ"ג ליום או פלסבו במשך שמונה שבועות. כמו כן, כל הנבדקים קיבלו המלצות דיאטה ואורח חיים. 86 נבדקים השלימו את ההתערבות. נטילת כורכומין הובילה להפחתה מובהקת ברמות כולסטרול מסוג LDL והכולסטרול הכללי (p<0.001), טריגליצרידים (p<0.001), הגלוקוז בצום (p=0.035), ההמוגלובין המסוכרר (HbA1c, p=0.004) והחומצה האורית (p<0.001) ולעליה מובהקת (p=0.017) ב-HDL בסרום של הנבדקים בהשוואה למצב הבסיס, ללא השפעה על רמת האינסולין ועל מדד התנגודת לאינסולין (HOMA-IR). נטילת כורכומין היתה יעילה יותר מפלסבו (p<0.001) בהפחתת הכולסטרול הכללי, כולסטרול מסוג LDL, הטריגליצרידים (p<0.001), וחומצת השתן (p<0.001). עם זאת, לא נצפה יתרון מובהק של כורכומין על פני פלסבו בהשפעה על רמות ה-HDL והגלוקוז בסרום של הנבדקים. כורכומין היה בטוח לשימוש ונסבל היטב(372).
מחקר קליני אקראי וכפול-סמיות (2014) בחן את השְפעת תוסף כורכומין על משקל הגוף, רמות הגלוקוז ופרופיל השומנים בקרב הסובלים מהתסמונת המטבולית. 65 נבדקים חולקו אקראית לקבלת תמצית תקנית של כורכום (מתוקננת להכיל 95% כורכומנואידים) במינון 1890 מ"ג ליום או פלסבו במשך 12 שבועות. בתום ההתערבות, נמצא כי כורכומין יעיל בהפחתת רמות ה-LDL כולסטרול (p<0.01) בהשוואה לפלסבו, ונצפתה מגמה לא מובהקת של שיפור פרופיל השומנים (כולסטרול כללי, טריגליצרידים, HDL) בקבוצת הכורכומין בהשוואה לפלסבו. עם זאת, לא נרשם יתרון לטיפול באמצעות כורכומין על פני פלסבו בירידה במשקל ובאיזון הסוכר(373).
מחקר קליני אקראי ומבוקר (2015) בחן את הבטיחות והיעילות של כורכומין (Biperine®) בטיפול בתסמונת המטבולית עם סבילות נמוכה לגלוקוז והצטברות שומן ויסצרלי. 44 נבדקים שהדגימו ירידה של למעלה מ-2% במשקל לאחר דיאטה של שלושים ימים, חולקו אקראית לנטילת תמצית כורכום מתוקננת להכיל 95% כורכומין בשילוב פוספטידילסרין ופיפרין במינון 1600 מ"ג ליום או פוספטידילסרין במינון 400 מ"ג במשך חודש. חודש לאחר התערבות נמצא שמתן כורכומין הגביר את הירידה במשקל מ-1.88 ל-4.91%, הגביר את שיעור ההפחתה בשומן הגוף (מ-0.7 ל-8.43%), הגביר את שיעור ההפחתה בהיקף המותניים (מ-2.36 ל-4.14%), הגביר את שיעור ההפחתה בהיקף המותניים (מ-0.74 ל-2.51%) והגביר את שיעור ההפחתה ב-BMI (מ-2.10 ל-6.43%)(p<0.01 בכל המדדים). פוספטידילסרין לבדו לא הדגים כל השפעה מובהקת סטטיסטית. ההבדלים בין תוסף כורכומין ובין תוסף פוספטידילסרין היו מובהקים בכל המדדים (בירידה במשקל p<0.05, בשומן הגוף p<0.01, בהיקף המותנים p<0.05, וב-BMI p<0.01). הטיפול נסבל היטב ולא היתה נשירת נבדקים מן המחקר(374).
מחקר קליני אקראי כפול-סמיות (2015) בחן את היעילות של נטילת אבקת כורכום (Curcuma longa) ואבקת זרעי קצח (Nigella sativa), כל אחד בנפרד או במשולב, בקרב הסובלים מהתסמונת המטבולית. במחקר השתתפו 250 גברים בריאים לכאורה אשר אובחנו עם תסמונת מטבולית. המשתתפים חולקו באופן אקראי ל-4 קבוצות, הראשונה קיבלה 1.5 גרם אבקת זרעי קצח ליום, השנייה קיבלה 2.4 גרם אבקת כורכום ליום, השלישית קיבלה 900 מ"ג אבקת זרעי קצח ליום + 1.5 אבקת גרם כורכום ליום והרביעית קיבלה פלסבו. לאחר 8 שבועות נמצא כי במשתתפים שנטלו אבקת קצח חל שיפור בפרופיל השומנים (טריגליצרידים p=0.001, כולסטרול כללי p=0.02, כולסטרול LDL p<0.001 כולסטרול HDL p=0.02) וברמת הגלוקוז בצום (p=0.02), ובמשתתפים שנטלו אבקת כורכום חלה ירידה בערכי הכולסטרול הכללי (p=0.009), ה-(LDL (p<0.001 ובמדד הדלקת (CRP (p<0.001 בהשוואה לפלסבו. גם במשתתפים שנטלו את הטיפול המשולב, למרות המינון היחסי הנמוך יותר, חל שיפור בכל המדדים המטבוליים ביחס לפלסבו (CRP p=0.007, אחוזי שומן p=0.04, כולסטרול p=0.02, גלוקוז בצום p<0.001, טריגליצרידים p=0.03, כולסטרול HDL p=0.04, כולסטרול p<0.001 LDL), וביחס לנתוני הבסיס(375).
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2014) בחן את השְפעת תוסף כורכומנואידים בתוספת פיפרין (C3 complex®) להגברת הזמינות הביולוגית על רמות הליפידים בסרום של חולים בתסמונת המטבולית(376). 100 נבדקים (טווח גילאים 25-75) שאובחנו כסובלים מהתסמונת המטבולית (לפי הקריטריונים הבאים: היקף מותניים≥102 ס"מ בגברים או ≥88 ס"מ בנשים, לחץ דם≥130/85 מ"מ כספית, טריגליצרידים≥1.7 מילימול לליטר, HDL≤1.03 מילימול בגברים ו-1.29 מילימול בנשים, גלוקוז בצום≥6.1 מילימול לליטר)חולקו אקראית לנטילת תוסף כורכומנואידים במינון 1000 מ"ג ליום בשילוב תמצית פיפרין (בריכוז 100:1) או פלסבו במשך שמונה שבועות. בתום ההתערבות נמצא יתרון מובהק לכורכומנואידים בשילוב עם פיפרין על פני פלסבו בהפחתת רמות ה-LDL, ה-non-HDL, הכולסטרול הכללי, הטריגליצרידים וליפופרוטאין (a) ובהעלאת רמות ה-HDL. עם זאת, לא נצפה יתרון לטיפול בכורכומנואידים על פני פלסבו בהפחתת רמות ה-LDL מהסוג הקטן והדחוס (הסוג המקושר ביותר לתהליכים טרשתיים). ההבדלים בין הקבוצות בהפחתת רמות הטריגליצרידים (p=0.003), הכולסטרול הכללי (p=0.042), ליפופרוטאין (p<0.001) וכולסטרול non-HDL במובהקות (p=0.009) אך לא כולסטרול מסוג HDL - (מובהקות p=0.235) וכולסטרול מסוג -LDL (מובהקות p=0.833) נותרו מובהקים גם לאחר תיקון הממצאים כך שיבוטל ההבדל המובהק בין הקבוצות במדד מסת הגוף של הנבדקים (BMI) במצב הבסיס.
במחקר קליני קטן ובלתי מבוקר (1992) נבחנה השְפעת כורכומין על חמצון שומנים ועל רמות הכולסטרול בקרב 10 נבדקים בריאים(377). 10 נבדקים נטלו כורכומין במינון 500 מ"ג ליום במשך שבעה ימים. בתום ההתערבות נצפתה ירידה מובהקת בחמצון השומנים (33%), בכולסטרול הכללי (11.63%) ועליה מובהקת (29%) ב-HDL בהשוואה למצב הבסיס (p<0.05 בכל המדדים).
שימוש חיצוני
במחקר פיילוט מבוקר פלסבו (2016) נבדקה היעילות והבטיחות של קרם צמחי להקלה על כאב נוירופתי על רקע סוכרת סוג 2. במחקר נכללו 50 מטופלים, הסובלים מלפחות שני מאפיינים של כאב נוירופתי בכפות הרגליים, אשר חולקו אקראית לשימוש בקרם צמחי או בקרם פלסבו - פעמיים ביום למשך 6 חודשים. הרכיבים הפעילים בקרם הצמחי כללו: שוש קירח (Glycyrrhiza glabra) כ-0.2%, בננה (Musa paradisiaca) כ-19.42%, כורכום (Curcuma longa) כ-2.43%, שמן אתרי פנדנוס (Pandanus odoratissimus) כ-9.70%, אלוורה (Aloe vera) כ-4.85% וחלב קוקוס. נמצא כי חל שיפור מובהק בתסמינים בקרב 77% מהמטופלים בקבוצת הקרם הצמחי לעומת 12.5% בקבוצת קרם הפלסבו (p<0.001). בשתי הקבוצות לא דווח על השפעות שליליות. החוקרים מסכמים כי השימוש בקרם הצמחי עשוי לתרום כטיפול משלים לחולי סוכרת סוג 2 הסובלים מכאב נוירופתי(378).
מנגנוני פעולה
הקדמה
כורכומין מעלה הפרשה של אדיפונקטין מרקמת השומן(379) ובאמצעותו מפעיל(262,380) את מסלול האנזים התוך תאי AMPK-activated protein kinase. אנזים זה מתפקד כחיישן של אנרגיה תאית. כשהוא מופעל הוא מפעיל מסלולים קטבוליים המייצרים ATP ועוצר מסלולים אנאבוליים הצורכים על ידי השפעה על גורמי שעתוק ופעילות של אנזימים מטבוליים. הפעלת מסלול AMPK מתבצעת ככל הנראה על ידי שינוי מאזן האנרגיה התוך תאית (יחס AMP:ATP). הפעלת מסלול האנזים AMPK משפיעה על מגוון תהליכים הקשורים בפתוגנזה של סוכרת ותסמונת מטבולית(380).
הגברת שרידות תאים בלבלב וויסות ייצור והפרשה של אינסולין
כורכומין מגביר שרידות תאי בטא ומפחית ייצור רדיקלים חופשיים(381-392) על ידי עיכוב מסלול NFkB ועיכוב ייצור ציטוקינים דלקתיים (TNFα, IL-1β, INFγ) ועל ידי הגברת פעילות אנזימים נוגדי חמצון אנדוגניים (SOD, CAT, GSH-Px) דרך הפעלת מסלול גורם השעתוק Nrf2 והעלאת ביטוי חלבוני חישת העקה Heme oxygenase-1.
כורכומין מעודד הפרשת אינסולין על ידי הגברת ביטוי הנשא GLUT2 הנושא את הגלוקוז אל תוך תא בטא בלבלב ועל ידי הגברת ביטוי האנזים גלוקוקינאז המהווה סמן לשחרור אינסולין על ידי פתיחת תעלות יונים והשריית פעילות חשמלית בממברנת התאים(383).
כורכומין מנטרל דיכוי הפרשת אינסולין בשל חשיפה ממושכת לציטוקינים דלקתיים וחומצות שומן חופשיות(384).
הפחתת רמות גלוקוז בדם דרך הגברת גליקוליזה ועיכוב גלוקונאוגנזה
כורכומין מפחית ביטוי של אנזימים המשתתפים בתהליך הגלוקונאוגנזה בכבד(100,385-387): הפחתת ביטוי (glucose-6-phosphatase (G6Paseיו-(phosphoenolpyruvate carboxykinase (PEPCK.
מעודד ייצור גליקוגן בשרירי השלד ומעלה ביטוי של אנזימים המשתתפים בגליקוליזה בשרירים ובכבד.
הפחתת עמידות לאינסולין בתאים/איזון שומני הדם
כורכומין מעלה את הביטוי הגנטי של PPAR גמא, קולטן גרעין וגורם שעתוק שיש לו השפעה מרכזית על קצב חילוף החומרים של גלוקוז ושומנים. הגברת הביטוי הגנטי של PPAR גמא מובילה ל:
ויסות התגובה הדלקתית על ידי ויסות מסלול חישת העקה JNK וכתוצאה מכך עיכוב NF-KappaB
דלקת תת קלינית ועקה חמצונית קשורים לעמידות לאינסולין ולסיכון מוגבר להתפתחות סוכרת. ציטוקינים דלקתיים כגון TNFɑ, IL-1β, IL-6, ניטריק אוקסיד וכו' משתחררים ממקרופג'ים ברקמת השומן בתהליך הדלקתי(387). ציטוקינים אלה מפעילים את מסלול חישת העקה JNK שבתורו משבש את מנגנון האיתות של האינסולין לקולטנים ומעודד עמידות לאינסולין. כורכומין מפחית את רעילות חיידקית (אנדוטוקסמיה) המקושרת להתפתחות שמנות ועמידות לאינסולין על ידי שינוי הרכב חיידקי המעי, העלאת ביטוי החלבונים אוקלודין וזונולה-אוקלודין-1 (ZO-1) המווסתים את חדירות המעי בצומתי החסימה ומגינים על שלמות מחסום המעי, ועדוד הפרשה של ציטוקינים מתאי האפיתל והרקמה הלימפואידית המשפרים את ההגנה החיסונית(395). כמו כן, כורכומין מפחית את התגובה הדלקתית התורמת להתפתחות המחלה. כך למשל, במחקר(100) שנערך בחולדות שהוזנו בדיאטה עתירת שומן כורכומין הפחית עמידות לאינסולין על ידי העלאת אדיפונקטין ו-PPARɣ ועיכוב NF-Kappa B דרך השפעה על מסלול האיתות JNK. דלקת תת קלינית ועקה חמצונית קשורים אף להתפתחות סיבוכים מאוחרים של סוכרת. כורכומין מספק הגנה מפני סיבוכי סוכרת ברקמת כלי הדם, בעיניים ובכליות על ידי עיכוב מסלול האיתות JNK המופעל על ידי עקה חמצונית ותוצרי גליקציה סופיים (Advanced glycation end products).
מניעה והפחתה של סיבוכי סוכרת כגון קטרקט, קרדיומיופתיה, נפרופתיה, ריפוי פצעים
כורכומין מפחית את הנזקים המשניים לסוכרת: החלמה לקויה מפציעות, נזקים חמצוניים לכליות, נוירופתיה, רטינופתיה וניוון מקולרי, מחלות כבד הקשורות בסוכרת (כגון כבד שומני), טרשת עורקים וקרדיומיופתיה, הודות לפעילות נוגדת חמצון (הפחתת ROS, מלונדיאלדהידים ו-TBARS שהם תוצרי לוואי של חמצון שומנים) ונוגדת דלקת (עיכוב TNF אלפא, והפחתת רמות הציטוקינים הפרו דלקתיים IL-1β ו-IL-6). כמו כן, במחקרי מעבדה נמצא כי כורכומין מעכב של פעילות האנזים אלדוז רדוקטאז (Aldose reductase) שמעורב בתהליך הפיכת עודפי גלוקוז לסורביטול, ואת פעילות האנזים סורביטול דהידרוגנאז (Sorbitol dehydrogenase) ההופך סורביטול לפרוקטוז. משקעי סורביטול ופרוקטוז מעורבים אף הם בגרימת נזקים משניים של סוכרת (כגון רטינופתיה ונפרופתיה)(100,396).
מחלות לב וכלי דם
הקדמה | מחקרים קליניים | מנגנוני פעולה
הקדמה
מחקרים קליניים הדגימו כי כורכומין משפר את פרופיל השומנים בדם, מפחית חמצון שומנים, משפר את תפקוד כלי הדם על ידי הפחתת תהליכים דלקתיים בעורקים והגברת הזמינות הביולוגית של חנקן חמצני (NO), משפר את זרימת הדם ומפחית את לחץ הדם הסיסטולי. ממחקרים פרה-קליניים עולה כי כורכומין מפחית פגיעות בשריר הלב הודות לפעילותו נוגדת החמצון ומפחית פגיעות בכלי הדם עקב סוכרת הודות לפעילות נוגדת דלקת.
מחקרים קליניים
סדרת מחקרים קליניים לא מבוקרים שבוצעה על מספר קטן יחסית של נבדקים בחנה את השְפעת הנטילה של מיצוי הידרו אלכוהולי של כורכום על גורמי סיכון קרדיווסקולריים (חמצון שומנים, רמות אפוליפופרוטאינים ורמות פיברינוגן).
במחקר הראשון (1995) נבחנה השְפעת מיצוי הידרו אלכוהולי(397) של כורכום על חמצון שומנים בקרב 18 נבדקים בריאים בני 27-67. נמצא כי נטילה של מיצוי כורכום (מינון שווה ערך ל-20 מ"ג כורכומין) במשך 45 ימים הפחיתה את חמצון השומנים (לפי רמות המלונדיאלדהידים) ב-60% בהשוואה למצב הבסיס (p<0.05).
במחקר השני (1997) מינון זהה של תמצית הכורכום כורכום (שווה ערך ל- 20 מ"ג כורכומין) ניתן לשלושים נבדקים בריאים (בני 60-90) במשך שישים ימים. בתום ההתערבות נצפתה הפחתה של 25% ו-50% בחמצון ה-HDL וה-LDL בהתאמה בהשוואה למצב הבסיס. עוצמת ההפחתה היתה רבה יותר בקרב נבדקים עם רמות גבוהות של חמצון שומנים לפני ההתערבות(398).
במחקר השלישי (2000) נבחנה השְפעת תמצית הכורכום על רמות אפוליפופרוטאינים בקרב 30 נבדקים בריאים (בני 24-70). מיצוי הידרואלכוהולי של כורכום במינון שווה ערך ל-20 מ"ג כורכומין ניטל על ידי הנבדקים במשך 30 ימים(399). בתום ההתערבות נמצא שכורכום הפחית במובהק את רמות אפוליפופרוטאין Bי(Apo B)י(p<0.05) וה-LDLי(p<0.01) המקושרים לסיכון מוגבר לטרשת עורקים והגביר במובהק את רמות אפוליפופרוטאין Aי(Apo A)י(p<0.01) וה-HDLי(p<0.01) הנחשבים לגורמים מגנים מפני טרשת עורקים בהשוואה למצב הבסיס. כמו כן, נצפתה הפחתה מובהקת ביחס Apo B/Apo A (גורם המנבא את מידת הסיכון להתפתחות טרשת)(p<0.01).
במחקר הרביעי (2000) נבחנה השְפעת תמצית הכורכום על רמות הפיברינוגן (חלבון קרישה המיוצר בכבד) בקרב 8 נבדקים הסובלים מקרישיות יתר (עם רמות פיברינוגן חריגות)(400). מיצוי הידרואלכוהולי של כורכום במינון שווה ערך ל-20 מ"ג כורכומין ניטל על ידי הנבדקים במשך 15 ימים. בתום ההתערבות נמצא שכורכום הפחית במובהק את רמות הפיברינוגן בדמם של הנבדקים (p<0.05).
מחקר קליני מבוקר פלסבו (2015) בו נבדקה התרומה של כורכומין (Longvida®) לשיפור תפקוד כלי הדם על ידי הגברת הזמינות הביולוגית של חנקן חמצני (NO). במחקר השתתפו 29 מבוגרים בגילאי 45-74 אשר קיבלו 2,000 מ"ג ליום כורכומין (כורכומין תקני משולב בפוספוליפידים במבנה חלקיקי פטנטי SLCP* - כל כמוסה מכילה 80 מ"ג כורכומין) או פלסבו למשך 12 שבועות(401). נמצא כי תפקוד כלי הדם (FMDba) השתפר ב-34% בקבוצת הכורכומין ואילו בקבוצת הפלסבו לא חל שינוי מובהק בהשוואה לנתוני הבסיס (p<0.01 בהשוואה לפלסבו ו-p<0.001 בהשוואה למצב הבסיס). עוד נמצא שיפור של 44% במדד delta FBFach ועלייה בזמינות הביולוגית של חנקן חמצני בקבוצת הכורכומין, בהשוואה לקבוצת הפלסבו (p<0.05 בהשוואה לפלסבו ו-p=0.06 בהשוואה למצב הבסיס).
* Solid Lipid Curcumin Particle Technology.
מחקר קליני השוואתי אקראי כפול סמיות ומבוקר (2012) בחן את השְפעת הנטילה של כורכומין בהשוואה לפעילות גופנית אירובית על התפקוד האנדותלי של כלי הדם בקרב נשים לאחר גיל המעבר. 32 נשים בריאות לאחר גיל המעבר חולקו אקראית לשלוש קבוצות: קבוצת ביקורת, קבוצת פעילות גופנית אירובית וקבוצת כורכומין. בקבוצת הכורכומין ניטל תוסף כורכומין בעל ספיגה משופרת* במינון 150 מ"ג במשך שמונה שבועות. נמצא כי כורכומין היה יעיל כמו פעילות גופנית בשיפור זרימת הדם ובהפחתת לחץ הדם הסיסטולי (ללא השפעה על קצב הלב או על לחץ הדם הדיאסטולי). לא נצפו שינויים מובהקים בלחץ הדם ובזרימת הדם בקבוצת הביקורת(402).
*(כורכומין תקני משולב בפוספוליפידים במבנה חלקיקי פטנטי SLCP* -Solid Lipid Curcumin Particle Technology)
מחקר קליני מבוקר פלסבו בחן את השְפעת כורכומין (Longvida®) על התפקוד האנדותלי של כלי הדם ועל קשיון העורקים בקרב נבדקים בריאים בגיל העמידה ובגיל המבוגר. 39 נבדקים בריאים (גברים ונשים מגיל המעבר ואילך, טווח גילאים 45-74) בעלי אורח חיים יושבני חולקו לנטילת התוסף (כורכומין תקני משולב בפוספוליפידים במבנה חלקיקי פטנטי SLCP*) במינון 2000 מ"ג ליום (מינון שווה ערך ל-400 מ"ג כורכומין) או פלסבו במשך 12 שבועות. החוקרים מציינים כי לפני ההתערבות לא היו הבדלים מובהקים במאפייני שתי הקבוצות, למעט הבדל מובהק במסת הגוף וצריכת החלבונים בתזונה (p=0.02) שהיו גבוהים יותר בקבוצת הפלסבו (p=0.03). בתום ההתערבות, בקבוצת הכורכומין חל שיפור של 37% בגמישות עורקי הזרוע בהשוואה למצב הבסיס (לפי שיפור בזרימת הדם בתגובה לאצטיל כולין) (p=0.03-0.001), ואילו בקבוצת הפלסבו לא נצפה שיפור מובהק (p=0.1-0.2). השפעה זו הוכחה כקשורה לפעילות נוגדת החמצון של כורכומין ולהעלאת רמת הניטריק אוקסיד בתאי האנדותל. לכורכומין לא היתה השפעה מובהקת על קשיון העורקים ועל מדדי דלקת בסרום(403).
במחקר קליני(404) (2019) כפול-סמיות מבוקר פלסבו הוערכה ההשפעה של תוסף כורכומין בעל זמינות ביולוגית גבוהה (®CurQfen) על מדדי סיכון קרדיווסקולריים ועל תפקוד כלי הדם בקרב גברים צעירים עם שמנות. במחקר נכללו 22 גברים בגילאי 18-35 עם BMI גבוה מ-30, אשר חולקו אקראית לנטילת תוסף כורכומין או פלסבו - במינון 500 מ"ג ליום למשך 12 שבועות. תוסף הכורכומין הכיל 193 מ"ג כורכומינואידים (38.6%) בשילוב סיבי חילבה מסיסים לשיפור הזמינות הביולוגית וכמוסות הפלסבו הכילו סיבי חילבה מסיסים בלבד. בתקופת המחקר המשתתפים התבקשו להמשיך את דפוסי התזונה והפעילות הגופנית הרגילים שלהם. נמצא כי בהשוואה לפלסבו, נטילת כורכומין הייתה מלווה בירידה מובהקת ברמת ההומוציסטאין (בקבוצת ההתערבות: ירידה מ-12.22 ל-8.62 ובקבוצת הפלסבו עליה מ-9.45 ל-11.84, p=0.04) ובעלייה מובהקת ברמת ה-HDL (בקבוצת ההתערבות: עליה מ-40.77 ל-54.56 ובקבוצת הפלסבו ירידה מ-61.2 ל-48.82, p=0.04). לא נמצאו הבדלים מובהקים בין הקבוצות בהתייחס לרמות הגלוקוז, האינסולין, הלפטין, האדיפונקטין או במדדי העקה החמצונית וכן בהתייחס לתפקוד כלי הדם (p>0.05).
הערת מערכת: המחקר נערך בשיתוף חברת Akay Flavours & Aromatics Pvt. Ltd. המשווקת את התוסף.
במחקר פיילוט אקראי מבוקר פלסבו (2017) נבדקה ההשפעה של תוסף כורכומין (CurQfen®) על קשיון עורקים ומדדים דלקתיים, בקרב גברים צעירים עם שמנות (obesity). במחקר השתתפו 22 גברים (בני 18-35) עם BMI מעל 30, אשר הוקצו באופן אקראי לקבוצת הפלסבו או לקבוצת הכורכומין והחילבה למשך 12 שבועות. התוסף מכיל מיצוי כורכום (Curcuma longa) המתוקנן לפי מינימום 35% כורכומינואידים, בשילוב גלקטומנאנים מזרעי חילבה (Trigonella foenum-graecum), לשיפור הזמינות הביולוגית. נמצא כי נטילת התוסף (כמוסה אחת ליום, המכילה 500 מ"ג) הייתה יעילה להפחתת קשיון העורקים (אשר נמדדה באמצעות carotid-femoral Pulse Wave Velocity – cfPWV) רק בקרב משתתפים עם רמה בסיסית גבוהה יותר של קשיון עורקים (p=0.045). בנוסף, נמצא כי בקרב משתתפים אלה חלה עלייה מובהקת במתווך הדלקתי IL-13 (ציטוקין השייך לזרוע החיסון Th2 ותורם לעיכוב תהליכים דלקתיים בעורקים) בעקבות השימוש בתוסף בהשוואה למצב הבסיס (p=0.018). החוקרים מסכמים כי לתוסף זה פוטנציאל לשפר את בריאות העורקים בקרב גברים צעירים עם שמנות הסובלים מרמה גבוהה של קשיון עורקים(405).
מחקר מבוקר (2012)(406) בחן השפעות מתן מינון נמוך (80 מ"ג ליום) של כורכומין (Curcuma longa) בצורה שומנית או פלסבו על אנשים בריאים בגילאי 40-60 למשך 4 שבועות. נמצא כי כורכומין, אך לא פלסבו, הביא לשינויים מובהקים (p<0.05 בכל המדדים) סטטיסטית אלו: ירידה בערכי טריגליצרידים בדם, הפחתת רמות עמילאז ברוק, עליה בפעילות נוגדי חמצון ברוק, עליה בפעילות נוגדי חמצון בדם, הפחתת פעילות חמצונית בדם, שיפור מרקרים לטרשת עורקים (הפחתת ICAM מולקולות הצמדות לאנדותל והעלאת רמת הניטריק אוקסיד), וכן הפחתת ריכוז חלבון בטא עמילואיד בפלסמה המקושר להתפתחות אלצהיימר והפחתת רמת האנזים הכבדי ALT.
מחקר קליני קצר מועד ולא מבוקר (1992) בחן את השְפעת מתן כורכומין על מניעת טרשת עורקים(377). עשרה נבדקים בריאים נטלו כורכומין (סוג מיצוי לא ידוע) במינון 500 מ"ג ליום במשך שבוע. בתום ההתערבות נצפתה הפחתה של 33% בחמצון השומנים, הפחתה של 11.63% ברמת הכולסטרול הכללי בסרום ועליה של 29% ברמת ה-HDL.
מנגנוני פעולה
כורכומין מפחית תחלואה לבבית על ידי פעילות נוגדת חמצון, נוגדת דלקת ומעכבת אפופטוזיס. כורכומין מנטרל רדיקלים חופשיים, מגביר פעילות של נוגדי חמצון אנדוגניים (SOD, GSH, CAT, GSH-S-transferase, HO-1) המגינים על הלב מפני נזק איסכמי, מפחית רמות כולסטרול, LDL וטריגליצרידים בסרום ומפחית חמצון שומנים (מלונדיאלדהידים) המעורבים בהתפתחות טרשת עורקים(274,319,407). כמו כן, כורכומין משרה פעילות במסלולי קינאזים (PI3K/Akt, JAK/STAT3, MAPK) המעודדים שרידות של תאים קרדיומיוציטים, מעכב גורמי שעתוק (NFkB, AP-1, GATA4), מפחית ציטוקינים דלקתיים (IL-1β, IL-6, TNFɑ), חלבונים מווסתי אפופטוזיס תאי (העלאת יחס Bcl2/BAX) ואנזימים מפרקי מטריקס בין תאי (MMP2, MMP9).
כורכומין מפחית פגיעה בכלי הדם בחולי סוכרת על ידי פעילות נוגדת חמצון המסייעת לצמצם נזקים חמצוניים ותוצרי גליקציה מתקדמים (AGE). כורכומין מעכב ביטוי של גורם גידול וסקולרי אנדותלי (VEGF) וגורמי גידול נוספים (PDGF-platelet derived growth factor, FGF-fibroblast growth factor) ועל ידי כך מעכב שגשוג יתר של תאי אנדותל ואנגיוגנזה המושרים על ידי גלוקוז והומוציסטאין. כורכומין אף מעכב ביטוי של ציטוקינים (TNFɑ), אנזימים דלקתיים (COX2, iNOS, eNOS), גורמים כימוטקטיים (MCP-1) ומולקולות הצמדות (ICAM-1) ומפחית הסננה של לויקוציטים לתאי האנדותל(262,274,288,319,408).
כורכומין אף מפחית פגיעה בתפקוד שריר הלב, לייפת ואפופטוזיס בשריר הלב כתוצאה מעקה חמצונית הנובעת מתוצרי גליקציה מתקדמים (AGE) על ידי פעילות נוגדת חמצון (נטרול רדיקלים חופשיים הגברת ייצור גלוטטיון בתאים והגברת ביטוי של אנזימים נוגדי חמצון אנדוגניים דרך הגברת ביטוי גורם השעתוק Nrf2), ומונע עליה של מדדי דלקת (TNFɑ ו-IL-1β) על ידי עיכוב מסלול הקינאז Akt בתגובה לגירויי עקה שתאי הלב חשופים אליהם(409).
תפקוד קוגנטִיבי עצבי
הקדמה | מחקרים קליניים | מנגנוני פעולה
הקדמה
מספר מחקרים קליניים ומחקר אפידמיולוגי אחד תומכים ביעילות כורכום וכורכומין הניתנים לבדם או בשילוב עם רכיבים נוספים בשיפור התפקוד הקוגניטיבי ובהפחתת דחק בקרב נבדקים בריאים, בטיפול בדלקת נוירוגנית הקשורה במיגרנות כרוניות, וכן במניעת הדרדרות קוגניטיבית בגיל המבוגר ובשלבים הראשונים להתפתחות דמנציה ואלצהיימר. כמו כן, ברוב המחקרים מלבד אחד הודגמה יעילות מובהקת של הצמח בשיפור מדדי דיכאון וחרדה בהשוואה לפלסבו ובאופן המשתווה לתרופות, ללא תופעות הלוואי השליליות של הטיפול התרופתי. מחקרים פרה-קליניים רבים מלמדים כי הצמח יעיל במניעת התקדמות מחלות נוירודגנרטיביות שונות (אלצהיימר, פרקינסון, טרשת נפוצה ועוד) הודות להשפעותיו כנוגד חמצון (מעלה את רמת הגורם הנוירוטרופי המוחי ומעודד תהליכי תיקון והתחדשות של תאי העצב), נוגד דלקת ומווסת חיסון, סופח מתכות ומגן מפני רעילות חומרים שונים, משקם עצבי, מווסת רמות נוירוטרנסמיטרים (מעכב האנזים MAO המפרק נוירוטרנמיטרים מונואמינים – סרוטונין, נוראדרנלין ודופמין), מווסת ציר ההיפותלמוס-יתרת המח-אדרנל (HPA) ומפחית רמות קורטיזול.
מחקרים קליניים
כללי | דחק וחָרדה | דִיכּאון | מיגְרנות | דמנְציה ואלצְהיימר – מניעה | דמנְציה ואלצְהיימר – טיפול
כללי
סקירה (2017) מציגה עדויות ממחקרים קליניים ופרה-קליניים לגבי יעילות כורכום וכורכומין בטיפול במחלות נוירופסיכיאטריות ודנה בפוטנציאל של הצמח כאמצעי לטיפול בדיכאון מג'ורי, הפרעות חרדה, הפרעת פוסט טראומה (PTSD), הפרעה טורדנית כפייתית (OCD), הפרעה ביפולרית, הפרעות פסיכוזה וסכיזופרניה, ואוטיזם(410).
דחק וחָרדה
מחקר קליני כפול סמיות ומבוקר פלסבו (2015) בחן את השְפעת נטילה קצרת טווח וארוכת טווח של כורכומין (Longvida®) על התפקוד הקוגניטיבי, מצב הרוח ומדדי הדם (מדדי דלקת, פרופיל שומנים, תפקודי כבד וכליות) של מבוגרים בריאים. 60 מבוגרים בריאים בני 60-85 חולקו אקראית לנטילת כורכומין פוספוליפידי (כורכומין תקני משולב בפוספוליפידים במבנה חלקיקי פטנטי SLCP* - כל כמוסה מכילה 80 מ"ג כורכומין) במינון 400 מ"ג או פלסבו בנטילה חד פעמית או מתמשכת (למשך ארבעה שבועות). כעבור שעה מנטילת התוסף, כורכומין שיפר במובהק את ביצועי הנבדקים במטלות קשב מושהה וזכרון עבודה בהשוואה לפלסבו (p<0.05). השפעה זו על תפקודי הזכרון והקשב לא נצפתה 3 שעות לאחר נטילת התוסף. לאחר נטילה ממושכת של תוסף הכורכומין, זכרון העבודה (p=0.044) ומצב הרוח (עייפות כללית, עייפות פיסית, הפחתה ברגיעה, ירידה בשביעות הרצון, דחק, חרדה, וירידה בעירנות שהושרו על ידי דחק פסיכולוגי) השתפרו במובהק בהשוואה לפלסבו (p<0.05 בכל המדדים) ובנוסף לכך, מתן אקוטי של כורכומין לאחר נטילה כרונית שפרה משמעותית את מצב העירנות כעבור שעה מן הנטילה, p<0.005. כמו כן, כורכומין בנטילה ממושכת הפחית במובהק את רמות הכולסטרול הכללי ואת ה-LDL בדמם של הנבדקים (p<0.05 בשני המדדים). לא נצפתה השפעה על מדדי דלקת ועל תפקודי הכבד והכליות. הטיפול נסבל היטב, ללא תופעות לוואי(411).
Solid Lipid Curcumin Particle Technology *.
מחקר קליני (2016) השוואתי אקראי כפול סמיות ומבוקר פלסבו בחן את השְפעת תוסף כורכומנואידים (CurQfen) משולב בגלקטומנן, סיב תזונתי המופק מזרעי גרגרנית יוונית (Trigonella foenum-graecum) לשיפור הזמינות הביולוגית והחדירות של כורכומין דרך מחסום דם המוח, על חרדה ועייפות ממקור של דחק תעסוקתי (occupational stress). שישים (60) נבדקים (51 גברים ו-9 נשים, גיל ממוצע 33) החווים חרדה ועייפות בשל עבודת משמרות חולקו אקראית לנטילת תוסף הכורכומנואידים המשופר (המתוקנן להכיל 35% כורכומין לפחות) במינון 1000 מ"ג ליום, תמצית תקנית של כורכום (מתוקננת להכיל 95% כורכומין) או פלסבו למשך 30 ימים. במהלך ההתערבות נאסר על הנבדקים לצרוך כורכום, קפאין, תיאוברומין או תה. בתום ההתערבות נצפה שיפור מובהק באיכות החיים של הנבדקים (p<0.05) עם שיפור מובהק ברמות הדחק (p<0.001), החרדה (p<0.001) והעייפות (p<0.001) בעקבות נטילת התוסף המשופר בהשוואה לתמצית התקנית הסטנדרטית לפי מדד הדחק הנתפס בסולם ה- SF-36 ומדד החרדה של בק (Beck Anxiety Inventory). כמו כן, נצפה שיפור מובהק ברמות נוגדי החמצון האנדוגניים (CAT, SOD, GPx, GSH) בעקבות נטילת תוספי הכורכומין (p<0.001 לתוסף המשופר ו-p<0.05 לתוסף הסטנדטי) והפחתה מובהקת בחמצון השומנים (p<0.001 לתוסף המשופר ו-p<0.01 לתוסף הסטנדטי) בהשוואה למצב הבסיס. עוד נמצא כי הזמינות הביולוגית של התוסף המשופר לעומת התוסף הסטנדטי היתה גבוהה פי 30.7 בנטילה בודדת ופי 39.1 בנטילה חוזרת למשך חודש (p<0.001). נטילת התוסף נסבלה היטב, ללא תופעות לוואי משמעותיות(412).
דִיכאון
סקירה שיטתית (2015) בחנה את יעילות הטיפול בדיכאון קליני מג’ורי באמצעות כורכומין. שישה מחקרים קליניים (ארבעה מחקרים אקראיים מבוקרים, מחקר אחד פתוח ומחקר אחד במבנה מצולב) שכללו 342 נבדקים נכללו במטא אנליזה. כל הנבדקים קיבלו טיפול תרופתי אנטי דכאוני ובנוסף טופלו בכורכומין (בחמישה מחקרים המינון היה 1 גרם ליום ובמחקר אחד 500 מ"ג ליום) או פלסבו. נמצא כי כורכומין יעיל במובהק מפלסבו בהפחתת תסמיני דיכאון מג’ורי (p=0.002). ההשפעה המשמעותית ביותר של כורכומין נצפתה בקרב נבדקים בגיל העמידה (p=0.002), במשכי נטילה של למעלה משישה שבועות (p=0.001) ובמינון הנטילה הגבוה (p=0.002). החוקרים מסכמים כי ברוב המקרים העדויות המחקריות תומכות ביעילות כורכומין בטיפול בדיכאון, עם זאת, בשל הזמינות הביולוגית הנמוכה של כורכומין בנטילה פומית בבני אדם ובשל המספר המצומצם של המחקרים הקלינים לא ניתן לקבוע חד משמעית כי כורכומין הוא טיפול יעיל העומד בפני עצמו(413).
להלן פירוט המחקרים שנכלל בסקירה:
מחקר קליני השוואתי אקראי ומבוקר (2014) בחן את יעילות ובטיחות כורכומין לטיפול בדיכאון קליני. 60 נבדקים (טווח גילאים 30-44) שאובחנו כסובלים מדיכאון קליני מאג'ורי חולקו אקראית לקבלת תמצית תקנית של כורכומין (מתוקננת להכיל 88% כורכומנואידים) במינון 1 גרם ליום, התרופה Fluoxetine (המוכרת כפרוזק במינון 20 מ"ג ליום) או שילובם במשך שישה שבועות. 45 נבדקים סיימו את ההתערבות. בתום ההתערבות נמצא כי השיפור במדדי הדיכאון (על פי מדד המילטון HAM-D) היה דומה בכל הקבוצות (p=0.77). הטיפול בכורכומין לא הוביל לתופעות לוואי לא רצויות והיה יעיל ובטוח ללא הפרעות פסיכוטיות או הגברת סיכון להתאבדות(414).
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2014) בחן את יעילות כורכומין (BCM-95) בהפחתת תסמיני דיכאון בקרב הסובלים מדיכאון קליני. 56 משתתפים (טווח גילאים 18-64) הסובלים מדיכאון קליני מג’ורי ומטופלים בתרופות נוגדות דיכאון (סוג לא צוין) חולקו אקראית לקבלת תמצית תקנית של כורכומין (מתוקננת להכיל 86% כורכומנואידים ו-7% שמנים אתריים המופקים מצמח הכורכום) במינון 1 גרם ליום או פלסבו למשך 8 שבועות. החוקרים מציינים כי עד לשבוע הרביעי במחקר, בשתי הקבוצות נצפה שיפור דומה בתסמיני הדיכאון(415). אולם, החל מהשבוע הרביעי ועד לסיום המחקר, נמצא יתרון מובהק לטיפול בכורכומין על פני פלסבו בשיפור התסמינים על פי המדדים IDS-SR30 – Inventory of Depressive Symptomatology self-rated versionי(p=0.045 ו-p=0.14 במדד הדיכאון הכללי ובמדד מצב הרוח בהתאמה). ההבדלים במדד החרדה STAI -Spielberger State-Trait Anxiety Inventory לא היו מובהקים p=0.097) בעיקר בקרב הסובלים מדיכאון לא טיפוסי (אטיפי), אשר לרוב קשה יותר לטיפול.
במחקר המשך למחקר הקודם (2015) נדגמו ונותחו סמנים ביולוגיים הקשורים בדיכאון מדגימות הרוק, הדם והשתן של הנבדקים במקביל לטיפול באמצעות כורכומין. דגימות של 50 נבדקים נכללו במחקר. בהשוואה לפלסבו, שמונה שבועות של טיפול באמצעות כורכומין נקשר לעליה (p<0.05) ברמות הטרומבוקסן B2 ו-(substance P (p<0.001 בשתן, ואילו טיפול באמצעות פלסבו נקשר בהפחתה ברמות האלדוסטרון והקורטיזול בשתן (p<0.05 בשניהם). כמו כן, נמצא מתאם בין רמות בסיס גבוהות יותר של אנדותלין 1 (p<0.01) ולפטין (p<0.05) בפלסמה ובין שיפור משמעותי יותר בתסמינים לפי מדד ה-IDS-SR30 לאחר שמונה שבועות של טיפול באמצעות כורכומין(416).
מחקר קליני(417) אקראי כפול סמיות ומבוקר פלסבו (2015) במבנה מצולב בחן את השְפעת תוסף כורכומנואידים (C3 Complex) על ביטויי חרדה ודיכאון בקרב נבדקים הסובלים משמנות (obesity).י35 נבדקים (83% נשים, גיל ממוצע 38.37) עם מדד מסת גוף BMI>30 המטופלים בתרופות (סוג לא צוין) חולקו אקראית לקבלת תמצית תקנית של כורכומנואידים (מתוקננת להכיל 95% כורכומנואידים לפחות) במינון 1 גרם ליום משולבת עם מיצוי פיפרין (bioperine) במינון 10 מ"ג ליום או פלסבו משולב עם מיצוי פיפרין (bioperine) במינון 10 מ"ג ליום במשך חודש. לאחר שבועיים הפסקה, הוצלבו הטיפולים למשך חודש נוסף, כך שכל הנבדקים התנסו בטיפול הנגדי. בתום ההתערבות נמצא כי לתוסף הכורכומנואידים יתרון מובהק על פני פלסבו בהשפעה על מדד החרדה (Beck Anxiety Inventory, p=0.03), אך לא בהשפעה על מדד הדיכאון (Beck Depression inventory,p=0.7).
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2013) בחן את יעילות הטיפול בדיכאון באמצעות תוסף המכיל כורכומין בשילוב עם הטיפול התרופתי (escitalopram או venlafaxine). ארבעים (40) נבדקים (טווח גילאים 20-60) שאובחנו כסובלים מדיכאון קליני מג’ורי וטופלו בתרופות נוגדות דיכאון חולקו אקראית לקבלת פלסבו או תוסף המכיל מיצוי כורכומין (בריכוז 97%) במינון 330 מ"ג ליום, מיצוי של חומצה אלג'ית מקליפות רימונים (בריכוז 70%) במינון 120 מ"ג ליום ופיפרין במינון 50 מ"ג ליום במשך חמישה שבועות. בתום ההתערבות לא נרשם יתרון לתוסף על פני הפלסבו בהפחתת תסמיני הדיכאון לפי המדדים MADRSי(Montgomery-Asberg Depression Rating Scale) ו-HAMDי(Hamilton Depression Rating Scale). אולם, הטיפול באמצעות כורכומין הדגים מגמת שיפור מהירה יותר בהשוואה לפלסבו(122).
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2015) בחן את יעילות תוסף כורכומין בהפחתת תסמיני דיכאון ואת מנגנוני פעולתו. 108 נבדקים גברים (טווח גילאים 31-59) שאובחנו כסובלים מדיכאון ונוטלים תרופות נוגדות דיכאון (סוג לא צוין), חולקו אקראית לנטילת כורכומין במינון 1000 מ"ג ליום או פלסבו במשך שישה שבועות. בתום ההתערבות, נמצא שתוסף כורכומין הפחית במובהק את תסמיני הדיכאון לפי סולם המילטון (HDRS-17) וסולם מונטגומרי-אסברג (MADRS). בנוסף, כורכומין הפחית את רמות הציטוקינים הפרו דלקתיים אינטרלוקין 1β ו-TNFΑ בפלסמה, העלה את רמת גורם הגדילה המוחי BDNFי(Brain derived neurotrophic factor) והפחית את רמות הקורטיזול בדגימת הרוק של הנבדקים בהשוואה לפלסבו(418).
מחקר קליני פתוח (2015) בחן את השְפעת תוסף כורכומנואידים ופיפרין בשילוב עם טיפול תרופתי על תסמיני דיכאון וחרדה בקרב חולי דיכאון מג’ורי. 111 נבדקים הסובלים מדיכאון קליני מג’ורי חולקו אקראית לקבלת טיפול תרופתי (סוג לא צוין) בשילוב תוסף כורכומנואידים במינון 1000 מ"ג ליום ופיפרין במינון 10 מ"ג ליום (סוג מיצוי לא ידוע) או טיפול תרופתי לבדו במשך 6 שבועות. בתום ההתערבות, חל שיפור מובהק בדירוג החרדה והדיכאון (p<0.001) בייחוד בתסמינים הסומטיים והקוגניטיביים (p<0.001) בעקבות נטילת הטיפול המשולב בהשוואה לטיפול התרופתי לבדו(419).
כמו כן, מחקר נוסף מהשנה האחרונה שלא נכלל בסקירה:
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2017) בחן את יעילות הטיפול בדיכאון קליני מג’ורי באמצעות שילוב תוסף כורכומין (BCM-95) וזעפרן. תוסף הכורכומין הכיל תמצית תקנית מתוקננת להכיל 88% כורכומנואידים ו-7% שמנים אתריים המופקים מצמח הכורכום. 123 נבדקים (טווח גילאים 18-65) אובחנו כסובלים מדיכאון מג’ורי לפי קריטריונים של ה-DSM-IV ועם ציון של 18 מעלה במדד IDS-SR30י(Inventory of Depressive Symptomatology self-rated version). הנבדקים חולקו אקראית לאחת מארבע זרועות: פלסבו, מיצוי כורכומין במינון נמוך (500 מ"ג), מיצוי כורכומין במינון גבוה (1000 מ"ג), או מיצוי כורכומין במינון נמוך בשילוב תמצית תקנית של זעפרן (מתוקננת להכיל מעל 3.5% Lepticrosalides) במינון 30 מ"ג ליום במשך 12 שבועות. בתום ההתערבות נמצא שהטיפול המשולב היה יעיל יותר במובהק בשיפור תסמיני הדיכאון לפי מדד IDS-SR30י(p=0.031) ובמדדי החרדה המצבית STAI-stateי(p<0.001) והתכונתית STAI-traitי(p=0.001) בהשוואה לפלסבו. השְפעת הטיפול המשולב היתה מובהקת יותר בקרב הסובלים מדיכאון לא טיפוסי (אטיפי) בהשוואה לשאר המטופלים (שיעורי היענות של 65% בהשוואה ל-35%, p=0.012). למינוני הכורכומין השונים לא היתה השפעה מובהקת על התוצאות(420).
מִיגרנות
מחקר קליני(144) אקראי כפול סמיות ומבוקר פלסבו בחן את השְפעת הנטילה המשולבת של אומגה 3 ונאנו-כורכומין על דלקת נוירוגנית* במיגרנה. 80 נבדקים (80% מהם נשים, טווח גילאים 20-50) הסובלים ממיגרנות בתדירות של שלושה התקפים ומעלה בחודש והנוטלים תרופות (נוגדי דיכאון amitriptyline או nortriptyline וחוסם בטא propranolol) חולקו לנטילת פלסבו, נאנו-כורכומין (במינון 80 מ"ג ליום), אומגה 3 (שמן דגים במינון 2500 מ"ג ליום, 1200 מ"ג EPA ו-600 מ"ג DHA), או שילוב של כורכומין ואומגה 3 במשך חודשיים. נמצא ששילוב נאנו-כורכומין ואומגה 3, אך לא כל אחד מהתוספים לבדם, היה יעיל במובהק בהפחתת תדירות ההתקפים בהשוואה למצב הבסיס ובהשוואה לפלסבו (p<0.001 בשניהם). פעילות כורכומין בשילוב אומגה 3 יוחסה להפחתה מובהקת של הביטוי הגנטי והרמות בסרום של הציטוקין TNFɑי(p<0.001 בשניהם).
* דלקת הנגרמת כתוצאה מהפגיעה ברקמות.
דמנְציה ואלצְהיימר - מניעה
סקירה (2016) מציגה את העדויות הפרה קליניות והקליניות ליעילות הטיפול במחלות נוירודגנרטיביות באמצעות הפוליפנוֹלים כורכומין ורזברטרול. ישנם מחקרים אפידמיולוגיים המעידים על כך כי צריכה של כורכום במזון קשורה להשפעות מגינות על מערכת העצבים. כמו כן, שתייה של יין אדום קשורה לסיכון נמוך יותר להתפתחות דמנציה. עם זאת, בחינה של המחקרים הקליניים בנוגע לשימוש בכורכומין וברזרבטרול לצורך מניעה וטיפול בהפרעות קוגניטיביות, לרבות מחקרים קליניים שעדיין לא פורסמו, מעלה תוצאות מאכזבות שאינן מאפשרות הסקת מסקנות לגבי היעילות הטיפולית של כורכומין ורזברטרול. נחוצים מחקרים שיעריכו את השְפעת הרכיבים הפעילים הללו בשלבים מוקדמים להתפתחות דמנציה, תוך בחינה של סמני מחלה ראשוניים, כדי שניתן יהיה לבחון אם בכוחם למנוע או להאט את התפתחות המחלה(421).
סקירה (2015) המציגה את העדויות לגבי ההשפעה המתווכת של רכיבים צמחיים שונים במסלולים המעורבים בהגנה עצבית. החוקרים מציינים כי כיום אין טיפול יעיל למחלת האלצהיימר אולם נמצא כי השימוש בצמחי מרפא ורכיבים צמחיים מסוימים עשוי להאט את התפתחות המחלה. בסקירה הנוכחית מוצגים ממצאים לגבי התפקיד של רכיבים צמחיים, כולל נגזרות פנוליות, גליקוזידים אירידואידיים, טרפנואידים, אלקלואידים וספונינים סטרואידליים בוויסות הפעילות של נוירוטרופינים בהגברת ההגנה העצבית. בין הרכיבים הצמחיים הנסקרים מוזכר כורכומין המשרה גדילה והתמיינות בשלוחות של תאי עצב (נויריטים) על ידי העלאת רמות של נוירוטרופינים וכן מונע אפופטוזיס של תאי עצב כתוצאה מחשיפה לרעלנים שונים, ביניהם משקעי בטא עמילואיד, בזכות פעילות נוגדת חמצון ונוגדת דלקת(422).
סקירה (2014) מציגה עדויות לגבי מספר היבטים תזונתיים אשר עשויים להיות בעלי השפעה בטיפול ובמניעת אלצהיימר. בסקירה מוצגים ממצאים המתייחסים לצריכת נוגדי חמצון, חומצות שומן מסוג אומגה 3, ויטמיני B בדגש על חומצה פולית (B9), טריגליצרידים בעלי שרשרת בינונית (MCT; בדגש על מוצר מדף בשם Axona ושמן קוקוס) ומוצר מדף של מזון רפואי בשם Souvenaid. כמו כן, מוצגים ממצאים ממחקרים קליניים העוסקים בהשפעות של תוספי תזונה נוספים וצמחי מרפא שונים כגון Huperzine A, גינקו בילובה (Ginkgo biloba), רזרבטרול וכורכומין. במחקרי בעלי חיים שונים נמצא כי כורכומין עשוי להיות יעיל לטיפול באלצהיימר בזכות פעילות נוגדת חמצון ומנטרלת רדיקלים חופשיים, פעילות נוגדת דלקת (דרך עיכוב מסלולים של גורמי השעתוק NFkB, stat3 וβ-catenin), הפחתת משקעי עמילואיד בטא והפחתת הנזק לסיבי תאי העצב. עם זאת, מחקרים קליניים שבוצעו עד כה לא הדגימו יעילות חד משמעית בהפחתת סמנים להתקדמות המחלה. החוקרים מסכמים כי כיום אין עדויות חד משמעיות ממחקרים קליניים המציגות שיפור במהלך מחלת האלצהיימר כתוצאה מטיפול תזונתי, אולם המחקרים מציעים כי רכיבים תזונתיים שונים עשויים להיות יעילים, הן כטיפול בודד או כטיפול משלים(423).
מחקר כפול-סמיות מבוקר פלסבו (2018) בחן את ההשפעה של תוסף כורכומין (Theracurmin) על הצטברות משקעים של חלבוני טאו ועמילואידים, המהווים סמן למחלת האלצהיימר. במחקר נכללו 40 משתתפים בגילאי 51-84 ללא דמנציה, אשר חולקו אקראית לקבלת תוסף כורכומין (חלקיקים בגודל נאנו מפוזרים בצורה אחידה על חלקיקי גומי מומסים במים וגליצרין, מכיל 10% כורכומין, 2% כורכומנואידים) במינון 180 מ"ג ליום או פלסבו במשך 18 חודשים. נמצא כי בהשוואה לקבוצת הפלסבו שבה לא חלו הבדלים מובהקים בהשוואה למצב הבסיס (הבדל לא מובהק בין הקבוצות למעט במדד הקשב p=0.04 ומגמה לא מובהקת של הבדל בין הקבוצות במשימות הזיכרון המילולי p=0.05), בקרב משתתפים בקבוצת הכורכומין חל שיפור מובהק במבדקי הזיכרון והקשב בהשוואה לנתוני הבסיס (זיכרון מילולי - אחזור מידע מזיכרון לטווח ארוך p=0.002, היזכרות סלקטיבית כללית p=0.002, זיכרון חזותי-היזכרות p=0.01, זיכרון חזותי-היזכרות מושהית p=0.006, קשב p<0.0001). באמצעות הדמיית PET החוקרים מראים כי נטילת כורכומין הייתה מלווה בירידה בהצטברות המשקעים החלבוניים באמיגדלה (p=0.04 בהשוואה למצב הבסיס, ללא הבדל מובהק בהשוואה לפלסבו) ובהיפותלמוס (ללא הבדל מובהק בהשוואה למצב הבסיס, אך מובהק בהשוואה לפלסבו p=0.02). החוקרים מסכמים כי נטילת תוסף כורכומין עשויה לתרום לשיפור מדדי זיכרון וקשב בקרב מבוגרים ללא הפרעה בתפקוד הקוגניטיבי, כאשר השפעה מיטיבה זו עשויה להיות כתוצאה מירידה בהצטברות משקעים חלבוניים באזורים במוח האחראים על תפקודים אלה(424).
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2016) בחן את יעילות תוסף כורכומין (BCM-95) במניעת ירידה קוגניטיבית בקרב מבוגרים בריאים. 96 נבדקים (בני 40-90, גיל ממוצע 66) חולקו אקראית לנטילת פלסבו או תמצית תקנית (מתוקננת להכיל 88% כורכומנואידים ו-7% שמנים אתריים המופקים מצמח הכורכום) במינון 1500 מ"ג ליום במשך 12 חודשים. בתום שישה חודשים נצפתה ירידה קוגניטיבית בקבוצת הפלסבו בהשוואה לנתוני הבסיס (לפי מבחן Montreal Cognitive Assessment) שלא נצפתה בקבוצת הכורכומין (p<0.05). עם זאת, בתום ההתערבות לא נצפו הבדלים מובהקים בין הקבוצות במדדי התפקוד הקוגניטיבי, במצב הרוח ובאיכות החיים הכללית(425).
מחקר קליני כפול-סמיות מצומצם (2014) בדק האם לכורכום וקינמון השפעה על התפקוד הקוגניטיבי בקרב משתתפים במצב טרום סוכרת שאינם מטופלים תרופתית. 48 משתתפים בגילאי 60 ומעלה שאובחנו זה לא מכבר בטרום סוכרת ( BMI=18.5-30, גלוקוז בצום 100-125) חולקו באופן אקראי לאחר צום לילה לקבלת פלסבו, 1 גרם כורכום, 2 גרם קינמון או כורכום + קינמון בשילוב עם לחם לבן בארוחת הבוקר. התפקוד הקוגניטיבי של הנבדקים נבדק לפני הנטילה ושש שעות אחריה. בעקבות נטילת התוספים לא נצפו שינויים מובהקים ברמות הגלוקוז והאינסולין בדמם של הנבדקים לאחר הארוחה. החוקרים מצאו כי תוספת הכורכום הובילה לשיפור זיכרון העבודה (p=0.05), וכן לשיפור העמידות לאינסולין (p<0.01) אך לא לשינוי במרקרים של מחלת האלצהיימר (APP, PS1, PS2, GSK-3β). לא נצפתה תרומה מובהקת של קינמון לשינוי המדדים(363).
מחקר אפידמיולוגי (2006) שנערך בסינגפור בחן את הקשר בין אכילת קארי ובין רמת התפקוד הקוגניטיבי בגיל המבוגר. מאכל הקארי הנפוץ בסינגפור מכיל קארי צהוב העשיר בכורכום. 1010 נבדקים בני 60-93 שאינם סובלים מדמנציה נכללו במחקר. הנבדקים שאכלו קארי מדי פעם, ולעתים תכופות או לעתים תכופות מאוד קיבלו ציונים גבוהים יותר במובהק במבחן המיני מנטל בהשוואה לנבדקים שלא אכלו קארי או שאכלו קארי לעתים רחוקות(426).
דמנְציה ואלצְהיימר – טיפול
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2008) בחן את השְפעת הנטילה של כורכומין על התפקוד הקוגניטיבי במחלת האלצהיימר. 34 נבדקים בני חמישים ומעלה שאובחנו באלצהיימר או שחוו ירידה פרוגרסיבית בתפקוד הקוגנטיבי או בזיכרון במשך שישה חודשים ומעלה חולקו אקראית לנטילת כורכומין בכמוסות או באבקה לנטילה עם המזון (סוג מיצוי לא צוין) במינון 4 גרם ליום, 1 גרם ליום או פלסבו למשך שישה חודשים. הנבדקים המשיכו ליטול את הטיפול התרופתי שלהם לאורך תקופת ההתערבות ובנוסף נטלו כמוסה אחת ליום של תמצית עלי גינקו בילובה (מתוקננת להכיל 24% גִינקולידים ו-6% בילבולידים) במינון 120 מ"ג ליום. 27 נבדקים השלימו את ההתערבות ונמצא שספיגת הכורכומין היתה טובה יותר בצורת כמוסות מאשר באבקה. בתום ההתערבות לא נצפו הבדלים מובהקים בין הקבוצות בתוצאות מבחן המיני מנטל להערכת התפקוד הקוגניטיבי. עם זאת לא נצפתה ירידה קוגניטיבית בקבוצת הפלסבו במהלך התקופה והחוקרים טוענים שיתכן שבשל כך ובשל גודל המדגם המצומצם לא הודגם יתרון לטיפול בכורכומין. כמו כן, לא נצפה יתרון לטיפול באמצעות כורכומין על פני פלסבו בהפחתת העקה החמצונית (לפי רמות המטבוליטים איזופרוסטנים הנוצרים בעת חמצון חומצות שומן חיוניות) ובהורדת רמת הבטא עמילואיד בסרום(427).
מנגנוני פעולה
כללי | דיכּאון | אלצְהיימר | פרקִינסון | טרשת נפוֹצה
כללי
כורכומנואידים מסייעים לעיכוב התקדמות מחלות נוירודגנרטיביות כגון אלצהיימר, פרקינסון, ALS, הנטינגטון, תסמונת דאון, טרשת נפוצה וגלאוקומה דרך ויסות עקה חמצונית הנובעת מתפקוד לקוי של המיטוכונדריה(428).
ככל שמתקדמים בגיל, המוח צובר משקעים של יוני מתכות כגון ברזל, אבץ ונחושת מייצרי רדיקלים חופשיים (ROS). משקעי מתכות וייצור רדיקלים חופשיים תורמים להתפתחות המחלות הנוירודגנרטיביות השונות. כורכומין פועל כסופח (קלטור) של יוני מתכות ומסייע בפינויים ממערכת העצבים המרכזית(274). בנוסף, כורכומין מגן מפני חומרים שונים הגורמים רעילות למערכת העצבים: ד-גלקטוזמין, פלואוריד, פורמלדהיד, Rotenone ו-MPTP (גורמים לתסמינים דמויי פרקינסון במודלים של בעלי חיים), Vincristine (תרופה כימותרפית), טטרה-כלורו-בנזוקינון, פנתילן-טטרזול (PTZ), אקרילמיד, ארסן ועוד(429). כורכומין פועל כנוגד חמצון באופן ישיר על ידי נטרול רדיקליים חופשיים ובאופן עקיף על ידי הגברת ביטוי של אנזימים נוגדי חמצון אנדוגניים כגון SOD, קטלאז, גלוטטיון פרוקסידאז וגלוטטיון רדוקטאז, הודות להפעלת מסלול האיתות של חלבון Nrf2 והגברת ביטוי גנים של חלבונים המשתייכים למערך ההגנה מפני עקה חמצונית(238) בתאים (Heme oxygenase 1, Heat shock proteins).
כורכומין פועל כנוגד דלקת(410) על ידי עיכוב מסלול השעתוק של NFkB, הפחתת ביטוי של אנזימים דלקתיים (COX2, iNOS), עיכוב הפעלה של תאי מיקרוגליה, עיכוב ייצור ציטוקינים דלקתיים (TNFɑ, IL-1ɑ ,IL-6) ועיכוב אפופטוזיס תאי על ידי עיכוב הפעלה של אנזימים מפרקי תאים (caspase 3).
השפעותיו של כורכומין כנוגד חמצון וכנוגד דלקת מונעות אפופטוזיס של תאי עצב ושינויים ניווניים במבנה המוח האופייניים למחלות נוירודגנרטיביות. כורכומין מונע הפחתה בנוירוטרנסמיטרים ומשפר את התקשורת העצבית(430) על ידי השריית גדילה של שלוחות תאי עצב ויצירת סינפסות חדשות, ומעודד תהליכי תיקון בתאי עצב על ידי העלאת ביטוי של גורם גידול נוירוטרופי מוחי BDNF. בנוסף כורכומין מפעיל את מסלול השעתוק של ERK המעודד שרידות ושגשוג תאי עצב, מייעל את פעילות המיטוכונדריה, ומעלה זמינות של DHA (docosahexaenoic acid) במערכת העצבים המרכזית (410).
השפעות נוספות של כורכומנואידים מתבטאות בקישור ישיר לבטא עמילואיד באלצהיימר, ומניעת הצטברותו והשפעותיו הרעילות, מניעת הצטברות חלבון α-synuclein הפוגע בתאים המייצרים דופמין בפרקינסון, הפחתת ביטוי האנזים Cox2 המושרה על ידי ROS ב-ALS, והפחתת תסמיני טרשת נפוצה ואנצפלופתיה סוכּרתִית, כמו גם פגיעות מוחיות בעקבות טראומה ונזק עצבי בעקבות הרעלת מתכות כבדות(428).
כורכומין משפיע על זמינות נוירוטרנסמיטרים במוח (מעלה סרוטונין, דופמין, נוראדרנלין ואצטיל כולין, ומפחית גלוטמט) על ידי עיכוב פעילות האנזים מונואמין אוקסידאז (בייחוד MAO-A) המפרק נוירוטרנמיטרים מונואמינים, העלאת ביטוי קולטנים לסרוטונין (5-HT1A/1B, 5HT2C, 5HT4), עיכוב פעילות האנזים אצטילכולין אסטראז המפרק אצטיל כולין, ועיכוב שחרור גלוטמט(410).
כורכומין מווסת את הפעילות ההורמונלית בציר ההיפותלמוס-יותרת המוח-אדרנל (HPA) המובילה להסדרת ההפרשה של קורטיקוסטרואידים, דרך ויסות רמות קורטיקוסטרון בסרום (המפעיל משוב על ציר HPA), עיכוב ביטוי של CRFי(corticotropin releasing factor) אשר רמות גבוהות שלו משבשות את הפעילות בציר HPA וגורמת להפעלת יתר שלו, שיפור רגישות הקולטנים לגלוקוקורטיקואידים (בהפעלת יתר של ציר HPA מתפתחת עמידות של הקולטנים לגלוקוקורטיקואידים) והגנה חמצונית על בלוטת האדרנל(410).
דיכּאון
כורכומין מעלה רמות של סרוטונין, נוראדרנלין ודופמין בקורטקס ובהיפוקמפוס על ידי עיכוב האנזים MAO,י(A ו-B) המפרק את הנוירוטרנסמיטרים המונואמיניים (סרוטונין, דופמין ונוראדרנלין) בגבול המיטוכונדריה של תאי העצב.
כמו כן, כורכומין מעלה רגישות קולטנים(431-433) לסרוטונין (5-HT1A/1B, 5-HT2C).
כורכומין מעכב השפעות של עקה על צירHPA , המתבטאות בהפרשה מוגברת של קורטיזול ובקלקול המשוב השלילי של קורטיזול על הפרשת CRH מההיפותלמוס. מתן כורכומין מפחית עמידות לקורטיזול ומעלה רגישות קולטנים לקורטיזול. כמו כן, כורכומין מפחית הפרשה של גלוטמט, הגורם לפגיעה בתאי העצב ומפחית את הפלסטיות העצבית (היכולת ליצור קשרים סינפטיים חדשים) בקורטקס הקדם מצחי ובהיפוקמפוס בתגובה לקורטיזול, ומעלה את רמות הגורם הנוירוטרופי המוחי (BDNF) האחראי לחידוש ותיקון תאי העצב, שרמתו יורדת בעקבות חשיפה לרמות מוגבהות של קורטיזול, על ידי עיכוב מסלול חישת העקה MAPK/ERK. לבסוף, כורכומין מבטל את הירידה בביטוי הגנטי של הקולטנים לסרוטונין בעקבות חשיפה לקורטיזול(431-433).
כורכומין מפחית את הביטוי הגנטי של האנזים IDO בתאי חיסון שונים (מקרופג'ים, תאים דנדריטים, אסטרוציטים ותאי מיקרוגליה). אנזים זה אחראי על המרת חומצת האמינו טריפטופן לקינורינין המעורב בתהליך הדלקתי. כתוצאה מפעילות מוגברת של האנזים חלה ירידה בהמרה של טריפטופן לנוירוטרנסמיטר סרוטונין. כמו כן, קינורינין הופך לגורם הנוירוטוקסי quinolinic acid, המעודד הפרשה מוגברת של גלוטמט והפעלה של קולטני NMDA (מסלול עירור יתר), פוגע בפלסטיות (גמישות) תאי העצב דרך עיכוב גורם נוירוטרופי מוחי (BDNF), משרה עקה חמצונית (ROS) וגורם להריסת תאי העצב במערכת הלימבית(323,432-434).
כורכומין מעכב את מסלולי העקה Akt, NF-κB, PI3K המובילים לשעתוק גנים פרו-דלקתיים, מעכב גורמי שעתוק NFkB ו-activator protein-1, מפחית תגובות יתר חיסוניות של זרועות החיסון Th1 ו-Th17 ומגביר את זרוע החיסון Th2 המאזנת אותם, מפחית רמות של ציטוקינים דלקתיים IL-1β, IL-6 TNF-α בסרום ומעלה את רמת הציטוקין IL-10 (אך לא IL-4), מעכב את האנזים פוספוליפאז A2 המשחרר חומצה ארכידונית (המשמשת חומר מוצא לאיקוסנואידים: פרוסטגלנדינים, לויקוטריאנים ותרומבוקסנים) ממברנות התאים, מפחית את הביטוי הגנטי של האנזים COX2 ואת ייצור PGE2, מעכב את האנזים iNOS ויצור של ניטריק אוקסיד מושרה על ידי ציטוקינים(431-436).
כורכומין גורם לתיקון ליקויים מיטוכונדריאליים בתאי עצב וייצור מופחת של ATP, ומונע יצור מוגבר של ROS על ידי פעילות נוגדת חמצון (הגברה של Nrf2, הפעלה של haem oxygenase-1), והעלאת רמות אנזימים נוגדי חמצון SOD, גלוטטיון פרוקסידאז(431-433).
כורכומין מגביר התחדשות ותיקון תאי עצב, ומגביר פלסטיות נוירונלית(431-433) על ידי העלאת רמות גורם נוירוטרופי מוחי (BDNF).
אלצְהיימר
אלצהיימר היא מחלה נוירודגנרטיבית המאופיינת בהצטברות חלבון עמילואיד בטא היוצר משקעים (פלאקים) חוץ תאיים במוח ובפירוק מוגבר של חלבוני טאו (חלבונים מבניים) בתוך התא ליצירת סבך סיביי עצב (neurofibrillary tangles). ההשערה המקובלת היא שהמחלה נובעת ממוטציה גנטית הגורמת לעליה בהצטברות חלבון APPי(Amyloid precursor protein) המשמש קודמן לבטא עמילואיד, ועליה בביטוי הגנטי של האנזים המפרק אותו והופך אותו לבטא עמילואיד או מליקוי במנגנון הפינוי של APP מהמוח. למשקעי בטא עמילואיד מגבירים עקה חמצונית (עליה של ROS), בייחוד בנוכחות יוני מתכות (נחושת, מנגן וברזל), הגורמת להתפוררות סיבי העצבים ולהצטברות חלבון הטאו, ומעוררים תגובה דלקתית המעודדת מוות של תאי עצב(274).
כורכומנואידים ובייחוד כורכומין מסייעים לטיפול באלצהיימר דרך מספר מנגנונים(274,288,437-438):
כורכומין וכורכומנואידים מפחיתים רמות של עמילואיד בטא מבלי להשפיע על רמות החלבון APP המשמש קודמן ליצירתו. משערים כי מנגנון פעולתם הוא השפעה על הבשלת APP או הפחתת הביטוי הגנטי של פקטורי האנזים ɣ-secretase החותך APP באופן שגורם ליצירת המשקעים. לכורכומין זיקה גבוהה לחלבון עמילואיד בטא. הוא נקשר לחלבון ומונע את יצירת הפלאק על ידי הפרעה למבנה האוליגומרים והפיברילות שבאמצעותם סיבי החלבון נקשרים. כמו כן, כורכומין מפחית הצטברות משקעי עמילואיד במוח על ידי עידוד פגוציטוזה של מקרופג'ים ומייעל את פינוי עמילואיד בטא מהמוח על ידי הגברת מסיסותו.
בנוסף, כורכומנואידים (כורכומין וכן DMC ו-BDMC) מגינים על תאי המוח מפני נזקי עמילואיד בטא בזכות פעילות נוגדת חמצון (כורכומין מונע חמצון שומנים במוח ומעלה רמות אנזימים נוגדי חמצון אנדוגניים כגון SOD, GST, GPX). בנוסף, כורכומין פועל כסופח (קלטור) ליוני מתכות נחושת, אלומיניום וברזל.
פעילויות נוספות של כורכומין כוללות:
הפחתת פירוק של חלבוני טאו בתאים על ידי עיכוב מסלול חישת העקה /JNK MAPK (c-jun N-terminal kinase) המעודד פעילות יתר של גלוטמט ומגביר את השְפעתו הרעילה על תאי העצב.
עיכוב מסלול גורם השעתוק הדלקתי NFkB והגברת מסלול השעתוק האנטי דלקתי של PPARɣ וכתוצאה מכך הפחתת רמות ציטוקינים דלקתיים כגון IL-1β, IL-6, TNFɑ ופעילות אנזימים דלקתיים COX2 ו-iNOS ודיכוי הפעלה של תאי מיקרוגליה.
עידוד צמיחה של נויריטים ושיקום פגיעות בתאי עצב לאחר פינוי משקעי עמילואיד בטא על ידי העלאת ביטוי של גורם נוירוטרופי מוחי BDNF בהיפוקמפוס ובקורטקס המצחי.
שיפור תפקודי זכרון על ידי עיכוב פעילות האנזים אצטיל כולין אסטרז האחראי לפירוק אצטיל כולין ועל ידי כך הגברת זמינות אצטיל כולין בסינפסות.
פרקִינסון
במספר מודלים של פרקינסון שהושרה בבעלי חיים הדגים כורכום הגנה על תאי העצב בחומר השחור (substantia nigra) אשר בגרעיני הבסיס על ידי פעילות נוגדת חמצון, הפחתת ROS והעלאת רמות גלוטטיון ו-SOD, ספיחה (קלציה) של יוני ברזל, שיפור תפקוד המיטוכונדריה, ומניעת אפופטוזיס (על ידי עיכוב מסלול גורם השעתוק JNK ושיפור יחס חלבונים מונעי/משרי אפופטוזיס Bax/Bcl2). בנוסף, כורכומין מנע הפעלה של תאים אסטרוציטיים והדגים פעילות נוגדת דלקת על ידי הפחתת רמות NF-kβ, IL-1b ו-TNFɑ, וכן מנע הפחתה ברמת הדופמין בסטריאטום(439-441) על ידי עיכוב האנזים מונואמין אוקסידאז Bי(MAO-B).
טרשת נפוֹצה
כורכומין מדגים הגנה על מערכת העצבים ובעל פוטנציאל טיפולי בטרשת נפוצה בזכות פעילות נוגדת חמצון, נוגדת דלקת ומווסתת חיסון(442). כורכומין מפחית אפופטוזיס בתאי אוליגודנדרוציטים בעקבות עליה בעקה החמצונית (ROS) במיטוכונדריה. כורכומין מפחית הפעלה של תאי דלקת (תאים דנדריטים, תאים מקרופג'ים, תאי מיקרוגליה), ציטוקינים (,IL-1β, IL-6, TNFɑ) כימוקינים (MCP-1), אנזימים פרו דלקתיים (COX2, iNOS) מתווכי דלקת (PGE2, ניטריק אוקסיד), וגורמי גידול ושגשוג תאים חיסוניים (TGF-β) ומפחית הפעלה של תאי T דרך עיכוב הפעלה של קולטני שער (Toll like receptors) על ממברנות תאי החיסון במערכת החיסון המולדת ועיכוב המסלולים של גורמי השעתוק MAPK, JAK-STAT NFkB. כורכומין מפחית חדירות של תאי דלקת למערכת העצבים המרכזית דרך עיכוב הפעלת אסטרוציטים (על ידי הציטוקינים IL-6 ו-TNFɑ) והפחתת ביטוי של מטלופרוטאינים מפרקים (MMP-9) הגורמים להגברת חדירות מחסום דם המוח. כורכומין מפחית ביטוי של ציטוקינים מזרועות החיסון Th17 ו-Th1 (IL-17, IL-23, INFɣ, IL-12) ומגביר ביטוי של ציטוקינים נוגדי דלקת IL-10 על ידי תאי T רגולטורים דרך עיכוב מסלול גורם השעתוק הפרו דלקתי STAT3 והגברת ביטוי מסלול השעתוק האנטי דלקתי PPARɣ.
כאבי שרירים וגידים
הקדמה | מחקרים קליניים | מנגנוני פעולה
הקדמה
מספר קטן של מחקרים קליניים ופרה-קלינים מדגימים את יעילותו של כורכומין בהפגת כאבי שרירים כתוצאה מאימון גופני בעצימות גבוהה. כורכומין מפחית את פירוק השרירים (לפי רמת הקריאטין קינאז) ומצמצם את הדלקת והכאב הנלווים בזכות פעילותו נוגדת החמצון ונוגדת הדלקת. במחקר יחיד נוסף, כורכומין שניתן בשילוב עם רכיבים נוספים (MSM, קולגן, גליקוזמינוגליקנים, ל-ארגינין, ל-ליזין ולבונה) סייע לתהליכי ההחלמה ולהפחתת הכאב לאחר ניתוח לאיחוי קרע בגיד הכתף, אך לאור ריבוי הרכיבים בתוסף לא ניתן לייחס את ההשפעה באופן בלעדי לכורכומין.
מחקרים קליניים
בסקירה (ינואר-פברואר 2017) מוצגים הממצאים בנוגע ליעילות של צמחי מרפא ותוספי תזונה טבעיים להקלה על תופעות הלוואי והתסמינים של כאבי שרירים מאוחרים (DOMS, כאב כתוצאה מאימון גופני חריג הנמשך מספר ימים לאחר האימון), או למניעתם(443). במסגרת הסקירה מוצגים הממצאים ממחקרים פרה-קליניים וקליניים בנוגע להשפעה המיטיבה של מספר צמחי מרפא ותוספים טבעיים, ביניהם זעפרן (Crocus sativus), כורכום (Curcuma longa), קפאין, ג'ינג'ר (Zingiber officinale), קינמון (Cinnamomum zeylanicum), תה שחור, מיץ רימונים, קמומיל (Matricaria recutita), מיץ אבטיח, מיץ דובדבנים ושום (Allium sativum). לגבי כורכומין נכתב כי יעילותו בשיכוך כאבי שרירים נובעת מהפחתה של פירוק השריר (ירידה ברמת הקריאטין קינאז), פעילות נוגדת חמצון ונטרול רדיקלים חופשיים, ופעילות נוגדת דלקת הכוללת עיכוב ההפעלה של גורמי השעתוק NFkB ו-AP-1, עיכוב האנזים COX-2 והפחתת ריכוז ציטוקינים דלקתיים (IL-6, TNFΑ, IL-beta).
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (יוני 2016) בחן את השְפעת הנטילה של תוסף כורכומין (Longvida®) על כאבי שרירים ותחושת שריפה בשרירים ועל פגיעה בשרירים בעקבות אימון גופני בעצימות גבוהה. 28 נבדקים בריאים לא מאומנים (גיל ממוצע בקבוצת הכורכומין 20 ובקבוצת הפלסבו 19) חולקו אקראית לנטילת כורכומין (כורכומין תקני משולב בפוספוליפידים במבנה חלקיקי פטנטי SLCP* - כל כמוסה מכילה 80 מ"ג כורכומין) במינון 400 מ"ג ליום או פלסבו יומיים לפני ועד ארבעה ימים אחרי אימון גופני בעצימות גבוהה (תרגיל דחיקות רגליים חוזרות כנגד התנגדות). בתום ההתערבות נמצא כי תוסף כורכומין יעיל במובהק בהפחתת רמות הקריאטין קינאז (המעידים על נזק לשריר, P=0.035), ומדדי הדלקת (TNFΑ p=0.028 ואינטרלוקין 8 p=0.03) בשרירים בהשוואה לפלסבו. כמו כן, החזרה לערכי הבסיס של הקריאטין קינאז היתה מהירה יותר בעקבות הכורכומין (יומיים לעומת ארבעה ימים על פי רמות הקריאטין קינאז). כמו כן, נצפתה מגמה של הפחתה לא מובהקת ברמות ברמות האינטרלוקינים 6 ו-10 בקבוצת הכורכומין בהשוואה לפלסבו. עם זאת, לא נרשם הבדל בין הקבוצות בדיווח על כאבי השרירים בעקבות הפעילות העצימה. מסקנת החוקרים היתה כי כורכומין יעיל בהפחתת מדדי הדלקת בעת התאוששות השריר, אך בשל גודל המדגם הקטן לא הוכחה יעילות בהפחתת הכאב(444).
* Solid Lipid Curcumin Particle Technology.
במחקר אקראי מבוקר (ספטמבר 2015) הוערכה היעילות של תוסף טבעי להקלה על כאב לאחר ניתוח לאיחוי קרע בגיד הכתף (supraspinatus). במחקר נכללו 121 מטופלים, אשר עברו את הניתוח במהלך שנת 2013 וחולקו אקראית לנטילת התוסף או פלסבו למשך חודשיים החל מהיום הראשון לאחר הניתוח: 2 מנות ליום ב-15 הימים הראשונים ומנה אחת ליום ב-45 הימים הבאים. התוסף, המשווק תחת השם המסחריTendisulfur , מכיל מינון גבוה של MSM, קולגן, GAG (ובשמו המלא: glycosaminoglycans), חומצות האמינו ל-ארגינין ול-ליזין ומיצוי יבש של לבונה (Boswellia spp) ושל כורכום (Curcuma longa). בנוסף, כל המשתתפים קיבלו טיפול תרופתי נוגד כאב (tramadol /paracetamol). נמצא כי ציוני הכאב של המשתתפים בקבוצת התוסף היו נמוכים יותר באופן מובהק בשבוע הראשון לאחר הניתוח בהשוואה לפלסבו (p=0.0477), עם מגמה דומה, שאינה מובהקת סטטיסטית, בשבוע השני (p=0.0988). בשבועות שלאחר מכן לא נמצא הבדל מובהק בין הקבוצות (p>0.05). החוקרים מציעים כי על מנת להעצים את השפּעת התוסף ייתכן ויש להגדיל את המינון ב-4 השבועות הראשונים ולהאריך את משך הנטילה ב-1-2 חודשים(445).
מנגנוני פעולה
כורכומין פועל להפגת כאבי שרירים על ידי פעילות נוגדת חמצון, נוגדת דלקת ונוגדת כאב. כורכומין מנטרל רדיקלים חופשיים הגורמים לאזורי פגיעה מיקרוסקופיים בשרירים ולתהליכי פירוק והרס (המתבטאים בשחרור קריאטין קינאז). כמו כן, כורכומין מגביר פעילות של גורמי שעתוק מפחיתי דלקת (PPAR-γ) ומפחית ביטוי ופעילות של גורמי שעתוק המעורבים בתהליך הדלקתי (NFkB, AP-1). וכתוצאה מכך מפחית ייצור והפרשה של ציטוקינים דלקתיים (IL-6, TNFα, IL-b, IL-8). בנוסף כורכומין מפחית את פעילות האנזים cox2 5-LOX ו-iNOS האחראים לייצור PGE2, LTB4 ו-NO בהתאמה, ועל ידי כך מפחית את ההפרשה של מתווכי הדלקת והכאב(443,445) היסטמין וברדיקנין (PGE2), ומעכב את העליה בחדירות כלי דם (NO, PGE2) ואת ההסננה של תאי דלקת לאזורי הפגיעה (LTB4).
מחלות חניכיים
הקדמה | מחקרים קליניים | מנגנוני פעולה
הקדמה
מספר מחקרים בחנו את יעילות תכשירי כורכום וכורכומין בשימוש חיצוני בהשוואה לתכשירים סטנדרטיים (מבוססי כלורהקסידין) לטיפול בדלקות חניכיים כרוניות. מן המחקרים עולה כי כורכום בשילוב אמצעים מכניים (ניקוי אבנית) יעיל בהפחתת הרובד החיידקי, בטיפול בדלקת ובשיפור התסמינים הנלווים (דימום, אדמומיות) בזכות פעילותו נוגדת הדלקת והאנטי בקטריאלית ותכונתו המצמתת, אך בשל איכות מתודולוגית לוקה בחסר של המחקרים (בעיקר שימוש במינון לא מספק של כורכום) קשה לקבוע אם תכשירים מבוססי כורכום משתווים ביעילותם לתכשירים מסחריים מבוססי כלורהקסידין. עם זאת, השימוש בתכשירים מבוססי כורכום לווה בפחות השפעות שליליות בהשוואה לתכשירים הסטנדרטיים.
מחקרים קליניים
סקירה שיטתית (נובמבר 2016) בחנה את יעילות כורכום בשימוש חיצוני בהשוואה לשטיפות פה סטנדרטיות המכילות את החומר האנטי בקטריאלי כלורהקסידין (chlorhexidine) במניעה ובטיפול בדלקת חניכיים (gingivitis). בסקירה הנוכחית נכללו חמישה מחקרים קליניים מבוקרים. בכל המחקרים השתתפו סה"כ 290 מבוגרים עם דלקת חניכיים, אשר טופלו בכורכום או בכלורהקסידין. הטיפול ניתן באמצעות שטיפות פה או באמצעות ג'ל פעמיים ביום למשך 21 יום. שניים מהמחקרים מצביעים על יעילות נמוכה יותר של כורכום בהשוואה לכלורהקסידין בהפחתת מדד הרובד החיידקי (plaque index) ומדד הדלקת (gingival index), אולם בשלושה מחקרים שני הטיפולים נמצאו יעילים במידה דומה. על בסיס הממצאים משני מחקרים בהם נערכה בדיקה מיקרוביאלית, שני הטיפולים היו בעלי יעילות דומה בהפחתת ריכוז החיידקים. בנוסף, בהתבסס על שני מחקרים בהם דווח על השפעות שליליות, נמצא כי כורכום היה מלווה בשיעור נמוך יותר של פגיעה בצבע השיניים והיה בעל טעם טוב יותר בהשוואה לכלורהקסידין. מתוך הסקירה עולה כי הן כורכום והן כלורהקסידין יעילים בהפחתת הרובד החיידקי והדלקת ולפיכך יכולים לשמש למניעה ולטיפול בדלקת חניכיים במקביל לטיפול באמצעים מכניים (ניקוי אבנית). עם זאת, נחוצים מחקרים שמשכם עולה על 21 ימים הכוללים מספר רב יותר של נבדקים כדי לבסס את יעילות הצמח ביחס לטיפול המקובל(446).
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו בחן את יעילות הטיפול באמצעות ג'ל כורכום (Curenext Oral Gel®) בדלקת חניכיים בהשוואה לתכשירי הג'ל הקיימים המכילים כלורהקסידרין (chlorhexidine) וכלורהקסידרין בשילוב האנטיביוטיקה מטרנידזול (chlorhexidine-metronidazole). במחקר, 60 נבדקים (בני 18-35) בריאים שהושרתה בהם דלקת חניכיים (על ידי מניעת צחצוח וניקוי באזור מסוים של הפה) חולקו אקראית למריחת אחד משלושת סוגי הג'לים פעמיים ביום למשך עשר דקות במשך 29 ימים כטיפול יחיד בדלקת החניכיים. בתום ההתערבות, ג'ל המופק ממיצוי כורכום (כורכומין בריכוז 1%) נמצא יעיל כמו התכשירים האנטיבקטריאליים האחרים בהפחתת מצב הדלקת, הרובד החיידקי והדימום מהחניכיים (p<0.001 בהשוואה למצב הבסיס בכל הקבוצות, p=0.05 בין הקבוצות). הוא אף היה יעיל באותה מידה כמו הטיפול האנטיביוטי (chlorhexidine-metronidazole) בהפחתת העליה ברמות הציטוקין הדלקתי IL-1β והכימוקין CCL28 (סמן לפעילות דלקתית אנטי מיקרוביאלית) בפה, ושניהם היו יעילים יותר במובהק בהפחתת העליה ברמות ה- IL-1β וה-CCL28 בהשוואה לטיפול בכלורהקסידרין לבדו (p<0.001 בשני המדדים)(447).
מחקר קליני השוואתי (2018) בחן את יעילות שבב המכיל כורכום בהשוואה לשבב המכיל chlorhexidine בטיפול מקומי בדלקת מסב השן (periodontitis). במחקר נבחנו 120 מוקדי דלקת (מספר הנבדקים לא צוין) עם כיסים בעומק 5-8 מילימטרים נבחרו לשמש במודל פה-חצוי (split mouth model). מוקדי הדלקת חולקו אקראית לטיפול מקומי בשבב chlorhexidine או בשבב כורכום בשילוב הסרת רובד ואבן שן ממשטחי השן והקצעת שורשים, או בטיפול הסרת רובד שן והקצעת שורשים לבדו. כעבור שלושה חודשים נצפתה הפחתה מובהקת ברובד חיידקי השן, בדלקת החניכיים, בעומק הכיסים ועליה מובהקת ברמת ההצמדות היחסית של החניכיים לשיניים בכל הקבוצות, עם יתרון מובהק לטיפול התרופתי ולשבב הכורכום על פני הטיפול המכני לבדו. השיפור בשתי קבוצות הטיפול נשמר עד לתום תקופת המחקר (שלושה חודשים), אך בקבוצת הטיפול המכני חלה הדרדרות מובהקת במצב כבר כעבור חודש (עליה בעומק הכיסים וירידה בהצמדות החניכיים). מסקנת החוקרים היתה כי כורכום יעיל כמו chlorhexidine בטיפול מקומי בדלקת מסב השן(448).
מחקר קליני השוואתי אקראי (יולי 2011) בחן את יעילות שטיפת פה המכילה כורכומין בהשוואה לשטיפת פה המכילה chlorhexidine gluconate במניעת דלקת חניכיים והיווצרות רובד חיידקי על השיניים. 100 נבדקים (בני 25-35) עם רמת דלקתיות בחניכיים בינונית עד גבוהה וציון גבוה מ-1 במדד הרובד החיידקי נכללו במחקר. הם חולקו אקראית לשימוש בשטיפת פה המכילה כורכומין (10 מ"ג כורכומין מומסים ב-100 מ"ל מים בתוספת 0.005% שמן מנטה) ולשטיפת פה המכילה כלורהקסידין גלוקונט. הנבדקים הונחו לגרגר מי שטיפה במינון 10מ"ל מדוללים ב-10מ"ל מים (יחס של 1:1) פעמיים ביום לאחר הצחצוח במשך 21 ימים. בתום ההתערבות נמצא שמי הפה שהכילו כלורהקסידין גלוקונט היו יעילים יותר במובהק ממי הפה שהכילו כורכום בהפחתת הרובד החיידקי על השיניים (p<0.05), על אף ששני התכשירים הפחיתו את הרובד החיידקי במידה מובהקת בהשוואה למצב הבסיס (p<0.01). כמו כן, לא נצפו הבדלים מובהקים בין התכשירים בהפחתת הדלקת ושני התכשירים הפחיתו את הדלקתיות במידה מובהקת בהשוואה למצב הבסיס (p<0.01). לבסוף, שני התכשירים הפחיתו במובהק את הספירה החיידקית בהשוואה למצב הבסיס (p<0.05) ללא הבדל סטטיסטי ביניהם. מסקנת החוקרים היתה ששני התכשירים יעילים במניעה ובטיפול בדלקת חניכיים, אך מי הפה המכילים כלורהקסידין גלוקונט יעילים יותר בהפחתת הרובד החיידקי. החוקרים טוענים שיתכן שהסיבה לכך היא דילול יתר של תמיסת הכורכומין(449).
מחקר קליני השוואתי (אפריל-יוני 2015) בחן את יעילות ג'ל כורכום (Curenext gel) בהשוואה לג'ל כלורהקסידין (chlorhexidine) למניעה ולטיפול בהיווצרות רובד חיידקי ובדלקת חניכיים. שישים נבדקים הסובלים מדלקת חניכיים בעקבות הצטברות רובד חיידקי חולקו אקראית למריחת ג'ל המופק ממיצוי כורכום (ריכוז הכורכומין 1%) במינון 10 מ"ג או ג'ל כלורהקסידין (בריכוז 2%) על גבי סד פלסטי המותאם לשיניים למשך 5 דקות בכל פעם במשך 21 ימים. בתום ההתערבות נמצא כי ג'ל כורכום יעיל כמו ג'ל כלורהקסידין בהפחתת הרובד החיידקי (הפחתה של 60.81% לעומת 60.21% בהתאמה בהשוואה למצב הבסיס, p<0.05 בשניהם) והדלקת (הפחתה של 71.70% לעומת 71.20% בהשוואה למצב הבסיס, p<0.05 בשניהם) ללא הבדל מובהק בין הטיפולים בשני המדדים. ג'ל הכורכום נסבל יותר בהשוואה לכלורהקסידין בשל ריחו, טעמו ואי ההכתמה של השיניים(450).
מחקר קליני השוואתי אקראי (2015) בחן את יעילות כורכום בהשוואה לג'ל המכיל כלורהקסידין גלוקונט לטיפול בדלקת חניכיים. 40 נבדקים (בני 20-35) חולקו אקראית למריחת ג'ל המכיל מיצוי של כורכום באלכוהול וגליצרין (ריכוז לא צוין) או ג'ל המכיל chlorhexidine gluconate (בריכוז 0.2%). שני התכשירים נמצאו יעילים לטיפול בהצטברות רובד חיידקי, בהפחתת דימום מהחניכיים ובהפחתת הדלקת בהשוואה למצב הבסיס (p<0.001 ביחס לשני התכשירים בכל המדדים). אך כלורהקסידין נמצא יעיל יותר בהשוואה לכורכום בכל המדדים שנבדקו (p<0.001). החוקרים מייחסים את יעילות ג'ל הכורכום להשְפעתו האנטי דלקתית וסבורים כי יתרון הכלורהקסידין נובע ככל הנראה בשל הריכוז הנמוך של הכורכום בג'ל(451).
מחקר קליני השוואתי אקראי חד סמיות ומבוקר פלסבו (אפריל 2013) בחן את יעילות שטיפת פה באמצעות תמיסה המכילה כורכומין בשילוב הקצעת שורשים בהשוואה לתמיסה המכילה כלורהקסידין גלוקונט בטיפול בדלקת חניכיים כרונית. 23 נבדקים (טווח גילאים 30-55) הסובלים מדלקת חניכיים כרונית (עם כיסי חניכיים בעומק 5 מ"מ לפחות) שעברו הקצעת שורשים חולקו אקראית לארבעה מפגשי טיפול שטיפת פה עמוקה (sub-gingival irrigation) בתמיסות המכילות מיצוי כורכומין באתנול וגליצרול (בריכוז 1%), כלורהקסידין (בריכוז 0.2%) או פלסבו עם הקצעת השורשים (ניקוי עמוק של השיניים והחניכיים בהרדמה), כעבור חודש, וכעבור שלושה ושישה חודשים. כעבור חודש נצפה יתרון לטיפול באמצעות כורכומין ולטיפול בכלורהקסידין בשיפור מצב הדימום בהשוואה לפלסבו (p<0.01) עם יתרון לטיפול באמצעות כורכומין (הפחתה בדימום בהשוואה למצב הבסיס: 95.7% לכורכומין, 87% לכלורהקסידין ו-52.2% לפלסבו). עם זאת, כעבור שישה חודשים נצפה יתרון בלתי מובהק לטיפול בכלורהקסידין, כאשר בקבוצת הכורכומין נצפתה הישנות קלה של הדלקת (הפחתה בדימום בהשוואה למצב הבסיס: 69.6% לכורכומין, 82.6% לכלורהקסידין ו-60.9% לפלסבו; שיעור האדמומיות: 73.9% לכורכומין, 17.4% לכלורהקסידין ו-69.6% לפלסבו). בכל הקבוצות נצפתה הפחתה מובהקת ברובד החיידקי בהשוואה למצב הבסיס (p<0.01), ללא הבדל מובהק בין הקבוצות. כמו כן, כלורהקסידין וכורכומין היו יעילים באותה מידה בהפחתת העומס החיידקי (על פי מבחן BANA) לאורך כל ההתערבות (ללא הבדל סטטיסטי בין הקבוצות), עם יתרון לא מובהק לכורכומין (73.9% דגימות שליליות לכורכומין לעומת 65.2% לכלורהקסידין ו-30.4% לפלסבו)(452).
מחקר קליני השוואתי אקראי מבוקר (2013) בחן את יעילות מי פה המכילים כורכומין בהשוואה לכלורהקסידין (chlorhexidine) בשילוב עם הקצעת שורשים* לטיפול בדלקת חניכיים כרונית. 30 נבדקים (טווח גילאים 20-40) הסובלים מדלקת חניכיים כרונית חולקו אקראית לשלוש קבוצות. בשתי הקבוצות הראשונות, הנבדקים עברו הקצעת שורשים וטופלו במי פה המכילים כלורהקסידין או כורכומין (ריכוז לא ידוע) במשך 21 ימים, ואילו בקבוצה השלישית הנבדקים עברו רק הקצעת שורשים. בתום ההתערבות נצפה שיפור קליני במצב החניכיים בכל הקבוצות בהשוואה למצב הבסיס. בהשוואה לקבוצת שעברה ניתוח בלבד, השיפור במצב החניכיים היה מובהק יותר בשתי קבוצות הטיפול (p<0.05). לא נצפה הבדל מובהק בין כורכומין ובין כלורהקסידין בשיפור מצב הדלקת ומצב הרובד החיידקי (p>0.05). פרטים נוספים אינם ידועים היות שהמאמר המלא אינו נגיש לקריאה(453).
* הקצעת שורשים היא הליך של ניקוי עמוק של החניכיים והשיניים המבוצע בהרדמה.
מחקר קליני מבוקר (ינואר 2011) בחן את יעילות הטיפול באמצעות ג'ל כורכום בשילוב הקצעת שורשים בדלקת חניכיים כרונית בהשוואה להקצעת שורשים בלבד. 30 נבדקים הסובלים מדלקת מסב השן (periodontitis) כרונית מקומית או מפושטת עם עומק כיסים של 5-7 מ"מ עברו טיפול של הקצעת שורשים בחצי פה ובחצי השני טופלו בנוסף בהחדרת ג'ל על בסיס מים המכיל מיצוי צמח כורכום השלם (בריכוז 2%) לכיסי החניכיים. מצב הדלקת הוערך ביום הטיפול וכעבור חודש ו-45 ימים. בתום התקופה, נצפה שיפור מובהק בדימום, עומק הכיסים, מצב הדלקת, עובי הרובד החיידקי והעומס החיידקי בהשוואה למצב הבסיס בעקבות הטיפול בהקצעת השורשים ובעקבות הטיפול בהקצעת השורשים ששולב בג'ל כורכום (p=0.000 בכל המדדים), עם יתרון לא מובהק לטיפול המשולב בכורכום(454).
מחקר קליני פתוח לא מבוקר (דצמבר 2014) בחן את בטיחות ויעילות השימוש בג'ל כורכום לטיפול בדלקת חניכיים(455). 10 נבדקים (בני 16-55) הסובלים מדלקת חניכיים חמורה שהתאפיינה באדמומיות, דלקתיות ודימום (3 ומעלה במדד הדימום), ולא טופלה במשך תקופה של לפחות שישה חודשים, מרחו ג'ל המכיל מיצוי של כורכום על החניכיים במשך 21 ימים. בתום ההתערבות נמצא שג'ל הכורכום יעיל במובהק בהפחתת חומרת דלקת החניכיים על פי דיווח הנבדקים (p<0.01) ובהפחתת תסמיניה (אדמומיות, דימום)(p<0.001).
מנגנוני פעולה
יעילות כורכומין בטיפול בדלקות חניכיים מיוחסת לתכונותיו כנוגד חמצון (מפחית עקה חמצונית כתוצאה מרעלנים שמייצרים חיידקי רובד השן), נוגד דלקת (מעכב COX2 ומפחית ייצור פרוסטגלנדינים דלקתיים מחומצה ארכידונית, מעכב פעילות נויטרופילים מפחית רמות ציטוקינים דלקתיים (TNF-α, IL-1β), אנטי בקטריאלי (מפחית רובד חיידקי, מונע את גידול החיידק streprococcus mutans, מונע את הצמדותו לרוק ומונע ממנו ליצר חומצה המזיקה לשיניים, מונע הצמדות ופעילות מפרקת של חיידקי רובד השן bacteroides forsythus, porphyromonas gingivalis, treponema denticola), מצמת (מפחית דימומים) ומעודד התחדשות רקמות (מעודד שגשוג תאים פיברובלסטים)(456-459).
מחלות עיניים
הקדמה | מחקרים קליניים | מנגנוני פעולה
הקדמה
בשלושה מחקרים קליניים הדגים כורכומין בשילוב עם הטיפול התרופתי יעילות טיפולית כנגד דלקות כרוניות ממקור זיהומי או אוטואימוני בעיניים: דלקת הענביה הקדמית ודלקת מדומה בארובת העין. כורכומין שיפר את תסמיני הדלקת והפחית את סיכויי הישנותה הודות לפעילותו נוגדת הדלקת ונוגדת החמצון. באחד המחקרים יעילות כורכומין השתוותה ליעילות הטיפול הקורטיקוסטרואידי, ללא תופעות הלוואי הכרוכות בטיפול מסוג זה.
מחקרים קליניים
סקירה (מרץ 2014) בחנה את ההשפעה המטיבה של השימוש בכורכום (Curcuma longa) ובכורכומין חומר פעיל מתוך הצמח, על מחלות עיניים. נמצא כי לצמח השפעה נוגדת דלקת, נוגדת חמצון ונוגדת גידולים. ניתן להשתמש בבטיחות במינון של עד 8 ג' ליום למשך שלושה חודשים. בנוסף, במחקרים קליניים ופרה-קליניים לכורכום נמצאה יעילות לטיפול במחלות עיניים כגון דלקת ענביה כרונית (אובאיטיס), רטינופתיה סוכּרתִית, גלאוקומה, ניוון מקולרי הקשור בגיל ותסמונת העיניים היבשות(460).
להלן פירוט המחקרים הקליניים המופיעים בסקירה:
במחקר קליני בלתי מבוקר (יוני 1999) נבחנה יעילות הנטילה של כורכומין לטיפול בדלקת הענביה הקדמית (אוביאיטיס אנטריורי כרוני). 32 נבדקים הסובלים מדלקת הענביה הקדמית חולקו לשתי קבוצות. קבוצה אחת נטלה כורכומין (סוג מיצוי לא ידוע) במינון 1125 מ"ג ליום והקבוצה השניה (עם תגובה חיובית במבחן מנטו – מבחן עורי לזיהוי הדבקה בחיידק השחפת) נטלה כורכומין במינון 1125 מ"ג ליום במשך 12 שבועות ובנוסף טופלה בתרופה לטיפול בשחפת במשך שנה. שתי הקבוצות הורשו להשתמש בטיפות עיניים להרחבת אישונים (Atropine/Cyclopentolate 1%) לפי הצורך. בתום ההתערבות חל שיפור במצב העין של הנבדקים בשתי הקבוצות, כאשר בקבוצת הכורכומין לבדו שיעור המשתפרים היה 100% ואילו בקבוצת הכורכומין בשילוב הטיפול נגד שחפת שיעור המשתפרים היה 86%. במעקב אחר מצב המטופלים שנמשך שלוש שנים מתום ההתערבות נמצא כי שיעור חזרת המחלה בקבוצת הכורכומין היה 55% ואילו בקבוצת הטיפול המשולב היה 36%. ארבעה מתוך 18 (22%) נבדקים בקבוצת הכורכומין ושלושה מתוך 14 (22%) בקבוצת הכורכומין והטיפול בשחפת איבדו את מאור עיניהם כתוצאה מסיבוכי המחלה בתקופת המעקב. מסקנת החוקרים היתה כי הטיפול באמצעות כורכומין יעיל לטיפול בדלקת כרונית של הענביה לא פחות מטיפול קורטיקוסטרואידי, ללא תופעות הלוואי הכרוכות בטיפול מסוג זה(461).
במחקר פתוח לא מבוקר (אוקטובר 2010) נבחנה יעילות תוסף כורכומין פוספוליפידי (Meriva) בטיפול בדלקת הענביה הקדמית (אובאיטיס אנטריורי כרוני). דלקת הענביה יכולה להתפתח כמחלה עצמאית, כתסמין של מחלה אוטואימונית או מחלה דלקתית מערכתית אחרת או כחלק מזיהום (חיידקי, נגיפי, טפילי, פטרייתי). 122 נבדקים (טווח גילאים 21-68, גיל ממוצע 37) הסובלים מדלקת כרונית בענביה הקדמית בעקבות מחלה אוטואימונית, זיהום הרפס או ממקור לא ידוע נטלו כורכומין עטוף בפוספוליפיד פיטוזומלי (כורכומין ופוספטידיל כולין ביחס 1:2 (במינון 1200 מ"ג ליום במשך 18 חודשים. כל המטופלים טופלו בטיפול תרופתי מערכתי (סטרואידים, מדכאי חיסון, טיפול תרופתי נגד נגיף ההרפס, טיפול אנטיטוקסופלסמי) או בטיפות עיניים (סטרואידים, מרחיבי אישונים, נוגדי דלקת לא סטרואידים). מעקב אחר מצב המטופלים נערך במשך 12 חודשים לפני ההתערבות ולאחריה. 106 נבדקים השלימו את ההתערבות. נמצא כי כורכומין הפחית במובהק את הישנות המחלה (36 חזרות של המחלה במהלך שנה לעומת 275 לפני הטיפול, 88% שיפור p<0.001). ההיענות הגבוהה ביותר לטיפול נרשמה בקרב החולים ממקור אוטואימוני. 80% מהנבדקים דיווחו על הפחתה של אי הנוחות בעין. הטיפול נסבל היטב ולא נרשמו תופעות לוואי לא רצויות (למעט מטופל אחד שלא התמיד בטיפול בשל תופעות לוואי עיכוליות)(82).
מחקר קליני לא מבוקר (ספטמבר 2000) בחן את יעילות הטיפול בגידול דלקתי מדומה בארובת העין ממקור לא ידוע (Idiopathic inflammatory orbital pseudotumor) באמצעות כורכומין בנטילה פומית. מדובר במחלה דלקתית בארובת העין המדמה גידול ומתבטאת בנפיחות, כאב, תנועה מוגבלת של העין, הפרעות בראיה, בחילות, הקאות וכאבי ראש. 8 נבדקים הסובלים מהמחלה נטלו כורכומין (סוג מיצוי לא ידוע) במינון 1125 מ"ג ליום במשך שישה עד 22 חודשים. חמישה נבדקים השלימו את ההתערבות. ארבעה מתוכם החלימו לחלוטין והדגימו נסיגה מוחלטת של סממני הדלקת ואילו בנבדק אחד הנפיחות פחתה לחלוטין אך נותרה מגבלה מסוימת בתנועת גלגל העין. לא דווח על תופעות לוואי לא רצויות בעקבות הטיפול ולא נצפתה חזרה של המחלה בקרב הנבדקים(462).
מנגנוני פעולה
מחקרים קליניים ופרה-קליניים שונים הדגימו יעילות של כורכומין בטיפול במחלות עיניים שונות: ירוד (קטרקט), ניוון מקולרי גילי, תסמונת העין היבשה, רטינופתיה סוכּרתִית וויטרורטינופטיה שגשוגית (PVR היפרדות רשתית כתוצאה מרטינופתיה סוכּרתִית) ודלקת הענביה הקדמית(460).
בכל המקרים הללו כורכומין הדגים פעילות נוגדת חמצון, פעילות נוגדת דלקת ונוגדת שגשוג יתר של תאים.
פעילות זו מיוחסת להפעלת קולטן הגרעין וגורם השעתוק PPAR-γ אשר מסייע בהגברת מטבוליזם של ליפידים ושל גלוקוז, מפחית עמידות לאינסולין, ובנוסף מסייע להפחתת עקה חמצונית על ידי הגברת ביטוי של אנזימים נוגדי חמצון אנדוגניים, הפחתת ROS, תוצרי גליקציה מתקדמים AGE וחמצון שומנים. בנוסף, הפעלת PPAR-γ מובילה לירידה במדדי דלקת ובשגשוג יתר של תאים על עיכוב מסלולים של גורמי שעתוק MAPK (ERK, P38, JNK) AP-1, STAT, and NF-κB וכתוצאה מכך עיכוב ייצור ציטוקינים דלקתיים (IL-6, TNF-α, INF-γ IL-1β), הפחתה בביטוי אנזימים כגון ניטריק אוקסיד סינתאז המייצר ניטריק אוקסיד, הפחתה בביטוי גורמים כימוטקטיים ומולקולות הצמדות לתאים חיסוניים, עיכוב מטלופרוטאין MMP-9 (המעורב בפירוק המטריקס הבין תאי), ועיכוב(460) גורמי גידול שונים (גורם גידול וסקולרי אנדותלי VEGF tissue plasminogen activator, endothelin-1).
מחלות כליה
הקדמה | מחקרים קליניים | מנגנוני פעולה
הקדמה
כורכום הניתן לבדו או בשילוב עם רכיבים צמחיים נוספים משפר תסמינים (פרופיטוס-גרד, יתר לחץ דם והפרשת חלבון בשתן) של מחלות כליה כרוניות שונות כגון פגיעה כלייתית בסוכרת, תסמונת כלייתית עקב מחלת הזאבת, מגן על הכליות מפני לייפת ומוות תאי ומשפר סיכויי קליטה של כליות מושתלות על ידי פעילות נוגדת דלקת ונוגדת חמצון.
מחקרים קליניים
מחקר קליני (2015) בחן את השְפעת כורכומין על מדדי עקה ודלקת במחלת כליות סוכּרתִית. חולי סוכרת בעלי פגיעה כלייתית נטלו כורכומין במינון 500 מ"ג ליום במשך 15-30 ימים. בתום ההתערבות נמצא כי כורכומין הפחית במובהק את הפגיעה הכלייתית שנמדדה על פי הפרשת המיקרו אלבומין בשתן. לא נצפתה השפעה על מדדים מטבוליים של הנבדקים. כמו כן, כורכומין את הגביר את רמות החלבון quinone oxidoreductase 1 (NQO-1) המגיב לעליה ב-Nrf2, הגביר רמות אנזימים נוגדי חמצון אנדוגניים והפחית חמצון שומנים (מלונדיאלדהידים). כורכומין הפחית את רמות הליפופרוטאינים בסרום (הקשורים בבקרה ובתפקוד תאי מערכת החיסון) והגביר את רמת הקינאז IkB, אנזים המעכב את מסלול השעתוק הדלקתי של NFkB. לבסוף, כורכומין העלה את הביטוי הגנטי של מספר חיידקי מעי החשובים לשמירה על שלמות מחסום המעי(463).
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2015) בחן את יעילות כורכום בהפחתת עקה חמצוני בחולי המודיאליזה. 50 נבדקים בני 18-60 המטופלים בהמודיאליזה חולקו אקראית לקבלת כורכום או פלסבו במשך שמונה שבועות. בתום ההתערבות חלה ירידה מובהקת ברמות המלונדיאלדהידים ועליה מובהקת ברמות האנזימים נוגדי החמצון גלוטטיון פרוקסידאז, גלוטטיון רדוקטאז וקטלאז בשתי הקבוצות בהשוואה למצב הבסיס. יחד עם זאת, רק בקרב קבוצת הכורכום נמצא שיחס הירידה ברמת המלונדיאלדהידים (0.2 לעומת 0.1, p=0.04) ויחס העליה ברמת האנזים נוגד החמצון קטלאז בכדוריות הדם האדומות (0.73 לעומת 0.54, p=0.02) היה גבוה במובהק בהשוואה לפלסבו. כמו כן, נצפתה עליה מובהקת ברמת האלבומין בסרום בקבוצת הכורכום בהשוואה לקבוצת הפלסבו (p=0.001). הטיפול נסבל היטב והיה נטול תופעות לוואי(464).
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2011) בחן את ההשפעה של כורכום על הסובלים מתסמונת כלייתית בעקבות מחלת הזאבת (Lupus nephritis). עשרים וארבעה (24) נבדקים שאובחנו בתסמונת כלייתית בהתקף חוזר או במצב של הדרדרות נמשכת עמידה לטיפול (relapsing or refractory) חולקו אקראית לנטילת תמצית כורכום (במינון 1500 מ"ג עם תכולת כורכומין של 66.3 מ"ג ביום) או פלסבו עם כל ארוחה במשך שלושה חודשים. בתום ההתערבות נמצא כי כורכום סייע להפחית את רמות החלבון בשתן (p<0.009), להפחית נוכחות דם בשתן (p<0.02), והפחית את לחץ הדם הסיסטולי (p=0.02) במטופלים הסובלים מלופוס נפריטיס בהשוואה למצב הבסיס. לא נצפתה השפעה מובהקת על המשתנים בהשוואה למצב הבסיס בקבוצת הפלסבו. כורכומין מגן על הכליות בתסמונת כלייתית שמקורה בזאבת מפני לייפת ומוות תאי על ידי פעילות נוגדת חמצון ועיכוב מסלול השעתוק של (TGFβ (transforming growth factor beta הגורם לעליה בביטוי הציטוקין הדלקתי TNFɑ בתאי אנדותל הכליה. כורכומין אינו משפיע על המנגנון החיסוני הגורם ליצירת נוגדנים עצמיים בזאבת (הנובע מפעילות יתר של זרוע החיסון Th2). כמו כן, כורכומין מונע הדרדרות של מצב הכליות בתסמונת על ידי ויסות יתר לחץ הדם העורקי (בייחוד יתר לחץ דם סיסטולי) במנגנון פעולה לא ידוע(105).
מחקר קליני אקראי מבוקר וכפול סמיות (2014) בחן השְפעת שימוש בכורכום כטיפול בפרוריטוס (גרד) אורמי בקרב חולי כליות סופניים. 100 מטופלי המודיאליזה בגיל ממוצע 53.3, הסובלים מפרוריטוס השתתפו במחקר וחולקו אקראית לשתי קבוצות: קבוצת התערבות בה נטלו כורכום- במינון 5001 מ"ג ליום (מינון שווה ערך ל-66.3 מ"ג כורכומין) או פלסבו למשך 8 שבועות. בתום ההתערבות, בקבוצת הכורכום נראתה הפחתה מובהקת במדד הדלקת (CRP (p=0.012 ובמדד חומרת הפרוריטוס (גרד) (p=0.001) בהשוואה לקבוצת הפלסבו (p=0.012). לא נרשמו תופעות לוואי לשימוש בכורכום. החוקרים מסיקים כי כורכום מהווה טיפול יעיל ובטוח בקרב חולי כליות(465).
מחקר קליני אקראי מבוקר פלסבו (2005) בחן את יעילות תוסף המכיל כורכומין וקוורצטין בטיפול בשלבים ראשונים של דחיית שתל במושתלי כליות המטופלים בדיאליזה. דחיית שתל הוגדרה כצורך בדיאליזה בשבוע הראשון שלאחר ההשתלה. ליקוי בתפקוד השתל הוגדר כרמות קריאטינין שאינן יורדות בתוך 48 שעות או רמות קריאטינין גבוהות מ-2.5 מ"ג לדציליטר ביום העשירי. 43 נבדקים בשלבים ראשונים של דחיית שתל מתורם מת חולקו אקראית לשלוש קבוצות: קבוצת פלסבו, קבוצת מינון נמוך (480 מ"ג כורכומין ו-20 מ"ג קוורצטין) וקבוצת מינון גבוה (840 מ"ג כורכומין ו-40 מ"ג קוורצטין) במשך חודש. 39 נבדקים השלימו את ההתערבות (נבדק אחד פרש מבחירה ושלושה בשל דליפת שתן). בתום ההתערבות דחיית שתל התרחשה בקרב שני נבדקים בקבוצת הביקורת ולא התרחשה כלל בקבוצת ההתערבות. השתל נקלט היטב בקרב 43% מהנבדקים בקבוצת הביקורת, 71% נבדקים בקבוצת המינון הנמוך ו-93% מהנבדקים בקבוצת המינון הגבוה (נתוני המובהקות אינם ידועים). רמות הקריאטינין בסרום היו נמוכות במובהק בקבוצות ההתערבות בהשוואה לקבוצת הביקורת (1.33 בקבוצת המינון הגבוה, 1.65 בקבוצת המינון הנמוך ו-1.82 בקבוצת הביקורת). שיעור מקרי הדחייה החריפה בתוך שישה חודשים מההשתלה היו 14.3% בקבוצת הביקורת והמינון הנמוך ו-0% בקבוצת המינון הגבוה. רעד כביטוי לרעילות במערכת העצבים נצפה בקרב 13% מהנבדקים בקבוצת המינון הגבוה בהשוואה ל-46% בקבוצת המינון הנמוך ובקבוצת הביקורת. כמו כן, רמות האנזים Heme oxygenase-1) HO-1) בשתן עלו באופן תלוי מינון בקבוצות ההתערבות. מסקנת החוקרים היתה שכורכומין וקוורצטין משפרים את סיכויי השתלות הכליה מתורמים מתים הודות להפעלת מסלול האיתות של חלבון Nrf2 והגברת ביטוי גנים של חלבונים המשתייכים למערך ההגנה מפני עקה חמצונית בתאים (Heme oxygenase 1 Heat shock proteins). פרטים נוספים אינם ידועים היות שהמאמר המלא אינו נגיש לקריאה(466).
שני מחקרים קליניים אקראיים ומבוקרי פלסבו (2013,2017) שנערכו על אותו המדגם, בחנו את השְפעת הטיפול באמצעות תוסף כורכומין ובוסווליה על מדדי דלקת בשלבים מוקדמים של דלקת כליות כרונית. 16 נבדקים (גיל ממוצע 56) הסובלים מדלקת כליות כרונית בדרגה 2-3 ואינם מטופלים בדיאליזה חולקו אקראית לטיפול באמצעות תוסף המכיל כורכומין ובוסווליה (Boswellia serrata) (סוגי המיצויים או מינונם אינם ידועים) או פלסבו במשך שמונה שבועות. בתחילת ההתערבות נרשמו רמות גבוהות של דלקת (IL-6, TNFɑ, CRP) ורמות נמוכות של נוגדי חמצון (גלוטטיון). בתום ההתערבות נצפה יתרון מובהק של התוסף על פני פלסבו בהפחתה ברמת הפרוסטגלנדין הדלקתי (PGE2 (p=0.05. לא נצפתה השפעה על רמות איקוסנואידים נוספים בשלבים הראשונים של דלקת כליות כרונית. כמו כן, בתום ההתערבות נצפתה ירידה ברמות האינטרלוקין IL-6 כתלות בזמן שחלף (p=0.03) ובמידת ההיענות לטיפול של הנבדקים כתלות בזמן שחלף (p=0.04). לא נצפו שינויים מובהקים במדדי הדלקת והעקה החמצונית האחרים. הטיפול הצמחי נסבל היטב והיה נטול תופעות לוואי. החוקרים מסכמים שמחלת כליות כרונית מאופיינת בדלקת כלל מערכתית וברמות ירודות של נוגדי חמצון, וכי הטיפול הצמחי עשוי להפחית את רמות הציטוקינים הדלקתיים ולשפר את מצב הדלקת(467-468).
מנגנוני פעולה
לכורכומין השפעה מגינה מפני אי-ספיקת כליות כרונית ותרומה לטיפול בקרדיומיופתיה והפרעות קרדיווסקולריות. כורכומין מפחית תנגודת לאינסולין, היפרגליקמיה, היפרליפידמיה, יתר לחץ דם ותסמינים נוספים הקשורים לשמנות ולמחלות מטבוליות הקשורות בה, המהווים גורמי סיכון להתפתחות תסמונת לבבית כלייתית. לכורכומין אף השפעה מגינה מפני כשל כלייתי כרוני על ידי עיכוב מסלול גורם השעתוק הפרו דלקתי NFkB ומניעת הפחתה בפעילות גורם השעתוק האנטי דלקתי PPARɣ. בנוסף, כורכומין מונע עליה של אנזימים (phospholipase A2, COX2, 5-LOX) ציטוקינים דלקתיים (TNFɑ, IL-6, IL-1β) וגורמי גידול (TGFβ, VEGF, PDGF) המעורבים בלייפת של הכליות ובהתפתחות כשל כלייתי(262,274,469).
מחלות עור
הקדמה | מחקרים קליניים | מנגנוני פעולה
הקדמה
מספר מחקרים קליניים מצביעים על יעילות כורכום לבדו או בשילוב עם צמחים נוספים (לרוב בשימוש חיצוני) במניעת הזדקנות העור, במניעת נזקי קרינה ובריפוי פצעים, ובטיפול בילפת שטוחה (ליכן פלנוס), פסוריאזיס וויטיליגו. כורכום פועל כנוגד דלקת וכנוגד חמצון, כמעכב שגשוג תאים, כאנטי מיקרוביאלי וכמעודד התחדשות הרקמות.
מחקרים קליניים
כללי | פסוֹריאזיס | ילפת שטוחה (ליכן פלנוס)
כללי
סקירה שיטתית (2016) בחנה את יעילות הטיפול במחלות עור באמצעות כורכום והרכיב הפעיל כורכומין בנטילה פנימית ובשימוש חיצוני. 18 מחקרים קליניים נכללו בסקירה, תשעה מתוכם בחנו כורכום שניטל פומית, שמונה מחקרים בחנו כורכום במריחה חיצונית ומחקר אחד שילב בין שימוש חיצוני ופנימי של כורכום/כורכומין. בין המחלות שנסקרו: אקנה, אלופציה, דלקת עור אטופית (אטופיק דרמטיטיס), הזדקנות עור הפנים בעקבות חשיפה לקרינה, ילפת שטוחה ברירית הפה (Oral lichen planus), גרד (pruritus), פסוריאזיס, דלקת עור בעקבות חשיפה לקרינה מייננת (radiodermatitis) וויטיליגו. עשרה מחקרים דיווחו על שיפור מובהק סטטיסטית בחומרת המחלה בקבוצת הכורכום/כורכומין בהשוואה לקבוצת הביקורת(470).
סקירה (2013) בחנה האם יש טעם לטיפול בבעיות עוריות עם כורכום (Curcuma longa). מסקירה זו עולה כי כורכום יעיל לטיפול בכאב כרוני ובדלקתיות עורית וכי הוא מסייע להחלמת פצעים וזיהומים עוריים ולטיפול בדיספיגמנטציה(471).
מאמר סקירה (2015) המציג 22 צמחי מרפא אשר משמשים ברפואת הצמחים המסורתית ברחבי העולם לריפוי פצעים. במאמר מוצגת טבלה המסכמת את צמחי המרפא העיקריים הידועים בתרומתם לאיחוי פצעים, כולל שם הצמח ותיאור קצר, פירוט חלקי הצמח בהם נעשה שימוש, אופן השימוש, תופעות לוואי, מהו הבסיס המחקרי והשימוש המסחרי(472).
לגבי כורכום נכתב כי הוא בעל סגולות אנטי בקטריאליות, אנטי פטרייתיות, משככות כאב ונוגדות דלקת (כורכומנואידים מפחיתים ייצור פרוסטגלנדינים ומעכבים ייצור לויקוטריאנים על ידי עיכוב מסלול האנזים ליפואוקסיגנאז). הפעילות האנטי דלקתית ותכולת פרו-ויטמין A (בצורת בטא קרוטן) וחלבונים בכורכום מעודדים ייצור סיבי קולגן בדומה לפעילות פיברובלסטים.
מחקר פתוח (1992) בחן את יעילות משחה הכוללת את מיצוי הצמחים נים (Azadirachta indica) וכורכום בטיפול בגרדת (Scabies) בקרב 814 נבדקים. ב-97% מהמקרים הושגה החלמה מלאה בתוך שלושה עד 15 ימים. לא דווח על תופעות לוואי לא רצויות בעקבות הטיפול(473).
מחקר קליני השוואתי (2010) בחן את ההשפעה המשולבת של טיפולי אור (narrowband UVB phototherapy) עם משחת טטרה-הידרו-כורכומנואידית (נגזרת של כורכומנואידים המופקים מכורכום) בצורתו הליפוזומלית (במעטפת מיקרוסקופית של פוספטידיל כולין) על ויטיליגו בהשוואה לטיפולי אור לבדם(474). עשרה נבדקים (בני 18 ומעלה) עם ויטיליגו מפושט או מוקדי טופלו בו זמנית באזורי עור שונים בטיפול המשולב או בטיפול אור בלבד במשך 12 שבועות (טיפולי האור התבצעו פעמיים בשבוע). בתום ההתערבות, נצפתה פיגמנטציה מחודשת מובהקת סטטיסטית בהשוואה למצב הבסיס בעקבות הטיפול המשולב והטיפול באור לבדו (p=0.001 ו-p=0.006 בהתאמה), עם זאת לא נצפה יתרון לטיפול המשולב במשחה על פני טיפול האור לבדו (p=0.158).
רופא עור אמריקני דיווח על שורה של תיאורי מקרה (2010) שבהם טופלו נגעי עור שונים בג'ל כורכומין במריחה חיצונית. ראשית, 647 חולי פסוריאזיס טופלו חיצונית בג'ל אלכוהולי המכיל כורכומין (בריכוז 1%) במשך 16 שבועות(475). כל הנבדקים טופלו במשחה סטרואידית ובטיפול נגד זיהומים והונחו להימנע מגורמים מחמירים (לא פורטו). שיעור ההצלחה בטיפול בנגעים היה 70%. כמו כן, טיפול בג'ל כורכומין בלבד בריכוז גבוה יותר (ריכוז לא צוין) בקרב 220 נבדקים לאחר ניתוח מנע או הפחית משמעותית היווצרות צלקות לאחר ניתוח. תצפיות נוספות עם ג'ל הכורכומין כללו הפחתה של דלקת והצטלקות בנפגעי כוויות וצריבות, יחד עם ריפוי מואץ ושיפור במרקם עור שנפגע על ידי קרינה לאחר שימוש של 3-6 חודשים לפחות. כורכומין במריחה חיצונית נמצא אף יעיל בהפחתת אדמומיות וטלנגיאקטזיה (התרחבות כלי דם ומראה קורי עכביש) שמקורה בקרינת השמש במקרי רגישות לקרינה ורוזציאה. לבסוף, ריפוי הושג במקרים של נגעי עור טרום סרטניים כתוצאה מחשיפה לשמש: קרנת עור אקטוזית (actinic keratosis) וכתמי שמש (solar lentigo).
פסוֹריאזיס
מחקר קליני לא מבוקר (2008) בחן את יעילות הנטילה הפומית של תוסף כורכומנואידים (Curcuminoid C3 complex) בטיפול בפסוריאזיס בינוני עד חמור. 12 נבדקים (בני 18 ומעלה) הסובלים מפסוריאזיס רובדי (Plaque psoriasis) ב-6% לפחות משטח הגוף עם עובי רובד בינוני (ציון 2 במדד PSAI) נטלו תוסף שהכיל תמצית תקנית של כורכומנואידים (מתוקננת להכיל 95% כורכומנואידים לפחות) במינון 4.5 גרם ליום במשך 12 שבועות, ולאחר מכן בוצע מעקב אחר הנבדקים במשך ארבעה שבועות. שמונה נבדקים השלימו את ההתערבות והמעקב. מתוכם שניים הגיבו לטיפול (שיעור הצלחה של 16.7%) בצמצום שטח הנגע והפחתה בחומרתו (75% שיפור במדד PSAI) והיתר לא הגיבו. כמו כן, בקרב שני הנבדקים הללו דווחו על שיפור באיכות החיים (ירידה של 16 נקודות במדד Skindex שפירושה שיפור) ואילו ששת הנבדקים הנותרים דיווחו על החמרה (עליה של 2.5 נקודות במדד Skindex שפירושה החמרה)(476).
מחקר קליני(477) (2015) אקראי כפול סמיות ומבוקר פלסבו בחן את יעילות כורכומין (Meriva) בטיפול בפסוריאזיס. 63 נבדקים הסובלים מפסוריאזיס בדרגה קלה עד בינונית (PASI<10) חולקו אקראית לטיפול בתוסף כורכומין עטוף בפוספוליפיד במבנה פיטוזומלי (כורכומין ופוספטידיל כולין ביחס 1:2) במינון 2 גרם ליום או פלסבו במשך 12 שבועות. כל הנבדקים טופלו בנוסף בטיפול מקומי במשחה סטרואידית. בתום ההתערבות נצפתה ירידה מובהקת במדד המחלה (PASI) בשתי הקבוצות (p<0.05), אך ירידה זו היתה גדולה יותר במובהק בקבוצת הכורכומין בהשוואה לפלסבו (p<0.05). כמו כן, נטילת כורכומין הפחיתה במובהק את רמת הציטוקין הדלקתי IL-22 בסרום של הנבדקים בהשוואה למצב הבסיס (p<0.001) ולקבוצת הפלסבו (p<0.05), אך לא השפיעה על רמת הציטוקין הדלקתי IL-17י(p>0.05).
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2018) בחן את יעילות תכשיר כורכום למריחה חיצונית בטיפול בפסוריאזיס בקרקפת. 40 נבדקים בריאים (טווח גילאים 18-75) הסובלים מפסוריאזיס בקרקפת בדרגה קלה עד בינונית שאובחן על ידי דרמטולוג והפסיקו ליטול תרופות לפסוריאזיס חודש לפני ההתערבות או תכשירים לשימוש חיצוני שבועיים לפני ההתערבות השתתפו במחקר. הנבדקים חולקו אקראית לקבלת תכשיר כורכום (turmeric tonic, סוג לא צוין) או פלסבו למריחה על הקרקפת פעמיים ביום במשך תשעה שבועות, ולאחר מכן נערך מעקב אחר הנבדקים במשך ארבעה שבועות מתום ההתערבות. 30 נבדקים (יחס נשים/גברים 70/30) השלימו את ההתערבות ואת תקופת המעקב. שני נבדקים מקבוצת הפלסבו התלוננו על יובש של הנגעים ושמונה נבדקים לא הגיעו לפגישות המעקב. בתום ההתערבות נמצא כי תכשיר הכורכום היה יעיל יותר במובהק בהשוואה לפלסבו בהפחתת חומרת הנגעים לפי מדד PASI המעריך את שטח הגוף המעורב בשילוב חומרת הקשקשת, האודם ועובי הרבדים (Psoriasis area and severity index, p<0.05) וכן יעיל יותר במובהק בשיפור איכות החיים של הנבדקים לפי מדד DLQI המורכב משאלון הבודק את הפגיעה באיכות חייו של המטופל (Dermatology life quality index, p<0.05). הטיפול באמצעות תכשיר הכורכום נסבל היטב ולא דווח על תופעות לוואי לא רצויות(478).
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2015) בחן את יעילות מיקרואמולג'ל כורכום למריחה מקומית בטיפול בפסוריאזיס רובדי (plaque psoriasis). במחקר, 34 נבדקים הסובלים מנגעים קלים עד בינוניים מרחו אקראית מיצוי הידרו אלכוהולי של כורכום בצורת מיקרואמולג'ל בריכוז 0.5% או פלסבו על נגעי פסוריאזיס בצד ימין או בשמאל. בתום ההתערבות נצפה שיפור מובהק בחומרת המחלה (לפי מדד PASI) ובאיכות החיים הקשורה במחלה (לפי מדד DLQI) בעקבות הטיפול המקומי בכורכום בהשוואה לפלסבו (p<0.05). בסיכום, 85% מהנבדקים היו מרוצים מן הטיפול, אך 6% דיווחו על יובש באזור הנגעים, 6% נוספים דיווחו על תחושת שריפה ו-3% דיווחו על גירוי בעור(479).
מחקר קליני פתוח (2000) בחן השְפעת טיפול מקומי באמצעות ג'ל כורכומין או משחה המכילה נגזרת של ויטמין D על רמות האנזים פוספורילאז קינאז (PHK) בדמם של חולי פסוריאזיס. האנזים פוספורילאז קינאז אחראי על כמה מסלולי איתות המעורבים בנדידת תאים ושגשוגם כמו גם בפירוק הגליקוגן הנחוץ כמקור אנרגיה לתהליך המואץ של חלוקת התאים בפסוריאזיס. קיים מתאם בין פעילות מוגברת של האנזים ובין מחלה פעילה. במחקר נכללו 40 נבדקים ששלושים מהם חולי פסוריאזיס שאינם מטופלים תרופתית ועשרה מהם נבדקים בריאים ללא פסוריאזיס. 30 חולי הפסוריאזיס חולקו לשלוש קבוצות: קבוצה ראשונה לא טופלה, קבוצה שניה טופלה חיצונית בג'ל אלכוהולי המכיל כורכומין (בריכוז 1%) וקבוצה שלישית טופלו במשחה המכילה נגזרת של ויטמין D בשם Calcipotriol. רמת האנזים פוספורילאז קינאז היתה הגבוהה ביותר בקבוצת החולים במחלה פעילה שלא טופלו. בשתי קבוצות הטיפול הודגם שיפור במצב הנגעים לפי מדדים קליניים, היסטולוגיים ומעבדתיים בהשוואה לנבדקים החולים שלא טופלו, כמו גם ירידה מובהקת ברמות האנזים פוספורילאז קינאז (p<0.0001), כמעט עד לרמתו בדמם של נבדקים בריאים. מסקנת החוקרים היתה שכורכומין בדומה לויטמין D יעיל לטיפול בפסוריאזיס דרך עיכוב האנזים פוספורילאז קינאז(480).
ילפת שטוחה (ליכן פלנוס)
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2012) בחן את יעילות הטיפול בילפת שטוחה ברירית הפה (Oral Lichen planus) באמצעות תוסף כורכומנואידים. ילפת שטוחה היא מחלה דלקתית (ככל הנראה ממקור אוטואימוני) התוקפת את העור, ריריות הפה והציפורניים ומתבטאת בהופעת קשקשת, אדמומיות, כיבים וגרד. 20 נבדקים חולי ילפת שטוחה טופלו בתוסף כורכומנואידים (סוג המיצוי וריכוזו אינם ידועים) במינון 6 גרם ליום או פלסבו במשך שבועיים. בתום ההתערבות נצפה יתרון מובהק לטיפול באמצעות כורכומנואידים על פני פלסבו בשיפור תסמיני המחלה ומדדיה (p=0.02-0.05). לא דווח על תופעות לוואי לא רצויות בעקבות הטיפול(481).
במחקר קודם של אותם החוקרים, אף הוא מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2007) 33 נבדקים הסובלים מילפת שטוחה ברירית הפה חולקו אקראית לנטילת פלסבו או תוסף כורכומנואידים (סוג המיצוי וריכוזו אינם ידועים) במינון 2 גרם ליום במשך 7 שבועות בנוסף לטיפול בתרופה פרדניזון במינון 60 מ"ג ליום במהלך השבוע הראשון. בתום ההתערבות לא נצפה יתרון לטיפול באמצעות כורכומנואידים על פני פלסבו בשיפור תסמיני המחלה. עם זאת, לטענת החוקרים יתכן שהטיפול התרופתי מיסך את השפעות הטיפול הצמחי(482).
מנגנוני פעולה
כורכומין מגן מפני נזקי קרינה על ידי עיכוב האנזים Phosphorylase kinase המוביל לעיכוב מסלולי הקינאזים MAPK (p38, JNK and ERK1/2), IκBα kinase, Akt, ועל ידי כך לעיכוב מסלולי גורמי השעתוק NFkB ו-AP-1 המשרים שעתוק גנים (לרבות ציטוקינים, אנזימים וגורמי גידול פרו דלקתיים) המעודדים שגשוג, נדידה והשתנות תאים, עיכוב אפופטוזיס והתפתחות גרורות(262,475).
פעילות מוגברת של האנזים Phosphorylase kinase אופיינית גם לפתוגנזה של פסוריאזיס המערבת שגשוג יתר של קרטינוציטים, פירוק גליקוגן, עיכוב אפופטוזיס, ותגובת יתר חיסונית של מערכת החיסון המולדת (בעיקר תאים דנדריטים) ומערכת החיסון הנרכשת (זרועות חיסון Th1 ו-Th17). כורכומין מעכב את פעילות האנזים בעיכוב לא תחרותי סלקטיבי(483-484). קיים מתאם בין פעילות מופחתת של האנזים ובין הפחתה בפעילות המחלה(480).
כורכומין מפחית ביטוי של ציטוקינים דלקתיים TNFɑ, INFɣ, IL-1β, IL-17, IL-22, IL-23, IL-12, וגורמי גידול TGFβ המעודדים שגשוג והתמיינות יתר של קרטינוציטים דרך עיכוב הפעלה של קולטני שער TLR על תאים חיסוניים במערכת החיסון המולדת ועיכוב מסלולי השעתוק של NFkB, AP-1 ו-STAT3. עיכוב מסלול השעתוק של NFkB אף מעודד אפופטוזיס ומשפר את המאזן שבין אפופטוזיס לשגשוג יתר של התאים(485).
בנוסף, כורכומין(486) מפחית שגשוג של תאי T והפרשה של ציטוקינים דלקתיים (IL-17, IL-22, IFNɣ, IL-2,IL-12, IL-23 ו-TNFɑ) על ידי עיכוב תעלות אשלגן מסוג Kv1.3 המבוטאות בעיקר בתאי T.
כורכומין מסייע לריפוי פצעים דרך פעילות נוגדת דלקת ופעילות אנטי מיקרוביאלית. כמו כן, כורכומין מעודד ייצור רקמת גרעון ואפיתליזציה, ומעודד ייצור ושקיעה של סיבי קולגן במשתית הבין תאית, עיצוב מחדש של הרקמה וכיווץ הפצע על ידי עידוד נדידה והפעלה של פיברובלסטים(472,487).
השפעה על מערכת המין הנשית
הקדמה | מחקרים קליניים | מנגנוני פעולה
הקדמה
שני מחקרים מצביעים על יעילות כורכומין בהקלה על תסמינים קדם-וסתיים בהיבט הפיסי, הנפשי וההתנהגותי. יעילות הצמח מתבססת על השפעותיו נוגדות העווית, הדלקת והכאב (בשל יכולתו לעכב ייצור והפרשה של פרוסטגלנדינים), ועל יכולתו למנוע הפחתה בזמינותם של מתווכים עצביים (סרוטונין, דופמין ונוראדרנלין) בתגובה לתנודות אסטרוגן. כמו כן, מחקרים פרה קליניים מעידים על פעילות פיטואסטרוגנית אפשרית של כורכומין, חלשה פי 103 ביחס לאסטרוגן אנדוגני, כך שבעת קשירה לקולטני אסטרוגן שעל תאי סרטן השד ועל תאי רירית רחם אקטופיים באנדומטריוזיס, כורכומין מפחית את שגשוג התאים. סקירה הבוחנת את המחקרים הפרה-קליניים בנוגע ליעילות כורכומין בטיפול באנדומטריוזיס מצביעה על הפוטנציאל הקליני של הצמח בטיפול במחלה הודות לפעילותו נוגדת החמצון והדלקת, נוגדת שגשוג התאים ומשרת האפופטוזיס ונוגדת פלישת תאים ואנגיוגנזה.
מחקרים קליניים
מחקר קליני (יוני 2015) אקראי כפול-סמיות ומבוקר פלסבו בחן את היעילות של כורכומין להקלה על תסמינים קדם-וסתיים (PMS). במחקר השתתפו 70 נשים (טווח גילאים 18-34) אשר חולקו באופן אקראי לקבלת אבקת כורכומין (סוג מיצוי לא צוין) או פלסבו במינון של 200 מ"ג ליום למשך 7 ימים לפני הווסת ו-3 ימים לאחר תחילת הווסת, במשך 3 מחזורי ווסת. הנשים התבקשו לדרג את חומרת התסמינים באופן יום-יומי. בתום המחקר נמצא כי בקרב נשים שנטלו אבקת כורכומין רמת התסמינים הכללית (מכלול התסמינים הפיסיים, הנפשיים וההתנהגותיים) ירדה באופן מובהק מ-102.06 ל-42.47 (p<0.0001) לעומת ירידה לא מובהקת מ-106.06 ל-91.60 בקבוצת הפלסבו (p=0.058). החוקרים מציעים כי היעילות של כורכומין להפחתת תסמיני PMS קשורה בפעילותו האנטי-דלקתית (עיכוב האנזים הפרו דלקתי Cox2) ובהשפּעתו על מתווכים עצביים (העלאת רמות סרוטונין, דופמין ונוראדרנלין במוח)(488).
מחקר קליני (מרץ 2014) אקראי כפול סמיות ומבוקר פלסבו בחן את השְפעת הנטילה של כורכומין על רמת הגורם הנוירוטרופי המוחי (BDNF) במהלך השלב הלוטיאלי של נשים הסובלות מתסמונת קדם וסתית (PMS). שינויים ברמות הגורם הנוירוטרופי המוחי בשלב זה בקרב נשים הסובלות מ-PMS נחשדו כגורמים לחלק מהשינויים הפסיכולוגים הפסיכולוגיים והסומטיים האופייניים לתסמונת. 70 נבדקות הסובלות מ-PMS חולקו אקראית לנטילת כורכומין (סוג מיצוי לא צוין) או פלסבו במהלך שלושה מחזורי וסת למשך עשרה ימים בכל פעם (שבעה ימים לפני הופעת הוסת עד שלושה ימים לאחר תחילת הדימום). בתום ההתערבות נמצא כי כורכומין העלה במובהק את רמת הגורם הנוירוטרופי המוחי בדמן של הנבדקות והפחית במובהק את תסמיני ה-PMS לפי דיווחן. מסקנת החוקרים היתה שכורכומין יעיל בהקלה על תסמיני התסמונת הקדם וסתית, בין היתר דרך השפעה על רמת הגורם הנוירוטרופי המוחי(489).
מנגנוני פעולה
כללי | תִסמונת קדם וִסתִית | אנדוֹמטריוזיס
השפעה פיטואסטרוגנית – כללי
בשני מחקרי מעבדה נבחנה השְפעת כורכומין על שורות תאים רגישים לאסטרוגן: תאי סרטן השד(490) ותאי משתית (סטרומה) ואפיתל רירית רחם אקטופיים (מחוץ לרחם) באנדומטריוזיס(491). משני המחקרים עולה כי לכורכומין השפעה פיטואסטרוגנית חלשה פי 103 בהשוואה לאסטרוגן אנדוגני, וכשכורכומין נקשר לקולטני אסטרוגן שעל התאים הוא מעכב את שגשוגם, ככל הנראה במנגנון תחרותי עם האסטרוגן האנדוגני על אתרי הקשירה. עם זאת, לא קיימים מחקרי בעלי חיים ומחקרים קליניים בנושא ולכן לא ברורה הרלוונטיות הקלינית של ממצאים אלה.
תִסמונת קדם וִסתִית
מנגנון הפעולה המשוער של כורכומין בהקלה על תסמיני התסמונת הקדם וסתית מתייחס לשני היבטים של התסמונת:
1. ההיבט הפיסי – רמות גבוהות של פרוסטגלנדינים המעודדים התכווצויות בטניות, שינויים ביציאות, כאב ורגישות בחזה וכאבי ראש.
2. ההיבט הנפשי – ירידה ברמות הנוירוטרנסמיטורים סרוטונין, נוראדרנלין ודופמין כתוצאה מהירידה באסטרוגן. אלה מתבטאים בשינויים במצבי רוח, קושי להתרכז ועייפות כללית.
כורכומין מסייע לשני ההיבטים של התסמונת על ידי:
1. פעילות נוגדת דלקת – עיכוב פעילות האנזים COX2 והפחתה בייצור PGE2 המקושר להתבטאות סוערת יותר של ההיבטים הפיסיים של התסמונת(488).
2. העלאת רמות הנוירוטרנסמיטרים סרוטונין, דופמין ונוראדרנלין (להרחבה ראו סעיף דיכאון, כאן) והעלאת רמות גורם נוירוטרופי מוחי (BDNF) התורם בעקיפין לשמירה על רמות הנוירוטרנסמיטרים במערכת העצבים המרכזית ולהולכה עצבית תקינה(489).
אנדוֹמטריוזיס
סקירה (ינואר 2018) מציגה את העדויות המחקריות ממחקרי בעלי חיים ומחקרי מעבדה ואת מנגנוני הפעולה שלכורכום וכורכומין הרלוונטיים לטיפול באנדומטריוזיס(492). מנגנוני הפעולה המצויינים הם: עיכוב שגשוג תאים (הפחתת ביטוי גורמי גידול EGF, (HER-2, FGF, VEGF, PDGF, IGF-1 והשריית אפופטוזיס (העלאת ביטוי החלבון מעודד האפופטוזיס p53, השריית אפופטוזיס מיטוכונדריאלי, שיפור יחס האנזימים מווסתי האפופטוזיס Bax/Bcl2, השריית ביטוי האנזים מפרק התא caspase-9), מניעת אנגיוגנזה (הפחתת ביטוי גורמי גידול VEGF, HIF-1α, PDGF-βR), פעילות נוגדת דלקת (עיכוב מסלול גורמי שעתוק פרו דלקתיים NFkB, AP-1, הפחתת ביטוי האנזים COX2, הפחתת ביטוי ציטוקינים דלקתיים IL-1, IL-6, IL-8, TGF-β, TNFɑ), פעילות נוגדת חמצון (הגברת פעילות אנזימים נוגדי חמצון אנדוגניים דרך הפעלת מנגנון Nrf2, הפחתת ROS וחמצון שומנים), ועיכוב פלישה והצמדות תאים (הפחתת ביטוי אנזימים מפרקי מטריקס בין תאי MMP-2,3,9, הפחתת ביטוי מולקולות הצמדות תאים ICAM-1, VCAM-1).
בטא תלסמיה
הקדמה | מחקרים קליניים | מנגנוני פעולה
הקדמה
שני מחקרים קליניים שנערכו בקרב חולי בטא תלסמיה מייג'ור ומינור מלמדים על יעילות מסוימת של כורכום ורכיביו בספיחת עודפי ברזל ופינויים, ובהפחתת העקה החמצונית הנובעת מהפרעות במשק הברזל. עם זאת, בשל בעיות מתודולוגיות בתכנון המחקר (גודל מדגם קטן, העדר אקראיות ובקרה) לא ניתן לקבוע בוודאות כי כורכום אכן יעיל לטיפול במחלה ונחוצים לשם כך מחקרים קליניים נוספים.
מחקרים קליניים
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו (2018) בחן את השְפעת כורכומין על עודפי ברזל, על רמות הפסידין* ועל תפקודי הכבד בקרב חולי בטא תלסמיה מייג'ור. 68 נבדקים (טווח גילאים 18-40) הסובלים מבטא תלסמיה מייג'ור ונוטלים את התרופה deferoxamine באופן קבוע או מטופלים בקביעות בעירויי דם כדי לשמר את רמות ההמוגלובין בסרום מעל 9.5 מ"ג/דציליטר חולקו אקראית לקבלת תוסף כורומין (סוג לא צוין) במינון 1000 מ"ג ליום או פלסבו במשך 12 שבועות. 61 נבדקים השלימו את ההתערבות. נמצא כי נטילת כורכומין הפחיתה במובהק את כמות הברזל החופשי בסרום שאינו קשור בטרנספרין (p=0.001), ואת רמות אנזימי הכבד המעידים על פגיעה כבדית (ALT p=0.018, AST p=0.002) בהשוואה למצב הבסיס. כמו כן, נטילת כורכומין הפחיתה במובהק את רמות המדדים הללו בהשוואה לפלסבו (ברזל לא קשור בטרנספרין p=0.026, ALT p=0.004, AST p=0.009). לא נצפה שינוי מובהק ברמת ההפסידין ובשאר המדדים שנבדקו (המוגלובין, פריטין, רווי של טרנספרין, TIBC מדד לכושר הקשירה הכללי של ברזל) בשתי הקבוצות. מסקנת החוקרים היא שהטיפול באמצעות כורכומין מפחית את עומסי הברזל ואת הליקויים בתפקודי הכבד על ידי הפחתת רמות הברזל החופשי ורמות אנזימי הכבד בסרום בקרב חולי בטא תלסמיה מייג'ור(493).
* חלבון המאזן את רמת הברזל בגוף על ידי ויסות קליטת הברזל במעי, הקטנת שחרור ברזל ממאגרי הכבד ומניעת שחרור ברזל ממקרופג'ים.
מחקר קליני לא מבוקר (2010) בחן את יעילות תוסף כורכומנואידים לטיפול בעקה חמצונית בחולי בטא תלסמיה מינור/המוגלובין E (המוגלובין עם פגם גנטי בשרשרת בטא). 21 נבדקים בני 15-45 הלוקים בתסמונת נטלו תוסף כורכומנואידים (המכיל כורכומין, DMC ו-BDMC ביחס של 1:0.3:0.1 בהתאמה) במינון 500 מ"ג ליום במשך שנים עשר חודשים. נמצא כי מתן כורכומנואידים הפחית את העקה החמצונית בעקבות התסמונת: רמת המטהמוגלובין (צורת המוגלובין שאינה מוסרת חמצן ביעילות) אך לא רמת ההמוגלובין התקין בכדוריות הדם האדומות פחתה במובהק בעקבות הטיפול בהשוואה למצב הבסיס (p<0.05), כך גם רמות המלונדהידים בכדוריות הדם האדומות (p<0.001), והפעילות המוגברת של האנזימים נוגדי החמצון האנדוגניים (סופראוקסיד דיסמוטאז, גלוטטיון פרוקסידאז, p<0.001), ולעומת זאת חלה עליה בריכוז הגלוטטיון בכדוריות הדם האדומות (p<0.05). רמת הברזל החופשי בסרום ירדה במובהק כעבור שישה חודשי טיפול (p<0.05) אך חזרה ועלתה לרמתה המקורית עד תום השנה, במקביל לא חל שינוי ברמת הפריטין בסרום. שלושה חודשים לאחר תום ההתערבות כל המדדים חזרו כמעט לקדמותם. לכורכומנואידים לא היתה השפעה על תפקודי הכבד והכליות ועל פרופיל השומנים של הנבדקים. החוקרים הסיקו מכך כי כורכומנואידים עשויים לנטרל עקה חמצונית בעקבות בטא תלסמיה, אך נדרשים מחקרים מבוקרים נוספים כדי להוכיח שהשיפור במדדים מתבטא גם בשיפור בתסמינים(494).
מנגנוני פעולה
הרכיבים הכורכומנואידים יעילים לטיפול בעקה חמצונית הנגרמת כתוצאה מבטא תלסמיה הודות לפעילות נוגדת חמצון: נטרול רדיקלים חופשיים הגברת ייצור גלוטטיון בתאים והגברת ביטוי של אנזימים נוגדי חמצון אנדוגניים דרך הגברת ביטוי גורם השעתוק Nrf2. כורכומנואידים אף מסייעים בהפחתת עודפי הברזל המגבירים עקה חמצונית (משרים עליית ROS) הודות לכושר הקשירה והספיחה של ברזל: כורכומין נקשר ליוני Fe3+, כורכומין אף מעלה את ביטוי של חלבונים המווסתים את משק הברזל התאי Iron regulatory proteins ושל הקולטן לטרנספרין transferrin receptor 1 ועל ידי כך מסייע בשינוע עודפי הברזל מהתאים(494).
מחלות ריאה
הקדמה
נכון לזמן זה (דצמבר 2017) אין מחקרים קליניים העוסקים בטיפול באמצעות כורכום או כורכומין במחלות ריאה. עם זאת, בשלל מחקרים פרה-קליניים הודגמה יעילות של הצמח בטיפול בדלקות ריאה כרוניות על רקע אסתמה ו-COPD הודות לפעילות נוגדת דלקת, מווסתת חיסון, נוגדת חמצון ונוגדת לייפת (פיברוזיס) של כורכום.
מנגנוני פעולה
סקירה (ינואר 2016) מציגה את העדויות ממחקרים פרה-קליניים בנוגע להשפעה האנטי-דלקתית של רכיבים טבעיים וצמחיים בהתייחס ל-3 מחלות ריאה עם בסיס דלקתי: תסמונת מצוקה נשימתית חדה (ARDS), אסתמה ומחלת ריאות נשימתית כרונית (COPD). דלקתיות בריאות מערבת הפעלה של תאי דלקת כגון מקרופג'ים, לימפוציטים, נויטרופילים ואאוזוניפולים, ואלה אחראיים לייצור והפרשה של מתווכי דלקת שונים כגון היסטמין, TNFΑ, אינטרלוקינים IL-1 בטא, IL-4, IL-5 ו-IL-6, פרוסטגלנדינים, לויקוטריאנים וניטריק אוקסיד. הביטוי התסמיני של תהליכים דלקתיים אלו הוא ירידה בתפקוד הריאות, תגובתיות יתר וחסימה של דרכי האוויר, בצקות, הפרשת יתר של ריר ועיצוב מחדש (remodeling) של הריאה(495).
כורכומין מעכב הפעלה של מסלול האיתות Notch1/2 ומפחית את ביטוי גורם השעתוק GATA3 המעורבים בהתמיינות תאי T מסייעים בכיוון דומיננטיות של זרוע החיסון Th2 (זרוע החיסון ההמורלית)(495).
כורכומין מעכב את מסלול גורם השעתוק NFkB, מפחית את הביטוי של האנזימים cox2 ו-5-lox וייצור של פרוסטגלנדינים ולויקוטריאנים, וכן מפחית ייצור והפרשה של נוגדני IgG, ומעכב הפעלה של תאי פיטום והפרשת היסטמין, המעורבים בההסננת תאי הדלקת לברונכוסים ,עיבוי של השרירים החלקים בברונכוסים והפרשת ריר מוגברת(260). כמו כן, כורכומין מעכב הפעלה של לימפוציטים, נויטרופילים ומקרופג'ים על ידי ויסות ציטוקינים דלקתיים והגברת ציטוקינים נוגדי דלקת: הפחתת IL-1, IL-5,IL-6, IL-8, TNFα והגברת IL-10, ומפחית ביטוי של מולקולות הצמדות (ICAM-1).
כורכומין מפחית עקה חמצונית בריאות על ידי עיכוב האנזים ניטריק אוקסיד סינתאז, ועל ידי הגברת פעילות אנזימים נוגדי חמצון אנדוגניים (Superoxide dismutase, Catalase, glutathione peroxidase) דרך הפעלת מסלול האיתות של חלבון Nrf2 והגברת ביטוי גנים של חלבונים המשתייכים למערך ההגנה(260) מפני עקה חמצונית בתאים (Heme oxygenase 1).
לבסוף, כורכומין מפחית הרס של רקמות הריאה ויצירה של רקמה צלקתית (פיברוזיס) על ידי עיכוב מסלול NFkB, עיכוב ביטוי של אנזימים מפרקי מטריקס בין תאי (MMP-2, MMP-9) והגברה של מעכבי מטלופרוטאינאזות ברקמות (TIMPs), עיכוב גורם הגידול TGF-β1 המעודד התמיינות של פיברובלסטים(260), והעלאת ביטוי של אנזימים מפרקי קולגן ואלסטין (cathepsin K and L).
נזלת אלרגִית
מחקר קליני אקראי כפול סמיות ומבוקר פלסבו בחן את יעילות כורכומין בטיפול בנזלת אלרגית. 241 נבדקים הסובלים מנזלת אלרגית (ריניטיס) חולקו אקראית לנטילת כורכומין (סוג ומינון אינם ידועים) או פלסבו למשך חודשיים. בתום ההתערבות נמצא שכורכומין היה יעיל יותר במובהק מפלסבו בהפחתת התסמינים (נזלת והתעטשויות) והגודש באף (התנגדות בזרימת האוויר). כמו כן, נמצא שכורכומין עיכב במובהק את ייצור הציטוקינים הדלקתיים TNFɑ, IL-4 ו-IL-8 בתאים מונונוקליארים והגביר את ייצור הציטוקין נוגד הדלקת IL-10 ומולקולות הצמדות לתאים חיסוניים. עם זאת, לכורכומין לא הייתה השפעה על שחרור פרוסטגלנדין E2 ולויקוטריאן C4 מתאים נויטרופילים. פרטים נוספים אינם ידועים היות שהמאמר המלא אינו נגיש לקריאה(496).
מחלות זיהומִיות
הקדמה | מחקרים קליניים | מנגנוני פעולה
הקדמה
מספר לא מבוטל של מחקרי בעלי חיים ומחקרי מעבדה מלמד על פעילות אנטי מיקרוביאלית רחבה של כורכום כנגד שלל חיידקים, וירוסים, פטריות וטפילים. כורכומין משרה עקה חמצונית בסביבת הפתוגנים, מעכב את גדילתם והתרבותם, ופוגע במערכות ההגנה והתקשורת שלהם. מספר המחקרים הקליניים העוסקים ביעילות כורכום וכורכומין בטיפול במחלות זיהומיות הוא זעום. מלבד יעילות כורכום בשימוש חיצוני בטיפול בדלקות חניכיים שלה הקצנו סעיף נפרד (ראו כאן), מצאנו רק מחקר אחד העוסק בטיפול באמצעות כורכומין בשילוב עם רכיבים נוספים (Serenoa serrulata, Urtica dioica, קוורצטין) בדלקת חיידקית כרונית של הערמונית. במחקר זה הטיפול הצמחי הדגים יעילות מובהקת מול הטיפול האנטיביוטי בשיפור התסמינים ובשיפור איכות החיים של הנבדקים, אך לא ניתן ליחסה להשפעה בלעדית של הכורכום. בנוסף, שני מחקרים קליניים עסקו בפעילות האנטי נגיפית של הצמח: האחד בטיפול ב-HIV למשך שמונה שבועות בלבד אשר לא הדגים הפחתה בעומס הנגיפי אך מצא שיפור במצב הנבדקים לפי דיווחם. המחקר השני אשר בדק טיפול ב- HPV הדגים יעילות בשיפור התסמינים על ידי שימוש בקרם וגינלי המכיל כורכומין בשילוב עם צמחים נוספים, אך לא על ידי נטילה פומית של כמוסות כורכומין בהשוואה לפלסבו.
מחקרים קליניים
סקירה (נובמבר 2012) שבחנה את ההשפעות של כורכום (Curcuma longa) מצאה כי לצמח השפעה מטיבה על מחלות דלקתיות, בהן דלקת הערמונית חיידקית כרונית, וכי כורכום בטוח לשימוש במינון של עד 12 ג' ליום במשך שלושה חודשים(354).
מחקר פרוספקטיבי אקראי (ינואר 2009) בחן את ההשפעה של דקל ננסי (Serenoa repens), שורש סרפד (Urtica dioica), כורכומין וקוורציטין, לטיפול משולב עם ציפרופלוקסצין (תרופה אנטיביוטית ממשפחת הפלורוקינולונים) לטיפול בדלקת ערמונית חיידקית כרונית. 143 מטופלים הסובלים מדלקת ערמונית חיידקית במשך שלושה חודשים לפחות השתתפו במחקר, כולם קיבלו ציפרופלוקסצין במינון 600 מ"ג ליום במשך 14 יום. 37 נבדקים טופלו באנטיביוטיקה לבדה, ו-106 נבדקים בקבוצת ההתערבות בנוסף לטיפול האנטיביוטי נטלו את התוספים הצמחיים הבאים:
1. תוסף סרפד (ProstaMEV) שהכיל: תמצית תקנית של סרפד מתוקננת להכיל 30% חומצות שומן וסטרולים במינון 160 מ"ג ותמצית יבשה של סרפד (שהכילה 0.4% β-sitosterol) במינון 120 מ"ג.
2. תוסף כורכומין (FlogMEV) שהכיל: תמצית יבשה של כורכומין במינון 200 מ"ג משולב בתמצית יבשה של קוורצטין במינון 100 מ"ג.
חודש לאחר תחילת המחקר, בקבוצת הטיפול האנטיביוטי 27% מהמטופלים דיווחו על שיפור, לעומת 89.6% בקבוצת ההתערבות (p<0.0001). נמצא שיפור מבחינת התסמינים ואיכות החיים (לפי המדדים CPSI-NIH Chronic Prostatitis Symptom Index ו-IPSS-International Prostatic Symptom Score) בקבוצת ההתערבות בהשוואה לקבוצת הביקורת (p<0.0001 בשני המדדים). כעבור שישה חודשים בקבוצת הביקורת 2 אנשים סבלו מחזרת המחלה, בעוד בקבוצת ההתערבות כולם נותרו בריאים(129).
מחקר קליני אקראי לא מבוקר (1996) בחן את השְפעת כורכומין על תסמונת הכשל החיסוני הנרכש (AIDS). ארבעים נבדקים חולי איידס חולקו אקראית לנטילת מינון גבוה (2.5 גרם ליום) או נמוך (מינון לא ידוע) של כורכומין (סוג מיצוי לא ידוע) במשך שמונה שבועות. בתום ההתערבות לא נצפתה השפעה של הצמח על העומס הנגיפי של החולים ועל חוזק התגובה החיסונית שלהם (לפי רמות תאי ה-T מסוג CD4+). עם זאת, נטילת כורכומין היטיבה עם החולים לפי דיווחם, ומכאן שלכורכום יש השפעה מיטיבה לא ידועה על כשל חיסוני נרכש(497).
מחקר קליני אקראי מבוקר פלסבו (2013) בחן את יעילות הטיפול בזיהום HPV של צוואר הרחם באמצעות כורכומין בכמוסות לשימוש וגינלי או בקרם צמחי טיפולי המכיל כורכומין (BasantTM). הנבדקות (257) שאובחנו כסובלות מזיהום של וירוס הפפילומה בצוואר הרחם ללא שינויים נאופלסטיים, חולקו אקראית לארבע קבוצות התערבות. הקבוצה הראשונה טופלה בקרם צמחי למריחה וגינלית שהכיל מיצויים של כורכומין, Sapindus mukorossi, Emblica officinalis ו-Aloe vera, הקבוצה השניה טופלה בקרם למריחה וגינלית שהכיל פלסבו, הקבוצה השלישית טופלה בכמוסות כורכומין לשימוש וגינלי והקבוצה הרביעית טופלה בכמוסות פלסבו במשך שלושים ימים מלבד בימי דימום הוסת. כשבוע מתום ההתערבות, שיעור ההחלמה מהנגיף בעקבות השימוש בקרם הצמחי (87.7%) היה גבוה במובהק בהשוואה לשיעור ההחלמה מהנגיף בשתי קבוצות הפלסבו יחדיו (73.3%)(p=0.03). שיעור ההחלמה מהנגיף בקבוצת תוסף הכורכומין (81.3%) היה גבוה בהשוואה לשתי קבוצות הפלסבו, אך ללא מובהקות סטטיסטית (p=0.08). בקבוצת הקרם הצמחי דווחו הנבדקות על גירוי וגירודים מקומיים באזור המריחה, לרוב בעוצמה קלה עד בינונית(498).
מנגנוני פעולה
כללי | פעילות אנטי נגיפית | פעילות נוגדת פטריות
כללי
במספר רב של מחקרי בעלי חיים ובמעבדה הדגים כורכומין פעילות נגד מגוון רחב של פתוגנים - חיידקים, וירוסים, פטריות וטפילים.
פעילות אנטי חיידקית: מיצויים שונים של כורכום וכורכומין הדגימו יעילות בעיכוב גדילה והתחלקות של שלל חיידקי גראם חיובי ושלילי(128):
Aeromonas hydrophila, Bacillus subtilis, B. coagulans, B. cereus, Edwardsiella tarda, Escherichia coli, Helicobacter pylori, Klebsiella pneumoniae, Listeria monocytogenes, Pseudomonas eruginosa, Salmonella typhimurium, Staphylococcus aureus, Staph. intermedius, Staph. epidermidis, Streptococcus agalactiae, Vibrio harveyi, V. alginolyticus, Vibrio cholerae, V. parahaemolyticus, V. vulnificus
מנגנון הפעולה המשוער של כורכומין הוא פגיעה בשלמות הממברנה החיידקית והגברת חדירותה, וקישור לחלבון FtsZ, היוצר את השלד המבני הנחוץ לחלוקת התא החיידקי(127).
בנוסף, כורכומין מעכב יצירת ביופילם חיידקי (חיידקים המאורגנים במבנה קרומי רב תאי הנוצר לרוב על משטח מוקף בנוזל). זהו מנגנון חיידקי המייצר עמידות בפני מערכת החיסון ובפני תרופות קונבנציונליות כגון סוגי אנטיביוטיקה שונים(500-504). מנגנון הפעולה המשוער של כורכומין הוא שיבוש התקשורת הבין חיידקית (quorum sensing).
פעילות אנטי נגיפית:
בתנאי מעבדה(128,505-506) מיצויים של כורכומין ונגזרות של כורכומין הדגימו עיכוב משמעותי של שכפול נגיפים כגון וירוס השפּעת, HIV, HPV, adenovirus, coxsackievirus והפטיטיס C.
במחקר שנערך על עכברות(507) שהודבקו בהרפס סימפלקס גניטלי (HSV-2), טיפול מקדים באמצעות כורכומין במריחה מקומית מנע במובהק את התפרצות המחלה (p<0.05)
במחקר מעבדה(508), כורכומין הגן על תאי אפיתל גניטליים מפני חדירה והתרבות של וירוס ה-HIV וה-HSV-2 על ידי כך שמנע פגיעה בחלבונים של צומתי החסימה ברקמת האפיתל (ZO-1, Occludin) ומנע עליה של ציטוקינים דלקתיים הפוגעים בשלמות המחסום האפיתלי של רירית אברי המין.
במעבדה, כורכומין ונגזרותיו הדגימו פעילות מעכבת של האנזימים פרוטאז ואינטגרז בוירוס ה- HIV, וכן עיכוב של החלבון המווסת את שעתוק הנגיף (transactivation regulatory protein) HIV-1 TAT ועל ידי כך מנעו את שכפול הנגיף ואת חדירתו ל-DNA של התא המארח(509-510).
בדומה לכך, במעבדה(511), כורכומין לא מנע את חדירת נגיף ההרפס סימפלקס מסוג 1 (HSV-1) לתא המארח, אך פגע במובהק בכושר השכפול של הנגיף על ידי פגיעה ביכולתו לגייס את פקטור השעתוק RNA-polymerase II.
פעילות נוגדת פטריות
במחקרי בעלי חיים ובמעבדה, מיצויים שונים של כורכום וכורכומין הדגימו פעילות אנטי פטרייתית כנגד שלל פטריות ועובשים, כולל זנים עמידים לטיפול תרופתי(135):
Aspergillius, Candida (albicans and non albicans), Cryptococcus neoformans, Epidermophyton floccosum, Erysiphe graminis, Exophiala jeanselmei, Fonsecaea pedrosoi, Fusarium solani, Helminthosporium oryzae, Microsporum gypseum, Paracoccidioides brasiliensis, Phytophthora infestans, Puccinia recondite, Rhizoctonia solani, Sporothrix schenckii, Scedosporium apiospermum, Trichosporon, Trichophyton rubrum, T. mentagrophytes.
מנגנון הפעולה המשוער הוא הגברת העקה החמצונית (העלאת ROS) והשריית אפופטוזיס, וכן התגברות על זנים עמידים על ידי שינוי חדירות הממברנה ועיכוב יצירת ביופילם והייפות (hyphae) – המבנים הארגוניים של הפטריות אשר מגנים עליהן מפני מתקפות חיצוניות(512-514).
נספח – פורמולות פטנט להגברת זמינות ביולוגית
הקדמה | פורמולות הפטנט המובילות | מחקרים פרמקוקינטיים השוואתיים | טבלאות מסכמות
הקדמה
בשוק ישנן נכון להיום מספר פורמולות פטנט מובילות לשיפור הזמינות הביולוגית של כורכומין, אך בבואנו להעריך את איכותן ולהשוות ביניהן אנו נתקלים במספר קשיים: הקושי הראשון קשור בהגדרת הזמינות הביולוגית. לרוב הנתון המספרי המגדיר את הזמינות הביולוגית של הכורכומין במוצרים השונים הוא השטח תחת העקומה הפרמקוקינטית (AUC) המודד את ריכוז הכורכומין בפלסמה כפונקציה של הזמן. עם זאת, לא מעט חברות מציגות את נתוני הריכוז המקסימלי בפלסמה (Cmax), את מסיסות הכורכומין במוצר או את אחוזי הספיגה שלו במעי. שנית, גם כאשר הזמינות הביולוגית נמדדת באמצעות הערך AUC, לעתים ערך זה מתייחס לסך כל הכורכומין שנמדד בדם הכולל את הכורכומין החופשי הפעיל ביולוגית ואת הנגזרות הלא פעילות של כורכומין לאחר שעברו קוניונגציה על ידי אנזימי הפאזה השניה בכבד. התוצאה המתקבלת היא ערך מספרי מנופח של זמינות ביולוגית שאינו משקף את ריכוז החומר הפעיל בפועל. לבסוף, במחקרי השוואה בין תוספים שונים לעתים מוצגים ערכים מתוקנים של AUC לפי ריכוז הכורכומין בתוספים ולא לפי מינוני הנטילה של כל תוסף ולפיכך אינם משקפים את הזמינות הביולוגית של הכורכומין מתוך הכמות שניטלה בפועל.
חשוב גם לזכור שזמינות ביולוגית משופרת אינה מעידה בהכרח על יעילות. תוספים שונים טרם נחקרו במחקרים קליניים להוכחת יעילותם במצבי חולי שונים. זמינות גבוהה בדם גם אינה מבטיחה הגעה לאברי המטרה, כגון מעבר דרך מחסום דם המוח. ולעתים שיפור הזמינות הביולוגית עלול לגרום אינטראקציות עם טיפול תרופתי כמו בפורמולות המכילות פיפרין מעכב הקוניונגציה,המשבשות את הפינוי התקין של רעלים ומעלות את הריכוז בדם של תרופות שהמשתמש נוטל במקביל. חלק מפורמולות הפטנט עדיין לא הציגו נתונים על בטיחות השימוש לאורך זמן. בסקירה שלהלן ננסה לרכז את המידע הפרמקוקינטי והקליני כפי שהוצג במחקרים, כדי לאפשר בחינה מושכלת וביקורתית של שלל המוצרים הנמכרים בשוק.
פיפרין משפר את ספיגת הכורכומין במעי (מעכב את מנגנון P-gp במעי) ומעכב את הגלוקורוניזציה (אנזים הפאזה השניה) של הכורכומין במעי ובכבד(515-516). למעשה, פיפרין משפר את הזמינות הביולוגית של כורכומין ב-2000% (פי 20)(517). יחד עם זאת, פיפרין עלול להגביר את הריכוז בסרום של תרופות בעלות טווח תרפויטי צר כדוגמת תרופות כימותרפיות (ראו כאן.)
תערובות ותרכובות פוספוליפידיות (פוספטידיל כולין) – שילוב כורכומין עם פוספטידיל כולין מגן על כורכומין מפני הרס בסביבה מימית, משפר את ספיגת הכורכומין במעי ומשפר את מעבר הכורכומין דרך ממברנות תאי המטרה בהיותו מסיס מים (הידרופילי) ומסיס שומן (ליפופילי) כאחד, לרבות במעבר דרך מחסום דם המוח (BBB). בהקשר זה, יש חשיבות למבנה המרחבי שיוצר השילוב, כאשר מעטפת שומנית (בין אם בצורת מיצלה, ליפוזום או פיטוזום – ראו להלן) מגינה על הכורכומין מפירוק אנזימתי במעבר במערכת העיכול(518). סוגי התוספים הפוספוליפידים כוללים:
מיצלות - מעטפת בעלת מסיסות הן במים והן בסביבה שומנית הנוצרת ספונטנית בסביבה מימית סביב הכורכומין. מסייעות לספיגה ולמסיסות במים של כורכומין(1,519).
ליפוזומים- הם סוג של מיצלות זעירות היוצרות בועיות מבוססות פוספוליפידים בעלות סידור מרחבי הידרופילי והידרופובי דו שכבתי בדומה לממברנות התאים. מסייעות לספיגה של כורכומין, למסיסות ולחדירה לתאים(10,520-521).
פיטוזומים - הם תרכובת בין מולקולות כורכומין ובין מולקולות פוספוליפידים, לרוב של פוספטידיל כולין (בניגוד לליפוזום ולמיצלה שהנן תערובות). "ראשי" כולין נקשרים לכורכומנואידים ליצירת מרכז הידרופילי ו"זנבות" של פוספטידיל יוצרים סביבם מעטפת ליפופילית בצורת כדור זעיר. יתרונם הוא ביציבות התרכובת, בהגנה מפני פירוק אנזימתי במערכת העיכול ובשיפור משמעותי של הספיגה במעי ובאברי המטרה(2,522-524).
דרכים נוספות לשיפור הזמינות הביולוגית של כורכומין מתבססות על פיתוחים מודרניים לשיטות מסורתיות הכוללות:
שילוב כורכומין יחד עם שמנים נדיפים שמקורם בקנה השורש הטרי (שאף הם סוג של תערובת ליפידית), וכן שילוב כורכומין עם פלבונואידים כגון קוורציטין או סיליבינין(525) (פלבונואיד המצוי בגדילן מצוי – Silybum marianum) ורכיבים צמחיים נוספים כגון גלקטומנן(412) (סיב תזונתי המופק מגרגרנית יוונית -Trigonella foenum-graecum). כל אלה נועדו לשפר את הספיגה של כורכומין במעי, להפחית את פירוקו בכבד ולשפר את פיזורו וזמינותו לתאים(1).
בשנים האחרונות אנחנו עדים לפיתוחים מבוססי טכנולוגיה המנסים לענות על האתגרים המטבוליים של השימוש בכורכומין(522):
חלקיקי נאנו(3,10,526), גודל החלקיקים מפצה על חוסר המסיסות במים ומאפשר מעבר קל יותר דרך ממברנות. משפרים את ספיגת כורכומנואידים במעי, משפרים את חדירות הכורכמנואידים לממברנות התאים.
מיקרו-אמולסיות – פיזור אחיד של חלקיקי כורכומין זעירים בשילוב עם חומרים מחליבים בפאזה שומנית רציפה ליצירת בועיות זעירות של כורכומין בתוך מעטפת שומנית מגנה. בנוסף לכל היתרונות של תוספים פוספוליפידים מצטרף יתרון הגודל הזעיר של החלקיקים(522,527).
פיזור חלקיקי על נשאים פולימרים - צימוד של כורכומין למולקולות זעירות של פולימרים הידרופילים המגבירים את היציבות של כורכומין, את מסיסותו במים, את ספיגתו במעי, את הובלתו אל איברי המטרה ואף מאפשרים שחרור מושהה של כורכומין(522,527).
ציקלודקסטרי - אוליגוסכריד היוצר מעטפת הידרופילית לסביבה ליפופילית שבה מצוי הכורכומין. מסייע לספיגה ולמסיסות במים של כורכומין ומעכב גלוקורוניזציה וסולפציה על ידי אנזימי הפאזה השניה בכבד(528).
כמו כן, חלק מתוספי הדור החדש משווקים כפורמולות נוזליות בצורת ג'ל (Liquid gel) לשיפור המסיסות, הספיגה והזמינות הביולוגית של הכורכומין.
סקירת פורמולות הפטנט המובילות ותכונותיהן
Cureit / Acumin (טכנולוגיית PNS- Polar-Nonpolar-Sandwich) - מיוצר מ-100% כורכום ללא חומרים מוספים באמצעות טכנולוגיה ליפוזומלית וטכנולוגית PNS (Polar Non Polar Sandwich). מכיל כ-50% כורכומנואידים (מיצוי אתנולי 95%), שמנים אתריים מצמח הכורכום (מיצוי באידוי), ורכיבים מסיסי מים (מיצוי מימי: פחמימות 40%, סיבים 5%, חלבון turmerin 2% ומינרלים). התוסף נהנה מיתרונות הרכיבים הפעילים הנוספים שבכורכום: turmerin, פוליסכרידים, וססקוויטרפנים. טכנולוגית ה-PNS למעשה ״אורזת״ בציפוי מסיס במים את הכורכומין ומארג החומרים הפעילים הנמצאים במיצוי השלם המופק משורש הכורכום, ובכך משפרת את מעבר הכורכומין לאורך המעי ואת ספיגתו אל מחזור הדם. זהו למעשה ליפוזום שבו הכורכומנואידים עטופים בשמנים האתריים של צמח הכורכום עצמו ובתווך הנגזרת המימית הפולארית של הצמח. החלקיקים הנם בגודל 200-400 מיקרון. מינון מומלץ על ידי היצרן הנו 500 מ"ג ליום. מחקר קליני יחיד דיווח על יעילות קלינית בדלקת מפרקים שגרונית(304).
על פי מחקרים (מפורטים בהמשך) זמינותו הביולוגית של התוסף היא פי 10 בהשוואה לכורכומין "נקי" (539), ופי 5 מתוסף כורכומין פוספוליפידי (Meriva) ופי 6 מתוסף כורכומין עם שמן אתרי (Biocurcumax) (542).
מחקר קליני השוואתי אקראי וכפול סמיות(542) בחן את הזמינות הביולוגית של תוסף כורכומנואידים חדשני המבוסס על פיזור חלקיקי של מולקולות כורכומנואידים על מטריקס הידרופילי וליפופילי מרכיבי שורש הכורכום (Cureit™/Acumin™) בהשוואה לתוסף כורכומין משולב בשמנים נדיפים מצמח הכורכום (BCM-95) ולתוסף כורכומין פיטוזומלי (Meriva) בקרב ארבעים וחמישה (45) נבדקים בריאים (כולם גברים). שיעור הספיגה של סך כל הכורכומנואידים בדם בעקבות נטילת התוסף הנבדק היה גבוה פי 6 בהשוואה לתוסף המשולב בשמנים נדיפים ופי 5 בהשוואה לתוסף הפיטוזומלי.
מחקר קליני (539) שנערך בקרב 12 גברים בריאים בגילאים 45-18, השווה בין הזמינות הביולוגית של כורכומין בתוסף כורכום נוזלי בטכנולוגית PNS, לבין תוסף בטבלייה המכיל 95% כורכומין "נקי" (ללא טכנולוגיה לשיפור הספיגה). במבחן הזמינות הביולוגית, תוצאות המחקר הראו כי רמות הכורכומינואידים בדם לאחר נטילת מנה אחת של תוסף כורכום בטכנולוגיית PNS היו גבוהות פי 10 בהשוואה לנטילת מנה אחת של תוסף הכורכומין הנקי.
לפירוט המינונים והתוצאות ראו כאן
כורכומין/כורכומנואידים (C3) בשילוב Bioperine - תמצית תקנית של כורכום מתוקננת להכיל 95% כורכומין/כורכומנואידים בשילוב עם
ביופרין (מהווה 1% מהפורמולה, piperine 95%), בפורמולה. מינונים מקובלים 1000 מ"ג כורכומין + 10 מ"ג פיפרין ליום - משפרת זמינות ביולוגית פי 20 בהשוואה ל-*C95 – יעילה בטיפול בתסמונת מטבולית ובדלקת מפרקים ניוונית. לא תתאים בשילוב עם תרופות בעלות טווח תרפויטי צר ופוטנציאל רעילות גבוה (כגון תרופות כימותרפיות), לא תתאים בצרבות ובדלקות אקוטיות במערכת העיכול, יתכן שפחות יעילה מתוספי כורכומין פוספוליפידי לטיפול בהפרעות קוגניטיביות(295,376,417).
*תמצית תקנית של כורכום מתוקננת להכיל 95% כורכומין
solid lipid curcumin particle technology) Longvida) - תוסף כורכומנואידים עטופים במטריקס ליפופילי המושך מולקולות שומן. מאפשר חדירה של כורכומין דרך המעי בצורת כילומיקרון וספיגתו דרך הלימפה באופן שעוקף (או עוקף חלקית) את המטבוליזם במעי ובכבד. חלקיקים בגודל נאנו. מיקרואנקפסולציה מגנה על כורכומין מפני פירוק בסביבה החומצית בקיבה, מסיס במים, נספג היטב במעי נכנס ככורכומין חופשי, מאפשר שחרור מושהה של כורכומנואידים ושהיה ארוכה יותר במחזור הדם. הרכב המוצר 20%-30% כורכומנואידים, 70-80% פוספוליפידים (לא ברור מדוע יש טווח רחב כל כך). טווח מינונים 400 מ"ג ליום – 2000 מ"ג (מינון שווה ערך ל-80 מ"ג – 400 מ"ג כורכומין ליום - משפר זמינות ביולוגית פי *65-285 של כורכומין חופשי בהשוואה לתמצית תקנית מתוקננת להכיל 95% כורכומנואידים (C3) – לפי דיווחים פרסומיים, אך בעיות מתודולוגיות במחקרי פרמקוקינטיקה וממצאי יעילות לא חד משמעיים עבור מינונים שונים. מיצוי זה עובר בקלות יחסית את דופן הממברנות של התאים ועובר BBB ולכן יעיל למחלות נוירודגנרטיביות, אלצהיימר, וכן נמצא יעיל לשיפור בריאות הלב והעורקים, לכאבי שרירים, ולמוקוזיטיס(403,411,444,530).
* לפי ערך AUC השטח מתחת לעקומה הפרמקוקינטית. 65 בהשוואה לפי מינוני הנטילה של התוסף בשלמותו. 285 לאחר תיקון לפי השוואת תכולת הכורכומין בתוספים.
Merivaי(CPC-Curcumin Phospholipid complex) - תרכובת פוספוליפידית של כורכומין ולציטין (פוספטידיל כוֹלין) סויה ביחס של 1:2 במבנה פיטוזום. מכילה 20% כורכומנואידים (מתוכם כורכומין 75-, DMC 15%, BDMC 10%), 40% פוספטידיל כולין ו-40% תאית (מיקרוקריסטלין צלולוז). אין בקרה על גודל החלקיקים. טווח מינונים 1000-2000 מ"ג ליום (מינון שווה ערך ל-200-400 מ"ג כורכומין ליום). מיצוי זה משפר זמינות ביולוגית של כורכומנואידים פי 29 (ב-2900%) בהשוואה ל-C3, ופי 19.2 בהשוואה לכורכומין סטנדרטי (C95)*. חסרונו הוא שבפועל הוא משפר זמינות ביולוגית של DMC, BDMC הרבה יותר מאשר של כורכומין, ולכן יתאים יותר בהקשרים של פעילות נוגדת דלקת ונוגדת חמצון. כמו כן, הוא אינו עוקף את המטבוליזם בכבד ולא מעכב גלוקורונידציה (אנזימי הפאזה השניה בכבד) וכך לצד רמות גבוהות של כורכומין חופשי, ישנן רמות גבוהות של כורכומין מצומד (גלוקורונידט וסולפט) שאינו פעיל ביולוגית. מיצוי זה נמצא יעיל במחקרים לטיפול בכאבים, בדלקת מפרקים ניוונית, בתופעות לוואי של סרטן, בסיבוכי סוכרת, בכאבי שרירים, בפסוריאזיס ובמחלות עיניים(80,82,101,225,477,531).
* לפי מדד AUC מתוקן: השוואה בין התוספים לפי ריכוז הכורכומין שבהם ולא לפי מינון הנטילה בפועל של כל תוסף.
BCM-95 / Biocurcumin / Biocurcumax - מיוצר מ-100% כורכום ללא חומרים מוספים. מכיל 86% כורכומינואידים (מתוכם כורכומין 71-77%, DMC 10-20%, BDMC 5%) וכן 7-9% שמנים אתריים המכילים ססקוויטרפנים משורש הכורכום (ar-tumerone, α-tumerone, β-tumerone). השמנים האתריים גם הם סוג של ליפידים ולמעשה מדובר בתוסף כורכומנואידים עם תערובת של ליפידים שכולו מופק מכורכום. החלקיקים הינם בגודל מיקרון. מינון במחקרים 1000 מ"ג ליום (ב-500 מ"ג תוסף יש בערך 450 מ"ג כורכומין חופשי). משפר זמינות ביולוגית פי 6.9 בהשוואה לכורכומין, פי 6.3 בהשוואה לכורכומין-לציטין-פיפרין, פי 5 בהשוואה לתמצית כורכומנואידים סטנדרטית (C95). נמצא יעיל לטיפול בבעיות מפרקים, בעיות במערכת השתן, מצב רוח וסטרס, תפקוד קוגניטיבי, מחלות נוירודגנרטיביות, מצבי דלקת, סרטן, ערמונית, חזה וכבד. יתרונו שעובר BBB ולכן יתאים למחלות נוירודגנרטיביות(532-533).
תוספי כורכומנואידים בשילוב עם נשא הידרופילי או ציקלודקסטרין - הגברת זמינות ביולוגית פי 39-46 בהשוואה לכורכומין סטנדרטי (C95) ויתרון על פני התוספים האחרים על פי נתונים פרסומיים. חלקיקים בגודל נאנו. מעכבים באופן פיסי תהליכי גלוקורונידציה (אנזימי הפאזה השניה בכבד). החסרון העיקרי הוא מיעוט מחקרים קליניים ומחקרים פרמקוקינטיים בבני אדם(345,534-537). לדוגמא Theracurmin ו- Cavacurmin/ CAVAMAX® W8 curcumin.
Novasol / Metacurmin (כורכומין מיצלרי בפורמולה נוזלית) – פורמולה המכילה 6% כורכומנואידים (82% כורכומין, 16% DMC ו-2% BDMC) המשולבים בחומר מתחלב (polysorbate 80) ויוצרים מיקרו-מיצלות המחקות את המיקרו-מיצלות הפזיולוגיות שיוצרים מיצי המרה במעי במטרה לשפר את ספיגת הכורכומין. התוסף נמכר בפורמט ג'ל נוזלי לשיפור המסיסות והספיגה של הכורכומנואידים. כל כמוסת ג'ל נוזלי של 500 מ"ג מכילה 25 מ"ג כורכומין. זמינות ביולוגית פי 185 בהשוואה לתוסף כורכומנואידים סטנדרטי (complex c3). נתוני הזמינות הביולוגית לקוחים ממחקר פרמקוקינטי יחיד שבוצע בבני אדם. במחקר זה נמצאו הבדלים משמעותיים בין נשים וגברים בערכי הזמינות הביולוגית של התוסף בהשוואה לתוסף הסטנדרטי (זמין פי 277 בנשים ופי 114 בגברים) וכן אחוז לא מבוטל מבין המשתתפים (עשרה מתוך 23) דיווח על תופעות לוואי לא רצויות בעת הנטילה. לא נערכו מחקרים קליניים(540).
מחקרים פרמקוקינטים השוואתיים
מחקר קליני השוואתי אקראי וכפול סמיות(542) בחן את הזמינות הביולוגית של תוסף כורכומנואידים חדשני המבוסס על פיזור חלקיקי של מולקולות כורכומנואידים על מטריקס הידרופילי וליפופילי מרכיבי שורש הכורכום (Cureit™/Acumin™) בהשוואה לתוסף כורכומין משולב בשמנים נדיפים מצמח הכורכום (BCM-95) ולתוסף כורכומין פיטוזומלי (Meriva). ארבעים וחמישה (45) נבדקים בריאים (כולם גברים) חולקו אקראית לנטילה חד פעמית של כל אחד מהתוספים במינון 500 מ"ג לאחר צום לילה (תכולת הכורכומין לכמוסה של התוסף הנבדק, של BCM-95 ושל Meriva היתה 180, 351 ו-80.5 בהתאמה). התוסף הנבדק הכיל 46.5% כורכומנואידים (כורכומין 36%, DMC 9% ו-BDMC 1.5%), המכיל 43% פחמימות, 5% סיבים,%2.4 חלבונים ו-3.2% שמנים נדיפים. נמצא כי ריכוז הכורכומנואידים המקסימלי בפלסמה היה 170.14 ננוגרם למיליליטר (כעבור 4 שעות) בעקבות נטילת התוסף הנבדק בהשוואה ל-47.54 ננוגרם למיליליטר (כעבור 3 שעות) ו-69.63 ננוגרם למיליליטר (כעבור 2.25 שעות) בעקבות נטילת התוסף המשולב בשמנים נדיפים והתוסף הפיטוזומלי בהתאמה. השטח מתחת לעקומה (AUC) אשר נמדד ב- ng mL/h היה 825, 117, ו-187, בהתאמה. כלומר שיעור הספיגה של סך כל הכורכומנואידים בדם בעקבות נטילת התוסף הנבדק היה גבוה פי 6 בהשוואה לתוסף המשולב בשמנים נדיפים ופי 5 בהשוואה לתוסף הפיטוזומלי.
מחקר קליני (539) שנערך בקרב 12 גברים בריאים בגילאים 45-18, השווה בין הזמינות הביולוגית של כורכומין בתוסף כורכום נוזלי בטכנולוגית PNS, לבין תוסף בטבלייה המכיל 95% כורכומין "נקי" (ללא טכנולוגיה לשיפור הספיגה). במבחן הזמינות הביולוגית, תוצאות המחקר הראו כי רמות הכורכומינואידים בדם לאחר נטילת מנה אחת של תוסף כורכום בטכנולוגיית PNS היו גבוהות פי 10 בהשוואה לנטילת מנה אחת של תוסף הכורכומין הנקי.
מחקר קליני אקראי כפול סמיות במבנה מצולב בחן את הזמינות הביולוגית של תרכובת כורכומין(531) פוספוליפידי במבנה פיטוזומלי (Meriva). תשעה נבדקים בני 18-55 חולקו אקראית לנטילת 209 או 376 מ"ג Meriva או 1799 מ"ג תוסף כורכומנואידים חופשיים (C3). לאחר מכן שבוע הפסקה הוצלבו הנבדקים בשני ביקורים נוספים (עם שבוע הפסקה ביניהם) כך שכל נבדק התנסה בכל סוגי הטיפולים. בתום ההתערבות נמצא שהזמינות הביולוגית של כורכומנואידים מתוסף Meriva גבוהה פי 29 בהשוואה לתוסף C3. ריכוז הכורכומין בפלסמה בעקבות נטילת Meriva היה גבוה פי 18 בהשוואה לריכוזו בעקבות נטילת C3, וריכוז הכורכומנואידים DMC ו-BDMC בפלסמה היה גבוה פי 50 ו-60 בהתאמה. לבסוף ספיגת תוסף Meriva היתה מהירה פי 2 לעומת ספיגת תוסף C3.
מחקר קליני השוואתי אקראי וכפול סמיות בחן את הבטיחות ואת הזמינות הביולוגית של תוסף כורכומין (Longvida) במינונים שונים בהשוואה לתוסף כורכומין סטנדרטי (C95) בקרב נבדקים בריאים ובקרב חולי סרטן העצם. 11 חולי סרטן העצם (osteosarcoma) בני 12-60 נטלו את תוסף הכורכומין (כורכומין תקני מתוקנן להכיל 20-30% כורכומין משולב בפוספוליפידים במבנה חלקיקי פטנטי SLCP* במינון הולך ועולה של 2, 3 ו-4 גרם. הטיפול בכל המינונים נסבל היטב. בנוסף, שישה נבדקים בריאים בני 18-40 חולקו אקראית לנטילת 650 מ"ג של תוסף הכורכומין הנבדק (תכולת כורכומין 130-195 מ"ג) או 650 מ"ג של תוסף כורכומין סטנדרטי (תכולת כורכומין 390 מ"ג לפחות). לאחר שבועיים הפסקה, הוצלבו הנבדקים לקבלת התוסף הנגדי. בקרב נבדקים בריאים שנטלו את התוסף הנבדק הריכוז המקסימלי של כורכומין בפלסמה הגיע ל-22.43 ננוגרם למליליטר, בעוד שריכוז הכורכומין בפלסמה בעקבות הנטילה של הכורכומין הסטנדרטי היה אפסי. עם זאת, בקרב הנבדקים הבריאים והחולים כאחד נצפתה שונות גבוהה במדדים הפרמקוקינטיים ובקרב החולים אף נצפה קשר בלתי לינארי בין מינון הנטילה ובין ריכוז הכורכומין בדם(530).
* Solid Lipid Curcumin Particle Technology
במחקר קליני השוואתי אקראי וכפול סמיות במבנה מצולב (X3) נבדקה הזמינות הביולוגית של תוסף Theracurmin (חלקיקים בגודל נאנו מפוזרים בצורה אחידה על חלקיקי גומי מומסים במים וגליצרין) בהשוואה לתוסף כורכומין פוספוליפידי (Meriva) ולתוסף כורכומנואידים בשילוב שמנים אתריים מצמח הכורכום (BCM-95). תשעה נבדקים בריאים בגילאי 24-32 חולקו אקראית לנטילת התוספים במינונים המקובלים (שש כמוסות של טרכורמין, כמוסה אחת של BCM-95 ושתי כמוסות של Meriva – מינון שווה ערך ל-182.4, 279.3 ו-152.5 מ"ג כורכומין בהתאמה). לאחר מכן הוצלבו הנבדקים פעמיים, כך שכל נבדק התנסה בנטילת כל סוגי התוספים. נמצא כי ריכוז טרכורמין בפלסמה היה גבוה פי 10.7-5.6 מריכוז התוספים האחרים וריכוזו בפלסמה על פני 24 שעות היה גבוה פי 11-4.6(541).
מחקר מעבדה שהעריך את ספיגה והזמינות הביולוגית של מוצרי כורכומין שונים, מצביע על כך שפורמולת כורכומין בנשא הידרופילי (Hydrophilic Carrier Dispersed Curcuminoids) וכורכומין בנשא ציקלודקסטרין הינם בעלי זמינות ביולוגית הגבוהה פי 46 ו-45, בהתאמה, לעומת המיצוי הסטנדרטי של 95% כורכומין(1).
ראוי לציין כי טרם ברור לאילו מן השיטות יתרון על האחרות, אולם מרבית המחקרים הקליניים שנערכו בשנים האחרונות והציגו תוצאות מבטיחות כללו שימוש בכורכומין לצד פיפרין או פוספטדיל כולין.
במחקר קליני משנת 2014 נערכה השוואה בין 3 פורמולות המכילות כורכומין בנטילה פומית:
1. תרכובת של כורכומין מוצמד לפוספוליפיד (CP).
2. שילוב כורכומין עם שמנים נדיפים מקנה שורש הכורכום (CTR).
3. שילוב כורכומין עם נשא הידרופילי, נגזרות של תאית ונוגדי חמצון טבעיים (CHC).
נמצא כי בהשוואה למיצוי סטנדרטי, רמת הרכיבים הפעילים בדם הייתה גבוהה פי 1.3 עבור CTR, פי 7.9 עבור CP ופי 45.9 עבור CHC - הפורמולה הייחודית שפותחה ע"י החוקרים.
החוקרים מסכמים כי פורמולה זאת עשויה להיות יעילה במידה רבה לשיפור איכות הספיגה של כורכומין; יש לציין כי במחקר זה לא נבדקה ולא הושוותה יעילות התוספים השונים לעומת תוסף כורכומין המכיל פיפרין או פוספטדיל כולין(534).
במחקר כפול סמיות מוצלב(537) נבדקה הזמינות הביולוגית של פורמולת כורכומין חדשה (CW8), אשר מבוססת על כורכומין יחד עם גמא- ציקלודקסטרין (γ-Cyclodextrin), מולקולה המופקת מעמילן ותורמת להגברת המסיסות והספיגה של הכורכומין. פורמולה זו הושוותה למיצוי כורכומין מתוקנן (StdC) ולשני מוצרים מסחריים המדווחים על זמינות ביולוגית גבוהה יותר: פורמולה של כורכומין עם פוספוליפיד פיטוזומלי (CSL) ופורמולה של כורכומין ושמן אתרי כורכום (CEO). מוצרים אלה אינם מוצגים בשמם המסחרי במאמר בשל העדר הסכמה לפרסום. במחקר השתתפו 12 מתנדבים בריאים בגילאי 20-35, אשר צרכו כל אחת מארבע הפורמולות בימים שונים (לקיחה חד פעמית), עם 7 ימי הפרדה בין כל פורמולה. שלוש הפורמולות כללו כ-376 מ"ג כורכומינואידים והמיצוי המתוקנן 1,800 מ"ג כורכומינואידים. המשתתפים קיבלו כל אחת מהפורמולות לאחר צום לילה, כאשר החוקרים מדדו את הרמה של שלושה רכיבים כורכומינואידים בדם (curcumin, demethoxycurcumin, and bisdemethoxycurcumin) לפני נטילת הפורמולה ועד 12 שעות לאחר מכן. מהתוצאות עולה כי ריכוז הכורכומינואידים הכללי היה הגבוה ביותר לאחר נטילת הפורמולה שנבדקה, CW8, כאשר נטילת הפורמולה CSL הייתה מלווה בריכוז הגבוה ביותר של bisdemethoxycurcumin. כמו כן, ריכוז הכורכומינואידים הכללי לאחר נטילת CW8 היה גבוה פי 38 בהשוואה למיצוי כורכומין מתוקנן (ריכוז של 388.6 לעומת 10.4 ננוגרם/מ"ל) וגבוה יותר באופן משמעותי בהשוואה לשתי פורמולות ההשוואה (CEO - 12.1 ננוגרם/מ"ל,CSL - 86.9 ננוגרם/מ"ל).
יש לציין כי המחקר מומן על ידי החברה הביוכימית Wacker Chemie AG המייצרת את הפורמולה הנחקרת.
מחקר קליני השוואתי אקראי כפול סמיות במבנה מוצלב בחן את הזמינות הביולוגית של תוסף כורכומין המבוסס על עיטוף של כורכומין במיקרו-מיצלות נוזליות (CLDM) בהשוואה לכורכומין סטנדרטי C95 (תמצית תקנית של כורכום מתוקננת להכיל 95% כורכומין). 12 נבדקים בריאים חולקו אקראית לנטילה חד פעמית של 400 מ"ג מהתוסף הנבדק או תוסף הכורכומין הסטנדרטי במינון 400 מ"ג (בפועל תכולת הכורכומין בתוסף הנבדק היתה 64.6 מ"ג ובתוסף הסטנדרטי 323 מ"ג). נמצא שריכוז הכורכומין המצומד בפלסמה (curcumin sulfate ו-curcumin glucuronide) כעבור 1.5 שעות מן הנטילה היו 20 ו-300 ננוגרם למיליליטר עבור התוסף הנבדק, ולא נמצאו כלל עבור תוסף הכורכומין הסטנדרטי. ריכוז הכורכומין החופשי היה 2 ננוגרם למיליליטר עבור התוסף הנבדק ו-0.3 ננוגרם למיליליטר עבור תוסף הכורכומין הסטנדרטי. שיא שניוני ושלישוני של ריכוז כורכומין חופשי בפלסמה נצפו כעבור 12 שעות ו-24 שעות (1.5 ננוגרם למיליליטר). שיעור הזמינות הביולוגית של כורכומין לפי השטח מתחת לעקומה הפרמקוקינטית היה גבוה פי 522 עבור התוסף החדש בהשוואה לתוסף הסטנדרטי. הממצאים מצביעים על שיפור הספיגה של כורכומין מן המעי אל מחזור הדם ועל שחרור מושהה שלו בזכות העיטוף במיקרו מיצלה שומנית(527).
מחקר קליני השוואתי אקראי חד סמיות ומבוקר במבנה מצולב בחן את יעילות ובטיחות תוסף כורכומין נוזלי (Novasol) המבוסס על עיטוף כורכומין במיצלות נוזליות בהשוואה לתוסף כורכומנואידים סטנדטי (c3 complex) ולתוסף כורכומין שעבר מיקרוניזציה, שניהם בצורת אבקה. התוסף הנוזלי הכיל 7% כורכומנואידים באבקה (מינון שווה ערך ל-6% כורכומנואידים בתוסף) ששולבה ב-93% חומר מתחלב (Tween 80/polysorbate 80) במטרה ליצור עיטוף טבעי של מיצלות עשויות מיצי מרה לשיפור ספיגת הכורכומין. התוסף שעבר מיקרוניזציה הכיל 17.2% אבקת כורכומנואידים מיקרונית (מינון שווה ערך ל-14.1% כורכומנואידים בתוסף). תוסף הכורכומנואידים הסטנדרטי הכיל 95% כורכומנואידים (82% כורכומין, 16% DMC ו-2% BDMC). עשרים ושלושה (23) נבדקים בריאים (13 נשים, טווח גילאים 19-28 ו-10 גברים, טווח גילאים 20-28) חולקו אקראית לנטילה חד פעמית של כל אחד מהתוספים במינון 500 מ"ג (יחס הכורכומנואידים השונים נשמר זהה בכל התוספים - מינון שווה ערך ל-24.6, 57.8 ו- 389.5 מ"ג כורכומין בתוסף הנוזלי, המיקרוני והסטנדרטי בהתאמה) בשלושה מפגשים שונים. שיעור הזמינות הביולוגית של התוסף הנוזלי לפי השטח מתחת לעקומה הפרמקוקינטית היה גבוה פי 128 בהשוואה לתוסף הסטנדרטי. לעומתו, שיעור הזמינות הביולוגית של התוסף המקרוני היה גבוה פי 9 בהשוואה לתוסף הסטנדרטי. כמו כן, נמצא כי הזמינות הביולוגית של תוספי הכורכומנואידים היתה גבוהה יותר במובהק בקרב הנשים מאשר בקרב הגברים (בנשים: זמינות ביולוגית גבוהה פי 277 ופי 14 עבור התוסף הנוזלי והתוסף המיקרוני בהשוואה לתוסף הסטנדרטי בהתאמה, בגברים: זמינות ביולוגית גבוהה פי 114 ופי 5 עבור התוסף הנוזלי והתוסף המיקרוני בהשוואה לתוסף הסטנדרטי בהתאמה)(540).
טבלאות מסכמות
לפי תכונות הפורמולות | לפי מנגנוני פעולה
טבלה 1 – תכונות הפורמולות
לצפייה בפורמט PDF לחצו כאן.
המקורות לטבלה נמצאים מיד אחריה
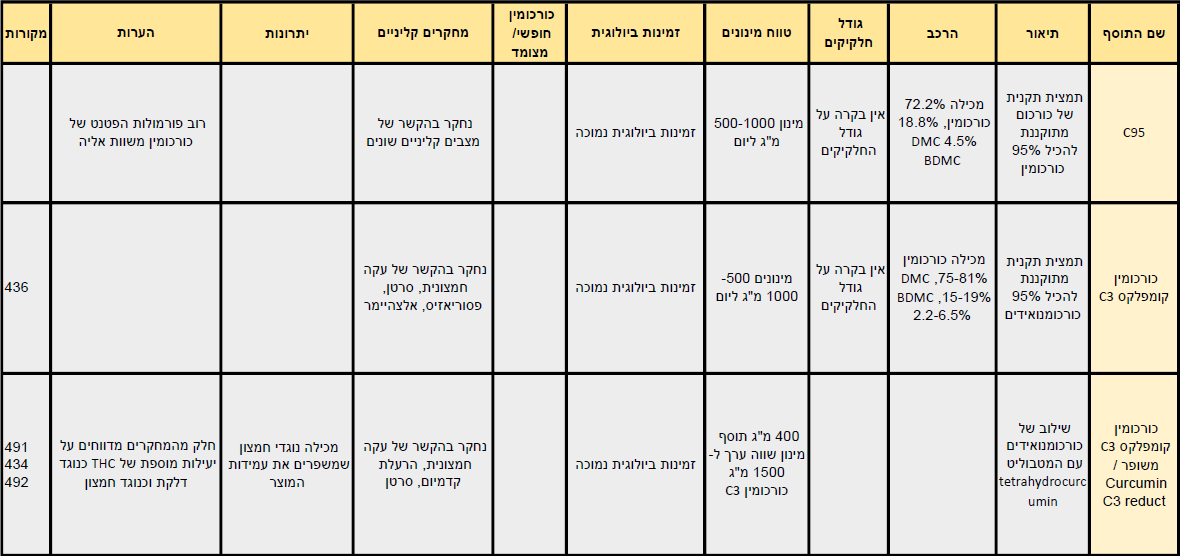
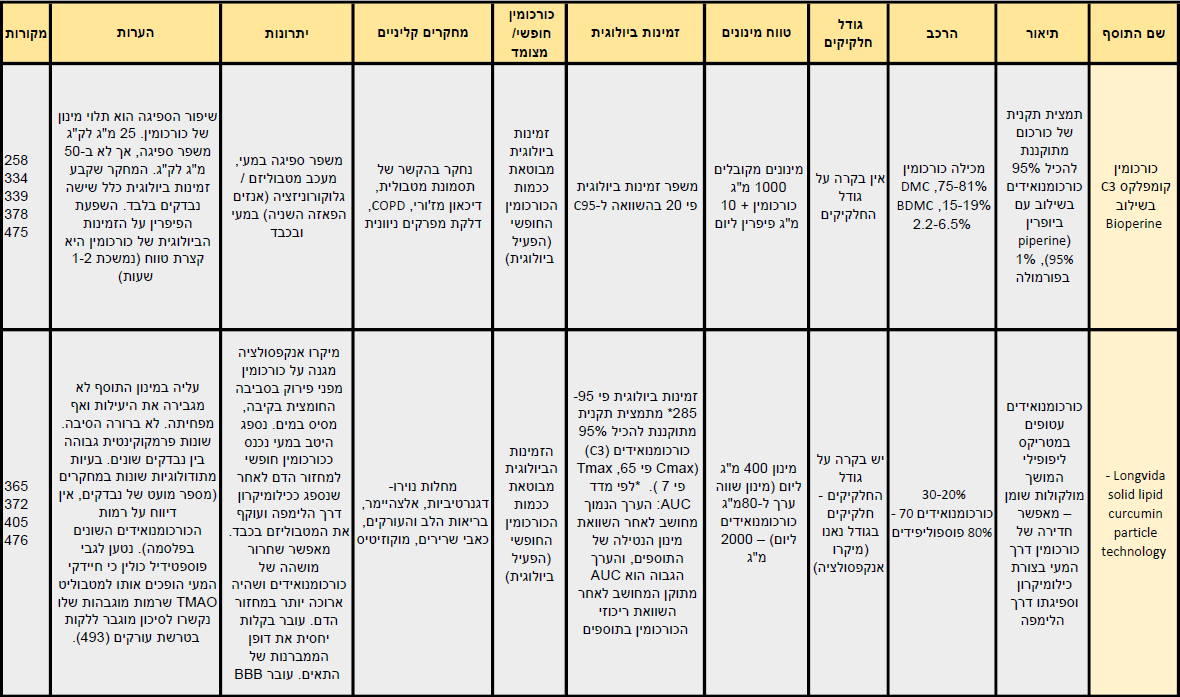
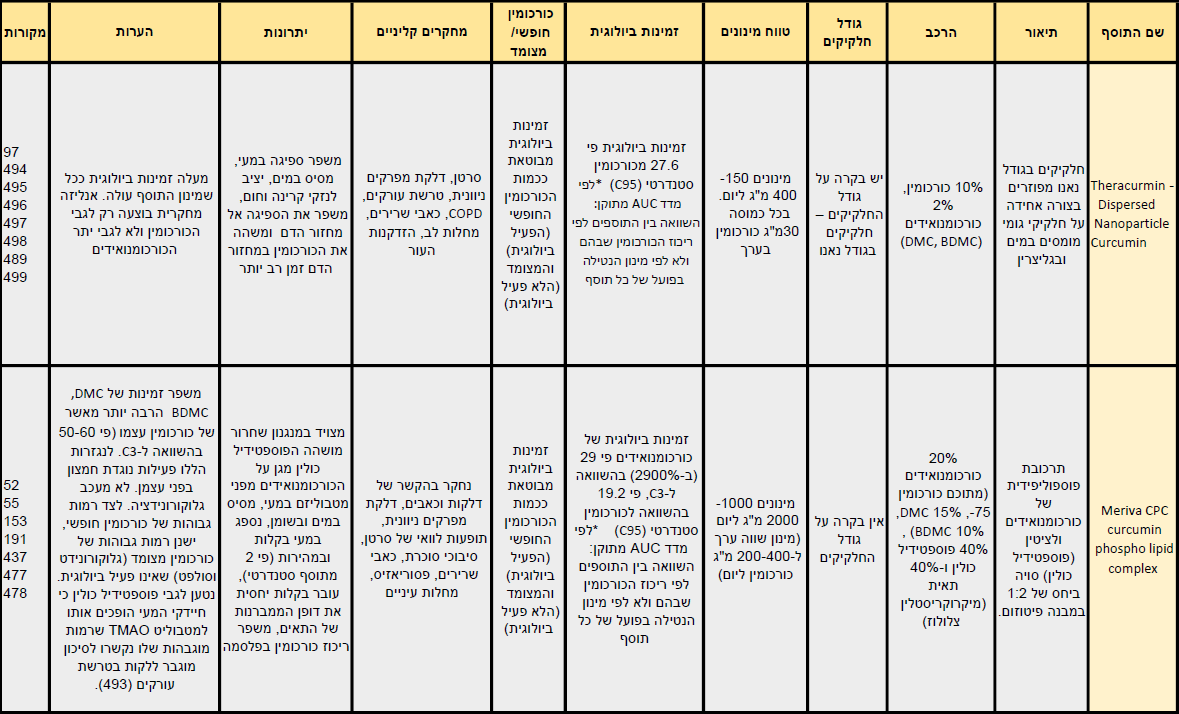
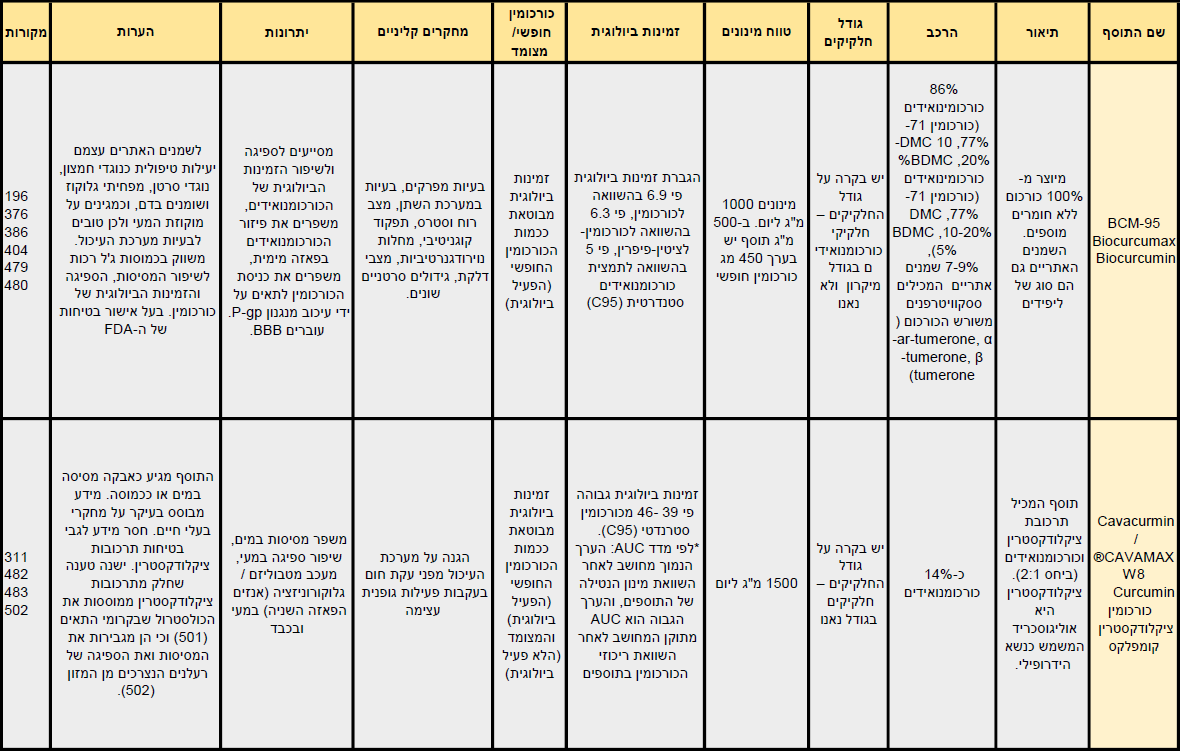
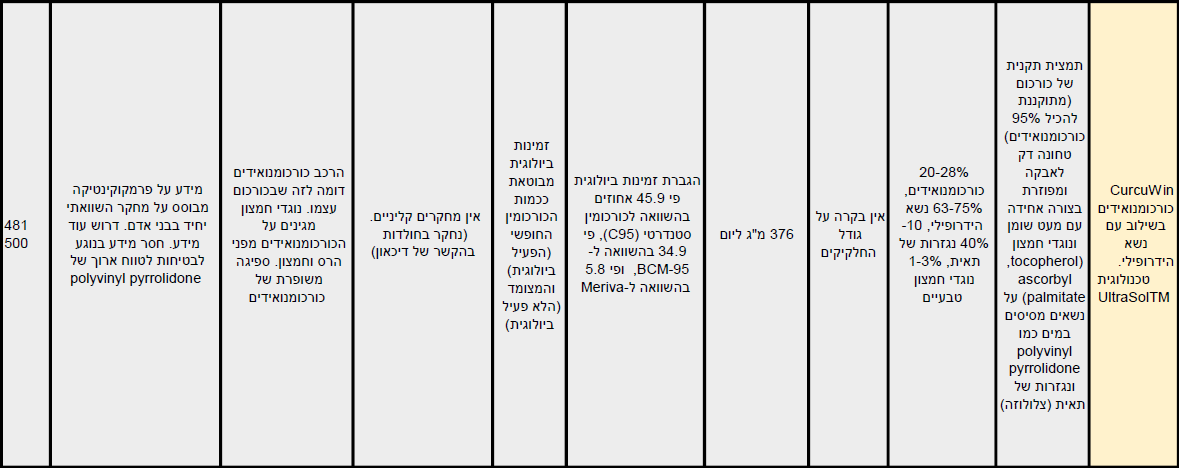
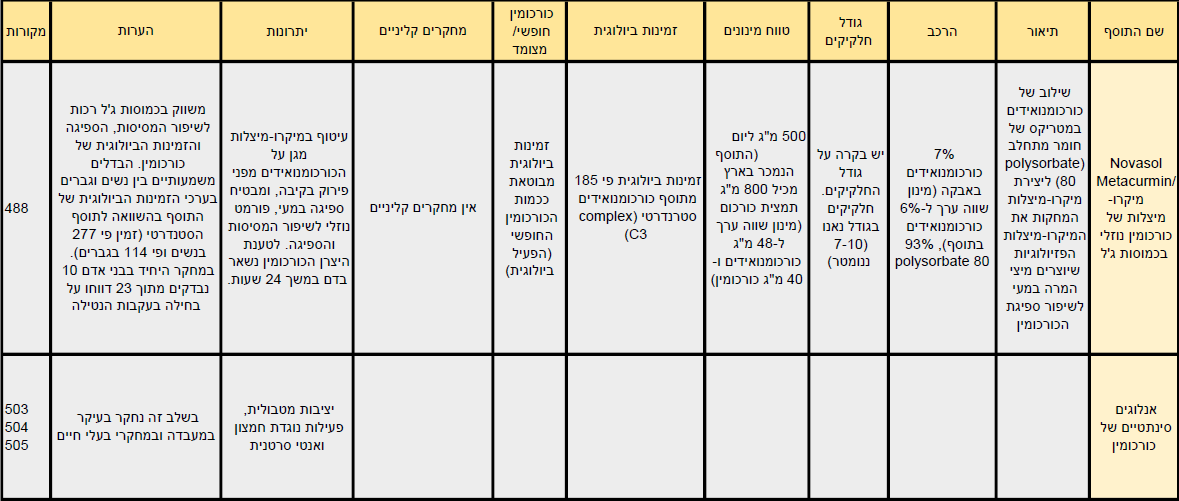
רשימת מקורות לטבלה:
436 Kurd SK, Smith N, VanVoorhees A, Troxel AB, Badmaev V, Seykora JT, Gelfand JM. , "Oral curcumin in the treatment of moderate to severe psoriasis vulgaris: A prospective clinical trial." J Am Acad Dermatol. 2008 Apr;58(4):625-31. https://www.ncbi.nlm.nih.gov/pubmed/18249471
491 Wu JC, Tsai ML, Lai CS, Wang YJ, Ho CT, Pan MH., "Chemopreventative effects of tetrahydrocurcumin on human diseases." Food Funct. 2014 Jan;5(1):12-7. https://www.ncbi.nlm.nih.gov/pubmed/24220621
434 Asawanonda P, Klahan SO. , "Tetrahydrocurcuminoid cream plus targeted narrowband UVB phototherapy for vitiligo: a preliminary randomized controlled study." Photomed Laser Surg. 2010 Oct;28(5):679-84. https://www.ncbi.nlm.nih.gov/pubmed/20961233
492 Kukongviriyapan U, Apaijit K, Kukongviriyapan V., "Oxidative Stress and Cardiovascular Dysfunction Associated with Cadmium Exposure: Beneficial Effects of Curcumin and Tetrahydrocurcumin." Tohoku J Exp Med. 2016 May;239(1):25-38.https://www.ncbi.nlm.nih.gov/pubmed/27151191
258 Panahi Y, Rahimnia AR, Sharafi M, Alishiri G, Saburi A, Sahebkar A, "Curcuminoid treatment for knee osteoarthritis: a randomized double-blind placebo-controlled trial." Phytother Res. 2014 Nov;28(11):1625-31. https://www.ncbi.nlm.nih.gov/pubmed/24853120
334 Panahi Y, Khalili N, Sahebi E, Namazi S, Reiner Ž, Majeed M, Sahbekar A, "Curcuminoids modify lipid profile in type 2 diabetes mellitus: A randomized controlled trial." Complement Ther Med. 2017 Aug;33:1-5. https://www.ncbi.nlm.nih.gov/pubmed/28735818
339 Panahi Y, Khalili N, Hosseini MS, Abbasinazari M, Sahebkar A. "Lipid-modifying effects of adjunctive therapy with curcuminoids-piperine combination in patients with metabolic syndrome: results of a randomized controlled trial." Complement Ther Med. 2014 Oct;22(5):851-7. https://www.ncbi.nlm.nih.gov/pubmed/25440375
378 Esmaily H, Sahebkar A, Iranshahi M, Ganjali S, Mohammadi A, Ferns G, Ghayour-Mobarhan M, "An investigation of the effects of curcumin on anxiety and depression in obese individuals: A randomized controlled trial." Chin J Integr Med. 2015 May;21(5):332-8. https://www.ncbi.nlm.nih.gov/pubmed/25776839
475 Panahi Y Khalili N, Hosseini MS, Abbasinazari M, Sahebkar A., "Lipid-modifying effects of adjunctive therapy with curcuminoids-piperine combination in patients with metabolic syndrome: results of a randomized controlled trial." Complement Ther Med. 2014 Oct;22(5):851-7. https://www.ncbi.nlm.nih.gov/pubmed/25440375
365 Santos-Parker JR, Strahler TR, Bassett CJ, Bispham NZ, Chonchol MB, Seals DR, "Curcumin supplementation improves vascular endothelial function in healthy middle-aged and older adults by increasing nitric oxide bioavailability and reducing oxidative stress." Aging (Albany NY). 2017 Jan 3;9(1):187-208. https://www.ncbi.nlm.nih.gov/pubmed/28070018
372 Cox KH, Pipingas A, Scholey AB, "Investigation of the effects of solid lipid curcumin on cognition and mood in a healthy older population." J Psychopharmacol. 2015 May;29(5):642-51. https://www.ncbi.nlm.nih.gov/pubmed/25277322
405 Brian K. McFarlin, et al. , "Reduced inflammatory and muscle damage biomarkers following oral supplementation with bioavailable curcumin." BBA Clinical, Volume 5, June 2016, Pages 72–78. https://www.sciencedirect.com/science/article/pii/S2214647416300034
476 Gota VS, Maru GB, Soni TG. Gandhi TR. Kochar N. Agarwal MG., "Safety and pharmacokinetics of a solid lipid curcumin particle formulation in osteosarcoma patients and healthy volunteers." J Agric Food Chem. 2010;24:2095–2099. https://www.ncbi.nlm.nih.gov/pubmed/20092313
97 Kanai M, Otsuka Y, Otsuka K, Sato M, Nishimura T, Mori Y, Kawaguchi M, Hatano E, Kodama Y, Matsumoto S, Murakami Y, Imaizumi A, Chiba T, Nishihira J, Shibata H. A phase I study investigating the safety and pharmacokinetics of highly bioavailable curcumin (Theracurmin) in cancer patients. Cancer Chemother Pharmacol. 2013 Jun;71(6):1521-30. https://www.ncbi.nlm.nih.gov/pubmed/23543271
494 Sasaki H, Sunagawa Y, Takahashi K, Imaizumi A, Fukuda H, Hashimoto T, Wada H, Katanasaka Y, Kakeya H, Fujita M, Hasegawa K, Morimoto T. , "Innovative preparation of curcumin for improved oral bioavailability." Biol Pharm Bull. 2011; 34(5):660-5. https://www.ncbi.nlm.nih.gov/pubmed/21532153
495 Kanai M, Imaizumi A, Otsuka Y, Sasaki H, Hashiguchi M, Tsujiko K, Matsumoto S, Ishiguro H, Chiba T., "Dose-escalation and pharmacokinetic study of nanoparticle curcumin, a potential anticancer agent with improved bioavailability, in healthy human volunteers." Cancer Chemother Pharmacol. 2012 Jan;69(1):65-70. https://www.ncbi.nlm.nih.gov/pubmed/21603867
496 Morimoto T, Sunagawa Y, Katanasaka Y, Hirano S, Namiki M, Watanabe Y, Suzuki H, Doi O, Suzuki K, Yamauchi M, Yokoji T, Miyoshi-Morimoto E, Otsuka Y, Hamada T, Imaizumi A, Nonaka Y, Fuwa T, Teramoto T, Kakeya H, Wada H, Hasegawa K., "Drinkable preparation of Theracurmin exhibits high absorption efficiency--a single-dose, double-blind, 4-way crossover study." Biol Pharm Bull. 2013;36(11):1708-14. https://www.ncbi.nlm.nih.gov/pubmed/24189415
497 Nakagawa Y, Mukai S, Yamada S, Matsuoka M, Tarumi E, Hashimoto T, Tamura C, Imaizumi A, Nishihira J, Nakamura T., "Short-term effects of highly-bioavailable curcumin for treating knee osteoarthritis: a randomized, double-blind, placebo-controlled prospective study." J Orthop Sci. 2014 Nov;19(6):933-9. https://www.ncbi.nlm.nih.gov/pubmed/25308211
498 Tanabe Y, Maeda S, Akazawa N, Zempo-Miyaki A, Choi Y, Ra SG, Imaizumi A, Otsuka Y, Nosaka K., "Attenuation of indirect markers of eccentric exercise-induced muscle damage by curcumin." Eur J Appl Physiol. 2015 Sep;115(9):1949-57. https://www.ncbi.nlm.nih.gov/pubmed/25921600
499 Funamoto M, Sunagawa Y, Katanasaka Y, Miyazaki Y, Imaizumi A, Kakeya H, Yamakage H, Satoh-Asahara N, Komiyama M, Wada H, Hasegawa K, Morimoto T., "Highly absorptive curcumin reduces serum atherosclerotic low-density lipoprotein levels in patients with mild COPD." Int J Chron Obstruct Pulmon Dis. 2016 Aug 26;11:2029-34. https://www.ncbi.nlm.nih.gov/pubmed/27616885
52 Allegri P, Mastromarino A, Neri P. Management of chronic anterior uveitis relapses: efficacy of oral phospholipidic curcumin treatment. Long-term follow-up. Clin. Ophthamol. 41-6, 2010 https://www.ncbi.nlm.nih.gov/pubmed/21060672
55 Appendino G, Belcaro G, Cornelli U, et al. Potential role of curcumin phytosome (Meriva) in controlling the evolution of diabetic microangiopathy. A pilot study. Panminerva Med. 53(Suppl. 1-3):1-7, 2011 https://www.ncbi.nlm.nih.gov/pubmed/22108476
153 Mirzaei H, Shakeri A, Rashidi B, Jalili A, Banikazemi Z, Sahebkar A, "Phytosomal curcumin: A review of pharmacokinetic, experimental and clinical studies." Biomed Pharmacother. 2017 Jan;85:102-112. https://www.ncbi.nlm.nih.gov/pubmed/27930973
191 Belcaro G, Hosoi M, Pellegrini L, Appendino G, Ippolito E, Ricci A, Ledda A, Dugall M, Cesarone MR, Maione C, Ciammaichella G, Genovesi D, Togni S. "A controlled study of a lecithinized delivery system of curcumin (Meriva®) to alleviate the adverse effects of cancer treatment." Phytother Res. 2014 Mar;28(3):444-50. https://www.ncbi.nlm.nih.gov/pubmed/23775598
437 Antiga E, Bonciolini V, Volpi W, Del Bianco E, Caproni M. , "Oral Curcumin (Meriva) Is Effective as an Adjuvant Treatment and Is Able to Reduce IL-22 Serum Levels in Patients with Psoriasis Vulgaris." Biomed Res Int. 2015;2015:283634. https://www.ncbi.nlm.nih.gov/pubmed/26090395
477 Cuomo J, Appendino G, Dern AS, Schneider E, McKinnon TP, Brown MJ, Togni S, Dixon BM. , "Comparative absorption of a standardized curcuminoid mixture and its lecithin formulation." J Nat Prod. 2011 Apr 25; 74(4):664-9. https://www.ncbi.nlm.nih.gov/pubmed/21413691
478 Belcaro G, Cesarone MR, Dugall M, Pellegrini L, Ledda A, Grossi MG, Togni S, Appendino G. , "Product-evaluation registry of Meriva®, a curcumin-phosphatidylcholine complex, for the complementary management of osteoarthritis." Panminerva Med. 2010 Jun;52(2 Suppl 1):33-62. https://www.ncbi.nlm.nih.gov/pubmed/20657536
196 Kuriakose MA, Ramdas K, Dey B, Iyer S, Rajan G, Elango KK, Suresh A, Ravindran D, Kumar RR, R P, Ramachandran S, Kumar NA, Thomas G, Somanathan T, Ravindran HK, Ranganathan K, Katakam SB, Parashuram S, Jayaprakash V, Pillai MR. "A Randomized Double-Blind Placebo-Controlled Phase IIB Trial of Curcumin in Oral Leukoplakia.". Cancer Prev Res (Phila). 2016 Aug;9(8):683-91 https://www.ncbi.nlm.nih.gov/pubmed/27267893
376 Lopresti AL, Maes M, Maker GL, Hood SD, Drummond PD, "Curcumin for the treatment of major depression: A randomised, double-blind, placebo controlled study." J Affect Disord. 2014 Oct;167:368-75. https://www.ncbi.nlm.nih.gov/pubmed/25046624
386 Rainey-Smith SR, Brown BM, Sohrabi HR, Shah T, Goozee KG, Gupta VB, Martins RN, "Curcumin and cognition: a randomised, placebo-controlled, double-blind study of community-dwelling older adults." Br J Nutr. 2016 Jun;115(12):2106-13. https://www.ncbi.nlm.nih.gov/pubmed/27102361
404 Meamarbashi A. , "Herbs and natural supplements in the prevention and treatment of delayed-onset muscle soreness." Avicenna J Phytomed. 2017 Jan-Feb;7(1):16-26. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5329173/
479 Antony B, Merina B, Iyer VS, Judy N, Lennertz K, Joyal S., "A Pilot Cross-Over Study to Evaluate Human Oral Bioavailability of BCM-95CG (Biocurcumax), A Novel Bioenhanced Preparation of Curcumin." Indian J Pharm Sci. 2008 Jul-Aug; 70(4):445-9. https://www.ncbi.nlm.nih.gov/pubmed/20046768
480 Benny M, Antony B. “Bioavailability of BIOCURCUMAXTM (BCM–095TM)”. Spice India. 2006;19:11–15. https://geronova.com/wp-content/uploads/2013/06/Spice_Board.pdf
311 Szymanski MC, Gillum TL, Gould LM, Morin DS, Kuennen MR, "Short term dietary curcumin supplementation reduces gastrointestinal barrier damage and physiological strain responses during exertional heat stress." J Appl Physiol (1985). 2017 Sep 21:jap.00515.2017. https://www.ncbi.nlm.nih.gov/pubmed/28935827
482 Li X, Uehara S, Sawangrat K, Morishita M, Kusamori K, Katsumi H, Sakane T, Yamamoto A. , "Improvement of intestinal absorption of curcumin by cyclodextrins and the mechanisms underlying absorption enhancement." Int J Pharm. 2017 Nov 18;535(1-2):340-349. https://www.ncbi.nlm.nih.gov/pubmed/29157961
483 Purpura M, Lowery RP, Wilson JM, Mannan H, Münch G, Razmovski-Naumovski V. , "Analysis of different innovative formulations of curcumin for improved relative oral bioavailability in human subjects." Eur J Nutr. 2017 Feb 16. https://www.ncbi.nlm.nih.gov/pubmed/28204880
502 Gerloczy A, Hoshino T, Pitha J., "Safety of oral cyclodextrins: effects of hydroxypropyl cyclodextrins, cyclodextrin sulfates and cationic cyclodextrins on steroid balance in rats." J Pharm Sci. 1994 Feb;83(2):193-6. https://www.ncbi.nlm.nih.gov/pubmed/8169787
481 Kulkarni SK, Akula KK, Deshpande J. , "Evaluation of antidepressant-like activity of novel water-soluble curcumin formulations and St. John's wort in behavioral paradigms of despair." Pharmacology. 2012;89:83–90. https://www.ncbi.nlm.nih.gov/pubmed/22343362
500 Jäger R, Lowery RP, Calvanese AV, Joy JM, Purpura M, Wilson JM., "Comparative absorption of curcumin formulations." Nutr J. 2014 Jan 24;13:11. https://www.ncbi.nlm.nih.gov/pubmed/24461029
488 Schiborr C, Kocher A, Behnam D, Jandasek J, Toelstede S, Frank J., "The oral bioavailability of curcumin from micronized powder and liquid micelles is significantly increased in healthy humans and differs between sexes." Mol Nutr Food Res. 2014 Mar;58(3):516-27. https://www.ncbi.nlm.nih.gov/pubmed/24402825
503 Teymouri M, Barati N, Pirro M, Sahebkar A., "Biological and pharmacological evaluation of dimethoxycurcumin: A metabolically stable curcumin analogue with a promising therapeutic potential." J Cell Physiol. 2018 Jan;233(1):124-140. https://www.ncbi.nlm.nih.gov/pubmed/27996095
504 Kunwar A, Barik A, Sandur SK, Indira Priyadarsini K., "Differential antioxidant/pro-oxidant activity of dimethoxycurcumin, a synthetic analogue of curcumin." Free Radic Res. 2011 Aug;45(8):959-65. https://www.ncbi.nlm.nih.gov/pubmed/21615275
505 Arshad L, Haque MA, Abbas Bukhari SN, Jantan I., "An overview of structure-activity relationship studies of curcumin analogs as antioxidant and anti-inflammatory agents." Future Med Chem. 2017 Apr;9(6):605-626. https://www.ncbi.nlm.nih.gov/pubmed/28394628
טבלה 2 – סוגי הפטנט לפי מנגנון הפעולה
לצפיה בטבלה בקובץ PDF לחצו כאן.
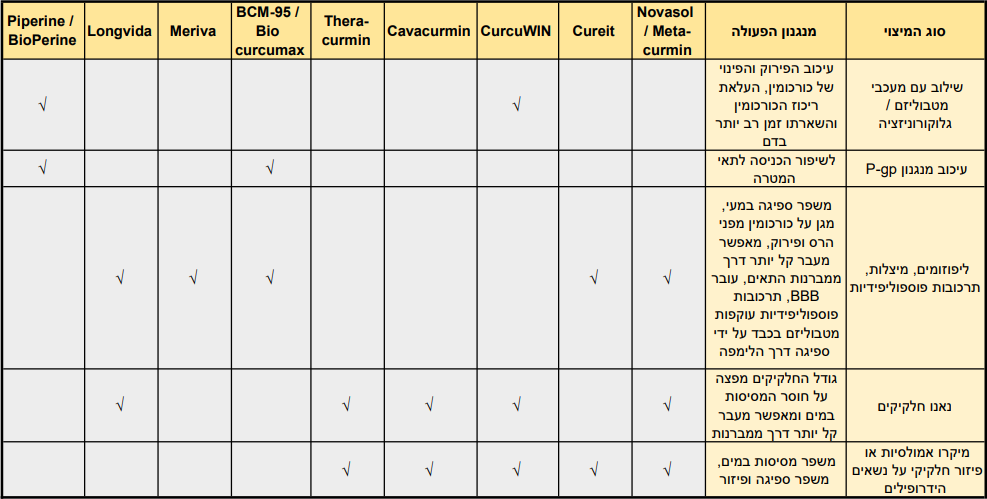
מקורות