כללי | סוגי תרכובות מגנזיום | מקורות תזונתיים | תפקידים פיזיולוגים | פעילות רפואית | התוויות | מינונים | ספיגה והפרשה | תסמיני חוסר | גורמים לחוסר | רגישות | תופעות לוואי | רעילות (עודף) | התוויות נגד | הריון | הנקה | אינטראקציות | מחקרים ומנגנונים | מקורות | נספח 1 - טבלה של תרכובות המגנזיום השונות | נספח 2 - מינונים פרטניים על פי התוויות
כללי
מגנזיום הינו האלמנט השמיני השכיח בקרום כדור הארץ, בצמחים הוא יון מרכזי במולקולות הכלורופיל ובגוף האדם הוא המינרל הרביעי בשכיחותו והשני השכיח בתאים אחרי אשלגן.
המגנזיום משמש כקו-פקטור משמעותי עבור יותר מ-300 תהליכים אנזימתיים, ביוכימיים ומטאבוליים ועל כן חיוני ביותר לתפקוד תקין של מערכות הגוף. מרבית האוכלוסייה בעולם המערבי אינה צורכת כמות דיה של מגנזיום בשל סיבות שונות הכוללות בין השאר עיבוד המזון, חוסר גיוון במזון, מחסור במגנזיום במי השתייה, נטילת תרופות ו/או מחלות כרוניות הפוגעות בתהליכי ספיגת המגנזיום או ברמתו בגוף.
בטבע, יון המגנזיום המתכתי (Mg2), מחובר ליסודות נוספים ויוצר תרכובות שונות, כאשר הנפוצות והחשובות ביותר להפקתו מצויות בעיקר באוקיינוסים ונהרות. בחיבור עם יסודות פחמן או חמצן, נוצרות תרכובות בצורת מלח שאינן אורגניות (מבחינה כימית, לא חקלאית). כאשר מגנזיום נקשר עם יסודות פחמן ומימן (בעיקר בתעשיית התוספים), נוצרות תרכובות אורגניות של מגנזיום עם חומצות שונות, כגון חומצות שומן וחומצות אמינו.
השלמה של מגנזיום לצרכים בריאותיים שונים לרוב מתבצעת באמצעות תוסף תזונה פומי כטבליות או כנוזל.
קיים גם שימוש רפואי במגנזיום כעירוי תוך ורידי מוגבל בזמן, הנחשב כשיטת טיפול יעילה אשר ניתנת במסגרת אשפוז במצבים אקוטים כגון התקפי אסתמה קשים, רעלת הריון והפרעות קצב לב שונות. כמו כן, מוכר גם שימוש חיצוני במגנזיום כשמן/קרם או כפדים.
מונוגרף זה עוסק בעיקר בשימושים הנוגעים לנטילה פומית של התוסף.
סוגי תרכובות מגנזיום:
תוספי המגנזיום השונים נבדלים זה מזה בתפקודם הפיזיולוגי, בזמינות הביולוגית (רמות הספיגה וההפרשה ורמת השימור של המגנזיום בסרום), וכן באופני השימוש ובמחירי העלות של המוצרים השונים.
קיימות בשוק 3 קבוצות של תרכובות מגנזיום:
תרכובות מגנזיום כלאט: תרכובות אורגניות מתכתיות בעלות זמינות ביולוגית גבוהה, בשל חיבורו של יון המגנזיום לשתי חומצות אמינו. היציבות המוגברת של תרכובות אלו מכונה "אפקט הכלציה", והיא מאפשרת להן לשרוד את המעבר בדרכי העיכול בשלמותן, להיספג למחזור הדם במהירות ולחדור את קרומי התא.
דוגמאות לתרכובות כלאט: ל-טרונאט, טאוראט, אורוטאט, אספרטאט, ביסגליצינאט, גליצינאט.
תרכובות מגנזיום אורגניות: תרכובות בעלות זמינות ביולוגית גבוהה, בשל חיבורם של יוני מגנזיום לאטומי פחמן ומימן היוצר תרכובות חומציות. תכונה זו מאפשרת רמת מסיסות גבוהה המגבירה את ריכוז יוני המגנזיום בדרכי העיכול.
דוגמאות לתרכובות אורגניות: פומאראט, מלאט, פידולאט, לקטאט, ציטראט, גלוקונאט, אצטאט.
תרכובות מגנזיום אנאורגניות: תרכובות בעלות זמינות ביולוגית נמוכה, בשל חיבורם של יוני מגנזיום לאטומי פחמן וחמצן, היוצר תרכובות בסיסיות. תכונה זו גורמת לרמת מסיסות נמוכה בדרכי העיכול.
דוגמאות לתרכובות אנאורגניות: כלוריד, אוקסיד, הידרוקסיד, קרבונאט, סולפאט, פוספאט, טריסיליקאט.
*ניתן לראות את כל התרכובות המצויות בשוק ב-נספח 1.
על פי רוב מלחי המגנזיום האורגניים (ובכללם תרכובות כלאט) מסיסים יותר ממלחי המגנזיום האנאורגניים. במחקר מעבדה נמצא כי מבין התרכובות האורגניות, מגנזיום גלוקונאט הינו בעל זמינות ביולוגית גבוהה יותר מסוגי מגנזיום ציטראט, פידולאט, לקטאט, אצטאט ואספרטאט. באשר להבדלים בזמינות הביולוגית בין תרכובות מגנזיום כלאט לתרכובות מגנזיום אורגניות אחרות, לא נערכו מספיק מחקרים על מנת להסיק מסקנות חד משמעיות. לתרכובות מגנזיום כלאט אין השפעה משלשלת גבוהה כמו לתרכובות מגנזיום אורגניות המחוברות לחומצות שומן כדוגמת מגנזיום ציטראט.
לפיכך, בעת בחירת סוג המגנזיום הרצוי, יש להתחשב בעובדה כי לתרכובות אורגניות של מגנזיום השפעה אוסמוטית, המגדילה את נפח הצואה ומגבירה את תנועתיות המעיים. השפעות אלו עלולות באופן תיאורטי להפחית את ספיגת המגנזיום(1-3).
על מנת להשלים את המינון היומי המומלץ אנו ממליצים לצרוך תוספי מגנזיום מסוג תרכובות אורגניות וכלאט המופיעות לעיל. כמו כן, יש לתת את הדעת על יחס המגנזיום בתרכובת ועל סוגי תרכובות (אורגני/אנאורגני) הנבדלים בפעילותם הרפואית, בזמינות הביולוגית ובתופעות הלוואי.
מקורות תזונתיים:
המקור התזונתי של מגנזיום מצוי במזונות מן הצומח, בהם הוא מופיע כיון מרכזי של מולקולת הכלורופיל.
ירקות ירוקים כגון קולורבי, עלי מנגולד, עלי תרד, ברוקולי, סלרי וכד' (המגנזיום נמצא בחלק הירוק בצמח), בטטה, בננות, קטניות (עדשים, שעועית וכד'), מוצרי סויה (בעיקר קמח סויה וטופו), אגוזים וזרעים (שקדים, אגוזי פקאן, ערמונים, שומשום, אגוזי קשיו, אגוזי ברזיל), דגנים מלאים, סובין, נבט חיטה, דוחן, אורז מלא, אבוקדו, משמש מיובש ושוקולד מריר.
* מקור נוסף למגנזיום הינו מי השתייה המהווים כ-20% ממקורות המגנזיום בגוף האדם. מתקני ההתפלה הקיימים בישראל פועלים בשיטה המותירה במים ריכוזים אפסיים של מגנזיום ומינרלים נוספים. שימוש נרחב במים מותפלים בחקלאות, הביא לירידה של 30% בשיעור המגנזיום בעלים של עצי הדר ובפירות וירקות(4).
** הקפאת המזון מפחיתה את כמות המגנזיום שבו. מזון מבושל מאבד כ-70% מהמגנזיום למי הבישול.
תפקידים פיזיולוגיים:
- בעל חשיבות רבה בתהליך הפקת אנרגיה תוך תאית מפירוק פחמימות לגלוקוז, משתתף בתהליכי גליקוליזה ומעגל קרבס ועל כן חיוני לייצור מולקולות (ATP (Adenosine Triphosphate – מולקולת האנרגיה העיקרית בגוף.
- משתתף בתהליכי חילוף החומרים של פחמימות, שומנים וחלבונים.
- משתתף בתהליכי שכפול תאים, סינתזת חלבונים, חומצות גרעין, DNA ו- RNA במיטוכונדריה ומשמש כקו-פקטור בתיקון נזקי ה-DNA.
- מסייע בשמירה על מאזן חוץ ותוך תאי תקין של אלקטרוליטים כגון: סידן, נתרן ואשלגן, החיוניים לייצובה ולתפקודה המבני של הממברנה. באמצעות כך מווסת את רמת חדירותה ומסייע לפעילות בתהליכי היצמדות ונדידת תאים.
- חוסם תעלות סידן, מתחרה עם סידן על אתרי קשירה ואנטגוניסט לקולטן NMDA, אשר לו השפעה על ריכוז הסידן בתאים.
- מעודד ייצור והפרשה של חנקן חד חמצני (NO) בתאי האנדותל (תאים הנמצאים בדפנות כלי הדם), אשר בתורו מביא להרפיית השריר החלק ולהתרחבות של כלי הדם.
- משמש כרכיב מבני ומווסת את ספיגת הסידן בעצמות, חיוני לתאי האוסטאובלאסטים והאוסטאוקלאסטים ולתהליכי שחלוף ובנייה מחודשת של העצם.
- משמש כרכיב חיוני במשאבת נתרן-אשלגן בממברנות התאים. תפקידו לסייע בהוצאת נתרן מהתאים ובהכנסת אשלגן לתוך התאים.
- ממלא תפקיד חשוב במטבוליזם של גלוקוז ואינסולין ומגביר את זיקת האינסולין לקולטניו, בעיקר בשל השפּעתו על האנזים Tyrosine kinase.
- קו-פקטור לאנזימים המעורבים בחילוף החומרים של שומנים (טריגליצרידים, כולסטרול, LDL, HDL). קו-פקטור לאנזים ליפופרוטאין ליפאז אשר אחראי על פירוק טריגליצרידים הנישאים על גבי ליפופרוטאינים לחומצות שומן ולגליצרול ולאחר מכן, מאפשר את קליטתם בכבד ובתאים שונים.
- מגן על תאי הגוף מפני השפּעתם המזיקה של מתכות רעילות כגון אלומיניום, עופרת, קדמיום, בריליום וניקל.
- משתתף בייצור גלוטתיון (נוגד חמצון תאי חשוב).
- מפחית רמות קורטיזול.
- מעורב בסינתזה והפרשה של מתווכים עצביים כגון: סרוטונין, נוראפינפרין ודופמין.
- משפעל את האנזים האחראי על המרה תקינה של ויטמין D מנגזרת (OH) D3) לנגזרתו הפעילה 1,25-OH)2D3).
- נחוץ למטבוליזם ולוויסות פעילות הורמון ה-PTH (הידוע כ-Parathyroid Hormone) המופרש מבלוטת יותרת התריס.
פעילות רפואית:
פעילויות רפואיות מגובות במחקרים (קליניים, בעלי חיים או מעבדה):
משלשל נפח, נוגד עווית, מרחיב כלי דם, מרחיב עורקים כליליים, משכך כאבים, מוריד רמות שומנים/כולסטרול בדם, נוגד קרישה, משפר תפקודי אנדותל, נוגד חמצון, משפר גמישות כלי דם, נוגד דלקת, מאט קצב לב/דופק, מוריד לחץ דם, משפר זיכרון, משפר יכולות למידה, משפר תפקוד קוגניטיבי, נוגד דיכאון, נוגד חרדה, תומך בבניית עצם, מוריד רמות סוכר, משתן אנטיליתי, נוגד כאב, מפחית ליחה.
*העדויות לגבי הפעילויות הרפואיות מוצגות בסעיף מחקרים ומנגנונים
התוויות:
התוויות המגובות במחקרים קליניים*:
עצירות, לחץ דם גבוה, תעוקת חזה, הפרעות קצב לב, אי ספיקת לב, סוכרת (סוג 1, סוג 2), הריון - סוכרת, נוירופתיה סוּכרתית, דילול עצם (אוסטאופורוזיס), שרירים תפוסים, תסמונת הרגל חסרת המנוחה, שיפור ביצועים ספורטיביים, כאבי וסת, תסמונת קדם וסתית (PMS), פיברומיאלגיה (FMS), מיגרנה, הפרעות קשב וריכוז עם היפראקטיביות (ADHD), דיכאון, אבנים בכליות, סיסטיק פיברוזיס. אובדן ונזקי שמיעה (כתוצאה מרעש).
התוויות המגובות במחקרי מעבדה ובעלי חיים*:
אלצהיימר, טרשת עורקים, יכולת למידה לקויה, הפרעות זכרון (טווח קצר וטווח ארוך), הפרעת דחק פוסט טראומטית (PTSD).
התוויות לשימוש חיצוני** (פד מגנזיום, שמן/קרם מגנזיום, מלחי מגנזיום):
תמיכה לאחר לידה (תפרים, בצקות), טחורים.
התוויות לשימוש תוך ורידי המגובות במחקרים קליניים (לא נחקרו כתוסף תזונה):
רעלת הריון (אקלמפסיה ופרה-אקלמפסיה), הפרעות קצב לב (פרפור פרוזדורים, טכיקרדיה חדרית), אסתמה, מחלת ריאה חסימתית כרונית (COPD), שבץ.
*העדויות לגבי ההתוויות הרפואיות מוצגות בסעיף מחקרים ומנגנונים.
**למרות מחסור במחקרים קליניים, קיימות ראיות אמפיריות רבות ליעילות שימוש זה.
מינון פרטני לכל התוויה ניתן למצוא בנספח 2.
מינונים
מינון יומי מומלץ | גבול נטילה | מינון יומי אופטימלי | מינון על פי התוויה
המלצות כלליות לנטילת תוסף מגנזיום
מומלץ ליטול תוסף מגנזיום בשעות הערב לפני השינה עקב השפּעתו מרפת השרירים אשר עלולה לגרום לתחושת עייפות.
במידה ונוטלים תוסף מגנזיום בשילוב עם סידן, יש לשמור על יחס מומלץ של 1:2 לטובת הסידן, כלומר 2 מ"ג של סידן על כל 1 מ"ג מגנזיום, או לכל הפחות יחס של 1:1.
מינון יומי מומלץ של מגנזיום לפי (RDA (RECOMMENDED DAILY ALLOWANCE:
הקצובה היומית המומלצת של מגנזיום. המלצות אלו מתייחסות לצריכה היומית המינימלית המומלצת לאדם בתזונה כדי להימנע ממחלות על רקע חוסרים תזונתיים. מינון RDA מותאם לפי מין וגיל.
קיים מונח נוסף (עדכני יותר) בשם DRI - Dietary Reference Intakes. ה-DRIs מחליפים את ערכי ה-RDA אשר פורסמו ב-1941 על ידי האקדמיה הלאומית למדעים בארה"ב, (FNB (Food and Nutrition Board of the Institute of Medicine.
במקרה של מגנזיום, הערכים לפי שתי ההגדרות שווים.
תינוקות וילדים
|
גילאים
|
מינון יומי
|
|
מלידה עד 6 חודשים
|
30 מ"ג
|
|
7 חודשים עד שנה
|
75 מ"ג
|
|
1-3 שנים
|
80 מ"ג
|
|
4-8 שנים
|
130 מ"ג
|
גברים ונשים
|
גילאים
|
מינון יומי גברים
|
מינון יומי נשים
|
|
9-13 שנים
|
240 מ"ג
|
240 מ"ג
|
|
14-18 שנים
|
410 מ"ג
|
360 מ"ג
|
|
19-30 שנים
|
400 מ"ג
|
310 מ"ג
|
|
31 ומעלה
|
420 מ"ג
|
320 מ"ג
|
|
הריון
|
|
350-400 מ"ג
|
|
הנקה
|
|
310-360 מ"ג
|
* ניתן לחשב מינון מומלץ למבוגר גם לפי 5 מ"ג מגנזיום לכל ק"ג של הגוף.
גבול נטילה - UL - Tolerable Upper Intake Level
גבול הצריכה המירבית לשימוש יומי מקסימלי בתוסף מגנזיום לצורך השלמה של הצריכה התזונתית(5-6), על פי המלצת FNB (הידוע כ-Food and Nutrition Board).
|
גילאים
|
מינון יומי
|
|
1-3 שנים
|
65 מ"ג
|
|
4-8 שנים
|
110 מ"ג
|
|
9-18 שנים
|
350 מ"ג
|
|
+19 שנים
|
350 מ"ג
|
מינון על פי התוויה
למינונים פרטניים ראו את הטבלה ב-נספח 2.
ספיגה והפרשה של מגנזיום:
גוף האדם מכיל בממוצע כ-22.6 גרם מגנזיום, כאשר 99% מתכולתו נאגר בעיקר בעצמות (50-60% נאגר בעצמות בצורת מלח תלת זרחני, המהווה כ-2% ממלחי העצמות), בשרירים, ברקמות רכות ובאיברים נוספים בגוף. 1% מתכולת המגנזיום בגוף נמצא בנוזל החוץ-תאי ורק 0.3% מצוי בסרום, בעיקר בתאי דם אדומים (71% מהמגנזיום בסרום קיים בצורה חופשית ופעילה פיזיולוגית, 22% קשור לאלבומין ו-7% לגלובולין)(8-9).
מאזן תקין של רמות מגנזיום בגוף מווסת על ידי המעיים, העצמות והכליות. תכולת המגנזיום בדיאטה יומית ממוצעת היא כ-300 מ"ג, אשר 25-75% מתוכה נספגים במעיים בהתאם לכמות הנצרכת במזון (כאשר המזון דל במגנזיום הספיגה גבוהה יותר ולהיפך), וכן בהתאם לריכוז המגנזיום בגוף (ככל שרמתו בגוף נמוכה, כך ספיגתו תהיה מוגברת ולהיפך). יתרת המגנזיום שלא נקלטת במעיים מופרשת דרך הצואה.
על מנת שמגנזיום ייספג, תחילה עליו להתנתק מן המולקולות הקשורות אליו ולחזור לצורתו היונית (Mg+2). חומצות הקיבה מפרידות את המגנזיום מהתרכובות עימן הגיע במזון וכך יוני מגנזיום בצורתם החופשית, עוברים מהקיבה, דרך התריסריון לקליטתם במעי.
במעי הדק, המגנזיום נספג בעיקרו באזור האיליום ובחלק הדיאסטלי של הג'ג'ונום (המעי האמצעי), החדירים לקליטה של יונים. ספיגה מועטה של מגנזיום מתרחשת במעי הגס. הקליטה במעי מתאפשרת באמצעות היקשרות המגנזיום לקולטני TRPM דרך תעלות TRPM6 ו-TRPM7 המבוטאות לאורך המעי. מתאי המעי עוברים יוני המגנזיום דרך הקרום הבזאלי, בהתאם למפל הריכוזים ועל ידי שיחלוף עם נתרן, לעבר הנוזל החוץ תאי, שם הם חודרים דרך דפנות כלי הדם אל הסרום.
לעצמות, אשר משמשות כמאגר המגנזיום העיקרי בגוף, תפקיד חשוב במנגנון ההומאוסטאזיס שלו בסרום. בעת מחסור במגנזיום, הגוף תלוי בזמינותו מן העצמות, על מנת לשמור על רמתו הקבועה בסרום.
עיקר הפרשת המגנזיום מתבצעת באמצעות הכליות, אשר מסננות בגלמורולוס כ-2,000-2,400 מ"ג מגנזיום ליום (70% מתכולת המגנזיום בסרום נמצאים בצורה חופשית וזמינה לסינון). בתנאים תקינים, כ-96% מהמגנזיום המסונן יעברו ספיגה חוזרת דרך אבובית הכליה, הלולאה על שם הלנה, האבובית המקורבת (tubulus contortus proximalis) ובטובולי הדיסטלי, בעוד שהאחוזים הנותרים, יופרשו באמצעות השתן (כ-3-5%, 100 מ"ג).
תהליכי הספיגה וההפרשה של מגנזיום מושפעים מגורמים רבים ומהורמונים שונים. הוכח כי ויטמין D כנגזרת פעילה 1,25-OH)2D) עשוי לשפר את ספיגת המגנזיום במעיים ואילו רמות עודפות של אסטרוגן, אינסולין, אלדוסטרון, גלוקגון, קלציטונין והורמון הפאראתאירואיד (PTH) מעודדות להפרשה מוגברת(10-13).
בנוסף, מרכיבים שונים כגון שומנים, זרחן, סידן, ברזל ולקטוז עלולים לעכב את ספיגתו של המינרל ולכן מומלץ שלא לצרוך אותם יחד.
הפרעות ותסמינים עקב חוסר במגנזיום:
היפומגנזמיה או תת-מגנזמיה מתארים מצב של מחסור במגנזיום המאופין ברמות מגנזיום בסרום נמוכות מ-0.75 מילימול/ליטר. אף על פי שהערכת רמות המגנזיום בסרום נחשבת למבחן הנפוץ ביותר לאבחון היפומגנזמיה, ראוי להדגיש כי רמות המגנזיום בסרום לא מאפיינות בהכרח את הרמות בתאים ובעצמות.
תסמינים מוקדמים של חוסר במגנזיום עלולים לכלול: עייפות וחולשה, חולשת שרירים, עוויתות שרירים, בלבול, רעידות, פרכוסים, הפרעות קצב לב, טכיקרדיה חדרית, אובדן תיאבון, בחילות והקאות.
תסמינים מתקדמים של חוסר במגנזיום:
- סיבוכי הריון - רעלת הריון ממאירה וקדם רעלת הריון, לידות מוקדמות ומומים מולדים.
- הפרעות במערכת העצבים והשרירים - חולשת שרירים, התכווצויות שרירים בגפיים ובפנים, רעד בעפעפיים, כיווץ כלי דם, מיגרנה ותגובת יתר לגירוי עצבי-שרירי הכוללת תסמינים כגון רעד חמור באצבעות, בלשון ובעפעפיים, נטייה להתקפי אפילפסיה ועיוות קבוע בשריר.
- הפרעות לב וכלי דם - הפרעות קצב הלב, פרפור חדרים, טרשת עורקים, מחלות לב כליליות ולחץ דם גבוה. בנוסף, חוסר חמור במגנזיום עלול לגרום למוות פתאומי עקב דום לב בקרב צעירים, בעיקר לאחר מאמץ גופני מוגבר.
- הפרעות התנהגותיות ונפשיות - במקרים בהם קיים מחסור מתמשך במגנזיום עלולות להתפתח הפרעות התנהגותיות ונפשיות שונות כגון: עצבנות יתר, ירידה במצב רוח, הפרעות זיכרון, הפרעות שינה, רגישות מוגברת לאור ורעשים, דיכאון, מיגרנה, כאבי ראש, עייפות ואנורקסיה.
- הפרעות פסיכוטיות - חוסר קיצוני של מגנזיום עלול לגרום להופעת מצבים פסיכוטיים שונים, בלבול, הזיות, חוסר התמצאות ועוד.
- היפראקטיביות - חוסר במגנזיום עלול להגביר את הסיכון להיפראקטיביות בקרב ילדים.
- מערכת העיכול - עצירות.
- תסמונת קדם וסתית - חוסר במגנזיום עלול לגרום להחמרה בתסמיני תסמונת קדם וסתית.
- דלדול עצם (אוסטאופניה, אוסטיאופורוזיס) - מחסור מתמשך במגנזיום עלול לגרום לירידה ברמות הסידן בדם. בתגובה, העצמות משחררות סידן לסרום ולאורך זמן רקמת העצם מתדלדלת.
- תסמונת מטאבולית - יתר שומנים בדם (טריגליצרידים וכולסטרול), עמידות לאינסולין וירידה בסבילות לגלוקוז, עמידות להורמון PTH והיפותירואידיזם.
- סיכון מוגבר להתפתחות מחלות שונות - חוסר במגנזיום עלול לגרום לעלייה במתכות רעילות אשר בתורן עלולות לגרום להתפתחות מחלות עצביות שונות כגון פרקינסון, אלצהיימר וטרשת נפוצה. בנוסף, חוסר במינרל עלול להגביר את סיכון לסיבוכי סוכרת (כגון נוירופתיה ובעיות בכלי דם).
גורמים לחוסר במגנזיום:
קיימים גורמים רבים אשר עלולים להביא למחסור במגנזיום(9,10,14):
תזונה דלה במגנזיום - שכיחה בעולם המערבי המתבסס על צריכה מועטה מזונות עשירים במינרל (ירקות, דגנים מלאים וקטניות) ועל צריכה מוגברת של מזונות מעובדים, מזוקקים ומתועשים המכילים כמויות נמוכות של ויטמינים ומינרלים, ביניהם מגנזיום. בנוסף, הירקות הנצרכים כיום אינם מכילים כמות נאותה של מגנזיום מלכתחילה, עקב 2 סיבות עיקריות. ראשית דשן כימי וחומרי הדברה מרווים את הקרקע בחומרים כימיים המונעים ממגנזיום להיספג בגידולים, ושנית כמות המגנזיום במי ההשקיה (בעיקר מותפלים) הינה נמוכה.
הפרעות במערכת העיכול - פגיעה בספיגה ובהפרשה של מגנזיום עקב מספר גורמים:
- HSH) Hypomagnesemia with secondary hypocalciuria) - מחלה הנגרמת בעקבות פגם גנטי תורשתי, המקודד למוטציות בגן TRPM6. מאופיינת בהיפומגנזמיה קשה ומלווה בהיפוקלצמיה.
- שימוש ממושך במעכבי משאבות פרוטונים - תרופות המפחיתות את ייצור החומצה הגסטרית בקיבה. לדוגמה: Omeprazole.
- מחסור תזונתי כללי - צום ממושך, רעב ותזונה דלה במגנזיום.
- הפרעות ספיגה - שלשולים, הקאות מתמשכים או מחלות הגורמות לבעיות ספיגה (כגון צליאק, מחלות מעי דלקתיות וכד').
- פנקריאטיטיס - דלקת לבלב חריפה, הפרעות בעיכול שומנים וצואה שומנית (Steatorrea, חומצות שומן חופשיות לא מעוכלות).
הפרעות בתפקוד הכליות - מגוון מצבים המובילים לכשל כלייתי, אשר בתורו עלול לגרום להפרשה מוגברת של מגנזיום בשתן או ליקוי בתהליך הספיגה המחודשת של המינרל בכליות:
- פגיעה בתפקוד האבובית המקורבת - נגרמת עקב נטילת תרופות כגון: Aminoglycosides, Cisplatin, Pentamide וצריכה עודפת של מלח בתזונה. בנוסף, ייתכן מצב של נמק בצינורית בעקבות שימוש בתרופות נפרוטוקסיות כגון: Gentamycin, Amphotericin B, Pentamidine, Cisplatin, Tacrolimus, Cyclosporine.
- פגיעה בתפקוד לולאת הלנה - נגרמת עקב נטילת משתני לולאה, מוטציות בתעלת האשלגן והכלור, פגיעה בגן Claudin, תסמונת ברטר וגיטלמן (עלייה ברמות PH ורמות ביקרבונאט בדם והפרשה מוגברת של סידן בשתן), הפרעה בהעברה הבין תאית בתעלות אשלגן-נתרן-כלוריד.
- סוכרת - הפרשה מוגברת של מגנזיום בשתן כניסיון של הכליות לסנן רמות גבוהות של גלוקוז בדם, על מנת לתקן מצב של היפרגליקמיה.
- סינון יתר (היפרפילטרציה) - עלול להיגרם בעקבות סוכרת, דלקת אקוטית וחמצת מטאבולית.
- היפרקלצמיה - רמות גבוהות של סידן. סידן מתחרה עם מגנזיום על אתרי קשירה.
- תרופות - משתני לולאה הפועלים דרך הלולאה על שם הלנה ותיאזידים הפועלים דרך אבובית המרוחקת (הטובול הדיסטלי המפותל).
- אלכוהול - צריכה מוגברת של אלכוהול עלולה לגרום להפרשה מוגברת של מגנזיום בשתן.
רמות עודפות של הורמונים
רמות גבוהות של וזופרסין (Antidiuretic Hormone, ADH) - הורמון נוגד השתנה המופרש מבלוטת יותרת המוח ואחראי על ויסות הפרשת שתן ביחס לכמות מלחים בדם ונוזלים בגוף. רמות גבוהות של הורמון זה מופרשות במגוון מצבים (גידולים בהיפופיזה, מחלות כלי דם, דלקת ריאות, שחפת ריאתית, תסמונת ג'יליאן ברה, התייבשות, ירידה בלחץ הדם, חבלה וטראומה גופנית כולל ניתוח), ועלולות להגביר את הפרשת המגנזיום בשתן.
רמות גבוהות של גלוקגון וקלציטונין - גלוקגון מופרש מהלבלב בתגובה לירידה ברמות סוכר בדם. קלציטונין מופרש מבלוטת התריס כתגובה לעלייה ברמות הסידן בדם. רמות גבוהות של כל אחד מן ההורמונים הללו מגבירות את הפרשת המגנזיום בשתן.
רמות גבוהות של הורמוני מין סינתטיים - שימוש בתחליפים הורמונליים לאסטרוגן ובגלולות למניעת הריון, עלול להפחית רמות מגנזיום בסרום.
היפוקלצמיה והיפרקלצמיה – יוני הסידן והמגנזיום מתחרים זה עם זה על אתרי ספיגה במעי, לפיכך רמות גבוהות של סידן יפריעו לספיגת המגנזיום ויגבירו את ההפרשתו בשתן. כמו כן, מחסור כרוני במגנזיום עלול לעכב את הפרשת הורמון PTH ולגרום להיפוקלצמיה.
היפוקלמיה - רמות נמוכות של אשלגן מקושרות עם רמות נמוכות של מגנזיום, ככל הנראה בשל מנגנון ספיגה והפרשה משותף הקשור בתעלות אשלגן-נתרן.
מתח נפשי - מתח נפשי מוגבר ו/או מתמשך עלול לגרום לצריכה מוגברת של מגנזיום בתאי הגוף וכתוצאה מכך לחוסר בו.
היפומגנזמיה משפחתית - תורשה אוטוזומלית רצסיבית. מוטציות בגן המקודד לחלבון TRPM6 מובילות לספיגה ירודה של מגנזיום במעי ולהפרשה מוגברת שלו דרך הכליות.
תרופות הפוגעות בספיגה ומעודדות הפרשה של מגנזיום - ראה תגובות הדדיות עם תרופות.
מאמץ גופני מוגבר - פעילות גופנית מאומצת וממושכת גורמת לייצור מוגבר של אנרגיה, אשר דורש כמויות גבוהות של מגנזיום. כמו כן, המאמץ מגביר כניסה של מגנזיום מהדם אל התאים (פגיעה ברמתו בדם), להפרשה מוגברת של המינרל דרך הזיעה ולהפרשה של אדרנלין המגבירה הפרשה של המינרל בשתן.
רגישות
לא ידועה רגישות למגנזיום.
תופעות לוואי
בדרך כלל צריכת מגנזיום ממקורות תזונתיים אינה גורמות לתופעות לוואי לעומת צריכת מגנזיום כתוסף. עם זאת, במחקרים אפידמיולוגיים ובמחקר שנערך בקרב בעלי חיים, נמצא כי חשיפה יתרה בתדירות גבוהה למגנזיום ממקורות תזונתיים, עלולה לגרום להפרעות בבלוטת התריס(15).
תופעות לוואי לשימוש פומי בתוסף מגנזיום - הפרעות ב למידע השלם למנויים
תופעות לוואי לשימוש תוך ורידי בתוסף מגנזיום - למידע השלם למנויים
עודף של מגנזיום (רעילות):
רמות גבוהות של מגנזיום בתזונה אינן מהוות סיכון בריאותי כלל ורעילות כתוצאה מנטילת מגנזיום במינונים מאוזנים, הינה נדירה. עם זאת, צריכת מינונים גבוהים של מגנזיום בתוסף פומי, או תוך ורידי עלולה להוביל לרעילות ולתופעות לוואי קשות.
היפרמגנזמיה מתאר מצב של עודף מגנזיום בדם ומוגדר כאשר רמות המגנזיום בסרום גבוהות מ-mmol/L 1.74-2.61. זהו מצב נדיר, אך עלול להימצא בקרב למידע השלם למנויים
תופעות נלוות למצבי עודף מגנזיום כוללות: למידע השלם למנויים
גורמים אפשריים להיפרמגנזמיה שנמצאו במחקרים קליניים:
- אי ספיקת כליות(17).
- מינון יתר של מגנזיום כתוסף פומי ותרופות המכילות מגנזיום כגון משלשלים(18) וסותרי חומצה(9).
- מינון יתר של מגנזיום תוך ורידי(19).
- מתן מגנזיום תוך ורידי לטיפול בהתקפי אקלמפסיה אקוטיים(20-21).
התוויות נגד לשימוש במגנזיום:
יש לנקוט זהירות בנטילת מגנזיום לאחר אבחנה של הפרעות בלב (למשל: הפרעות קצב והפרעות בהולכה חשמלית), הפרעות בכליות (למשל: אי ספיקת כליות ומחלת כליות סופנית) והפרעות במערכת העיכול (חסימות מעיים ומחלות מעיים שונות). במידה ויש צורך רפואי לנטילת מגנזיום, יש להתייעץ עם הרופא המטפל(22).
הריון
ניתן ואף רצוי לצרוך מגנזיום כתוסף תזונה בתקופת ההריון.
הריון הוא מצב פיזיולוגי הדורש רמות מוגברות של מגנזיום. הגורמים העיקריים לדרישה המוגברת כוללים למידע השלם למנויים
תסמיני חסר במגנזיום כגון התכווצויות שרירים והתכווצויות רחם בתקופת ההריון ניתנים לטיפול באמצעות למידע השלם למנויים
על פי המלצות Journal of Pregnancy and Child Health, כל אישה בהריון צריכה ליטול תוסף מגנזיום במינון של למידע השלם למנויים
הנקה
ניתן לצרוך מגנזיום כתוסף תזונה בתקופת ההנקה. יחד עם זאת, בהעדר סיבה בריאותית מוצדקת לנטילה, מוטב להימנע.
RDA של מגנזיום עבור נשים מניקות הינו 310-360 מ"ג(5).
מגנזיום נמצא בטוח לשימוש כתוסף תזונה בקרב נשים הרות ומניקות, כאשר ניתן במינון נמוך מהקצובה המירבית (UL) העומדת על 350 מ"ג ליום, בעוד מינונים גבוהים יותר עלולים לגרום לשלשולים ואף לירידה בהפרשת החלב וביכולת ההנקה, כפי שנמצא במחקר קליני מבוקר(31), בעת נטילת תוסף מגנזיום Aspartate במינון ממוצע של 460 מ"ג ליום למשך 4 שבועות. השערת החוקרים היא כי מגנזיום עלול לעכב את הפרשת ההורמון פרולקטין.
תגובות הדדיות עם תרופות / צמחי מרפא / תוספי תזונה:
חילוף חומרים תרופתי
מגנזיום הוא אחד התוספים הנחקרים ביותר, ונערכו מחקרים רבים המשלבים מגנזיום עם תרופות שונות. במרבית המחקרים נעשה שימוש בתוספי מגנזיום כתרכובות אנאורגניות.
ניטרול חומציות הקיבה באמצעות תוספי מגנזיום אנאורגניים כגון: מגנזיום הידרוקסיד, אוקסיד, סולפאט וטריסיליקאט המעלים את רמת ה-pH בקיבה, עלול לשנות את למידע השלם למנויים
אנטִיביוטיקה
יש להימנע משילוב של תוסף מגנזיום עם אנטיביוטיקות שונות, בשל פגיעה אפשרית בזמינותן הביולוגית ובספיגתן, כמפורט להלן:
אמינוגלִיקוזידים
תרופות מקבוצה זו:
Amikacin (Amikin, Fresenius), Gentamicin (Garamycin, Gentatrim, Jenamicin, Opti-Genta), Kanamycin (Kantrex), Neomycin (Neomycin, Mycifradin, Myciguent, Nro-Fradin, Neo-Tab, Nivemycin), Netilmicn (Netromycin), Paromomycin (Monomycin, Humatin, Leshcutan), Tobramycin (Nebcin, Tobi, Tobrex, TobraDex, Bramitob, Zylet), Streptomycin (Streptomycin)
במחקר שנערך בקרב עכברים, נמצא כי למידע השלם למנויים
פלואורוקווינולים
תרופות מקבוצה זו:
Ciprofloxacin (Ciloxan, Cipro, Ciprodex), Cinoxacin (Cinobac, Pulvules), Enoxacin (Penetrex), Gatifloxacin (Tequin), Levofloxacin (Levaquin), Ofloxacin (Floxin), Lomefloxin (maxaquin), Moxifloxacin (Avelox), Norflaxin (Noroxin), Ofloxacin (Floxin, Ocuflox), Sparfloxacin (Zagam), Trovafloxacin (Alatrofloxacin, Trovan)
במחקר קליני נמצא כי הזמינות הביולוגית של למידע השלם למנויים
מקרולידים
תרופות מקבוצה זו:
Azithromycin (Azenil, Zeto, Zithromax), Clarithromycin (Biaxin, Karin, Klacid, Klaridex), Dirithromycin (Dynabac), Erythromycin (Acnetrim, Erythrocin, Aknemycin), Nitrofurantoin (Macrodantin, Uvamin)
במחקר קליני שנערך בקרב 6 גברים בריאים, נטילת למידע השלם למנויים
טטרציקלינים
תרופות מקבוצה זו:
Demeclocycline (Declomycin), Doxycycline (Vibramycin, Atridox, Doryx, Doxy, Monodox), Minocycline (Minocin, Fynacin, Vectrin), Tetracycline (Achromycin, Sumycin, Actisite, Apo-Tetra, Tetracyn)
מגנזיום בשילוב עם תרופות אלו עלול ליצור למידע השלם למנויים
תרופות נוגדות פטריות
יש לנקוט זהירות בשילוב תוסף מגנזיום עם תרופות אלו בשל ראיות סותרות במחקרים ולבחון כל מקרה לגופו, כמפורט להלן:
(Amphotericin B (Fungilin
ניתן ואף רצוי לשלב תוסף מגנזיום עם Amphotericin B.
פגיעה בתפקוד הכליות הנחשבת כתופעת לוואי של נטילת התרופה, עלולה להפריע ל למידע השלם למנויים
(Itraconazole (Sporanox
יש להימנע משילוב מגנזיום עם Itraconazole.
במחקר קליני, נטילת 200 מ"ג Itraconazole בשילוב עם למידע השלם למנויים
תרופות נוגדות וִירוסים
אין מניעה לשלב תוסף מגנזיום עם תרופות אלו, כמפורט להלן:
(Foscarnet (Foscavir
אין מניעה לשלב תוסף מגנזיום עם תרופה זו.
Foscarnet נקשרת ליון המגנזיום, מגבירה את הפרשתו בשתן ומפחיתה את רמתו בסרום(41). מינון של למידע השלם למנויים
(Ribavirim (Rebetol, Copegus
אין מניעה לשלב תוסף מגנזיום עם תרופה זו.
התרופה ניתנת בעיקר כטיפול בדלקת כבד נגיפית מסוג C ועלולה לגרום למידע השלם למנויים
כימותרפיה מסוג (Cisplatin (Abiplatin
ניתן ואף רצוי לשלב תוסף מגנזיום עם התרופה על מנת למנוע היפומגנזמיה(44).
Cisplatin עלולה לפגוע בתפקוד הכליות ולהוביל להפרעה בספיגת החוזרת של מגנזיום ולהפרשה מוגברת שלו בשתן עד לכדי היפומגנזמיה(45-46).
תרופות ביולוגיות מסוג (Panitumumab (Vectibix), Cetuximab (Erbitux
למידע השלם למנויים
תרופות מדכאות חיסון - (Cyclosporin (Sandimmun, Deximune, Restasis
למידע השלם למנויים
תרופות מרחיבות סימפונות
אין מניעה ואף רצוי לשלב מגנזיום עם חלק מתרופות אלו, כמפורט להלן:
אגוניסטים קצרי טווח לקולטני בטא 2 אדרנרגיים
תרופות מקבוצה זו: (Albuterol (Salbutamol, Ventolin, Salbutrim
ניתן ואף רצוי לשלב תוסף מגנזיום עם תרופות אלו.
במחקרים קליניים נמצא כי למידע השלם למנויים
אגוניסטים ארוכי טווח לקולטני בטא 2 אדרנרגיים
תרופות מקבוצה זו:
Bitolterol (Tornalate), Pirbuterol (Maxair), Levalbuterol (Xopenex), Metaproterenol (Alupent), Salmeterol (Serevent), Terbutaline (Brethine, Brethair, Bricanyl), Isoetharine (Arm-A-Med, Bronkosol, Bronkometer)
למידע השלם למנויים
סטרואידים
תרופות מקבוצה זו:
Dexamethasone (Dexacort), Prednisone (Prednisone), Prednisolone (Danalone, Pred-forte)
למידע השלם למנויים
תרופות משתנות
קיימים מספר סוגים של תרופות משתנות. יש לבחון כל מקרה לגופו, כמפורט להלן:
משתני לולאה
תרופות מקבוצה זו:
Bumetanide (Bumex), Ethacrynic acid (Edecrin), furosemide (Lasix), Torsemide (Demadex)
ניתן ואף רצוי לשלב תוסף מגנזיום עם תרופות אלו(70-71).
תרופות אלו מעכבות את למידע השלם למנויים
משתנים תיאזידים
תרופות מקבוצה זו: (Chlorothiazide (Diuril), Hydrochlorothiazide (Esidrix, HydroDiuril Disothiazid
ניתן ואף רצוי לשלב תוסף מגנזיום עם תרופות אלו(75-76).
תרופות אלו מעכבות את למידע השלם למנויים
משתנים אוגרי אשלגן
תרופות מקבוצה זו:
Triamterene (Dyrenium), Spironolactone (Aldactone), Amiloride (Amiloride, Midamor, Hydrocloride)
יש לנקוט זהירות בשילוב תוסף מגנזיום עם תרופות אלו.
תרופות אלו עשויות להגביר את למידע השלם למנויים
תרופות חוסמות תעלות סִידן
תרופות מקבוצה זו:
Felodipine (Plendil), Nifedipine (Adalat, Procardia), Amlodipine (Norvasc), Lercanidipine (Zanidip), Lerdadipine (Vasodip, lercapress)
יש לנקוט זהירות בשילוב תוסף מגנזיום עם תרופות אלו ולהקפיד על ניטור פעילות הלב כאשר יש צורך בשילוב(78).
תרופות אלו, כמו גם מגנזיום, מעכבות למידע השלם למנויים
תרופות קושרות אשְלגן
תרופות מקבוצה זו: Sodium polystyrene sulfonate (Kayexalate)/Tolevamer
ניתן ואף רצוי לשלב תוסף מגנזיום עם תרופות אלו.
תרופות אלו מיועדות לטיפול במצב של עודף אשלגן (היפרקלמיה) ומובילות לעלייה משמעותית ברמות הנתרן ולירידה ברמות המגנזיום(82).
תרופות נוגדות קרישה
יש לנקוט זהירות בשילוב מגנזיום עם תרופות אלו, כמפורט להלן.
מגנזיום עלול ליצור תגובה הדדית גם עם צמחי מרפא להם פעילות נוגדת קרישה.
(Warfarin (Coumadin
אין מניעה לשלב תוסף מגנזיום עם תרופה זו, אך יש לנקוט זהירות בשילוב ולהפריד למידע השלם למנויים
(Acetylsalicylic acid (Aspirin
יש לנקוט זהירות בשילוב מגנזיום עם תרופה זו.
מחקרים קלינים מצביעים על אפשרות לפעילות סינרגיסטית.
במחקר קליני מבוקר פלסבו שנערך בקרב 42 חולים עם מחלת עורקים כלילית, נטילת מגנזיום אוקסיד במינון 800-1,200 מ"ג בשילוב עם אספירין, הפחיתה ב למידע השלם למנויים
תרופות להורדת סוכר
ניתן ואף רצוי לשלב תוסף מגנזיום עם תרופות אלו, כמפורט להלן, אך יש לנקוט זהירות בשימוש.
רצוי לנטר את רמת התרופה בדם או לעקוב אחר רמת הסוכר בדם מחשש להיפוגליקמיה.
סולפונילאוריאה (Sulfonylurea)
תרופות ממשפחה זו: (Glibenclamide (Gluben, Glibetic, Glyburide) ,Glipizide (Glucotrol.
ניתן ואף רצוי לשלב תוסף מגנזיום עם תרופות אלו, אך יש לנקוט זהירות בשימוש.
רצוי לנטר את רמת התרופה בדם או לעקוב אחר רמת הסוכר בדם מחשש להיפוגליקמיה.
במחקרים קליניים נמצא כי למידע השלם למנויים
אינסולין
ניתן ואף רצוי לשלב תוסף מגנזיום עם אינסולין, אך יש לנקוט זהירות בשימוש. רצוי לעקוב אחר רמת הסוכר בדם מחשש להיפוגליקמיה.
מגנזיום עשוי להגביר את פעילות האינסולין(91). במחקר קליני שנערך בקרב חולי סוכרת סוג 1 המזריקים אינסולין, מגנזיום הידרוקסיד במינון 500 מ"ג למידע השלם למנויים
תרופות להורדת כולסטרול
אין מניעה לשילוב מגנזיום עם תרופות אלו, כמפורט להלן:
סטטינים
תרופות מקבוצה זו:Atorvastatin, Rosuvastatin, Simvastatin, Pravastatin, Fluvastatin, Lovastatin
אין מניעה לשלב מגנזיום עם תרופות ממשפחת הסטטינים, אך יש לנקוט זהירות בשילוב עם תוספי מגנזיום מתרכובות אנאורגניות מחשש להפרעות בספיגת התרופה.
במחקר קליני שנערך בקרב 23 חולי סוכרת שאינה תלוית אינסולין, נמצא כי נטילת התרופה Simvastatin במינון של 10 מ"ג ליום למשך 4 חודשים, הפחיתה את רמות המגנזיום בסרום ב-0.02 מילימול/ליטר ובעקבות כך נצפתה עלייה של 17% בריכוז הגלוקוז בסרום(93).
למרות היעדר ראיות קליניות, בסקירה נרחבת אשר בחנה את ההשפעות של מגנזיום כחלק מטיפול במחלות לב וכלי דם, מסקנת החוקרים הייתה כי נטילת מגנזיום בשילוב עם סטטינים עשויה באופן תיאורטי להגביר את היעילות הטיפולית של הסטטינים עקב תגובה הדדית אפשרית, הקשורה בעיכוב האנזים HMG-CoA רדוקטאז והפחתת רמות כולסטרול(94).
מנגד, חשוב לציין כי במחקר קליני(95) נוסף נמצא כי תרופה סותרת חומצה המכילה מגנזיום הידרוקסיד (תרכובת אנאורגנית) ואלומיניום הידרוקסיד, הפחיתה את ספיגת התרופה Rosuvastatin ב-50%. כאשר ניטלו במשולב, סותר החומצה הפחית את הריכוז של Rosuvastatin ב-54% ואת ריכוז התרופה בסרום ביחס לזמן (AUC). כמו כן, סותר החומצה הפחית ב-50% את הריכוז המקסימלי של התרופה בסרום (Cmax). כאשר המשתתפים נטלו את סותר החומצה לאחר שעתיים משנטלו את Rosuvastatin, סותר החומצה הפחית את AUC של Rosuvastatin ב-22% וב-16% את Cmax.
(Colestyramine (Questran
אין מניעה לשילוב מגנזיום עם תרופה זו.
במחקר שנערך בקרב בעלי חיים, התרופה הגבירה את הפרשת המגנזיום בשתן(96).
לא ברורה הרלוונטיות הקלינית של ממצאים אלו.
הפרעות קצב ואִי ספיקת לב (Digoxine (Digoxin, Lanoxin
ניתן ואף רצוי לשלב מגנזיום עם תרופה זו, אך יש לנקוט זהירות בשילוב עם תוספי מגנזיום מתרכובות אנאורגניות מחשש להפרעות בספיגת התרופה.
נטילת התרופה עלולה ל למידע השלם למנויים
חוסמי בטא
תרופות ממשפחה זו: Sotalol, Atenolol, Metoprolol (Lopressor, Toprol), Pindolol, Timolol , Propranolol
יש לנקוט זהירות בשילוב תוסף מגנזיום עם תרופה אלו, בשל השפעות סותרות במחקרים.
מחד, השילוב עלול לפגוע בספיגת התרופה ובזמינותה הביולוגית. לראיה, במחקר קליני אקראי ומבוקר נמצא כי למידע השלם למנויים
מאידך, השילוב עשוי להפחית את תופעות הלוואי של התרופה ולהגביר באופן תיאורטי את יעילותה הטיפולית. כך למשל במחקר קליני אקראי מבוקר, נמצא כי למידע השלם למנויים
Quinidine
יש להימנע משילוב של מגנזיום כתוסף פומי עם התרופה, בשל חשש תיאורטי לפגיעה בספיגת התרופה.
במחקר שנערך בקרב בעלי חיים נמצא כי למידע השלם למנויים
תרופות הורמונליות
ניתן ואף רצוי לשלב מגנזיום עם תרופות אלו.
נטילת תחליפי אסטרוגן וגלולות למניעת הריון משפרת למידע השלם למנויים
ביספוספונאטים
תרופות ממשפחה זו:
Alendronate (Fosamax), Risedronate (Actonel), Etidronate (Didronel), Tiludronate (Skelid)
יש לנקוט זהירות בשילוב מגנזיום עם תרופות אלו.
במחקר שנערך בקרב בעלי חיים למידע השלם למנויים
סותרי חומצה
קיימים מספר סוגים של סותרי חומצה. יש לבחון כל מקרה לגופו, כמפורט להלן:
מעכבי משאבות פרוטונים/מימן (PPI - Proton pump inhibitors)
תרופות מקבוצה זו:
Lansoprazole, Dexlansoprazole, Esomeprazole Pantoprazole, Rabeprazole, Omeprazole (Omeprazole, Omepradex, Losec)
אין מניעה בשילוב תוסף מגנזיום עם תרופות אלו.
במספר דיווחי מקרה, שימוש ארוך טווח בתרופות PPI למידע השלם למנויים
אנטגוניסטים לקולטני היסטמין (H2)
תרופות ממשפחה זו: (Famotidine (Famo, Gastro) ,Ranitidine (Zantac, Zanidex.
ש לנקוט זהירות בשילוב תוסף מגנזיום עם תרופה זו.
במחקר קליני(116) נמצא כי שילוב מגנזיום הידרוקסיד עם התרופה ,Ranitidine למידע השלם למנויים
(Misoprostol (Cytotec
יש לנקוט זהירות בשילוב מגנזיום עם תרופה זו.
שלשולים הינם תופעת לוואי שכיחה בקרב אנשים הנוטלים תרופה זו וקיימת השערה תיאורטית כי נטילת התרופה בשילוב עם מגנזיום עלולה להחריף את השלשולים(117).
תרופות משככות כאב (Fentanyl (Durogesic, Fenta, Beatryl, Actiq
אין מניעה לשלב מגנזיום עם תרופות אלו.
במחקר קליני רנדומלי מבוקר וכפול סמיות, נמצא כי למידע השלם למנויים
נוגדי דלקת שאינם סטרואידים - NSAID's
תרופות ממשפחה זו: (Ibuproen (Advil, Nurofen, Adex
ש לנקוט זהירות בשילוב מגנזיום עם תרופות אלו.
נטילה של תרופות מקבוצה זו בשילוב עם מגנזיום הידרוקסיד יוצרת למידע השלם למנויים
ריטלין - Methylphenidate (Ritalin, Concerta), Amphetamine
ניתן ואף רצוי לשלב מגנזיום עם תרופות אלו.
נטילת מגנזיום בשילוב עם תרופות מקבוצת האמפטמינים, הנחשבות כבעלות PH בסיסי, עשויה למידע השלם למנויים
ליתיום (Lithium (Licarbium
יש לנקוט זהירות בשילוב מגנזיום עם תרופה זו.
במחקר מעבדה נמצא כי נטילת התרופה, המשמשת לטיפול בהפרעות דו קוטביות, עלולה למידע השלם למנויים
נוגדי פרכוסים (Gִabapentin (Neurontin
יש להימנע משילוב מגנזיום עם תרופה זו.
תרופה זו הינה נוגדת פרכוסים ומשמשת לטיפול בכאבים נוירולוגיים שונים. במחקר קליני נמצא כי למידע השלם למנויים
הרפיית שרירים
תרופות מקבוצה זו:
Rocuronium (Zemuron, Esmeron), Rapacuronium (Raplon), Mivacurium (Mivacron), Vecuronium (Norcuron), Cisatracurium (Nimbex), Atracurium (Tracrium), Pancuronium (Pavulon)
יש לנקוט זהירות בשילוב מגנזיום עם תרופות אלו.
במספר מחקרים קליניים ודיווח מקרה אחד(124-128) נמצא כי למידע השלם למנויים
טיפול בהרעלת מתכות (Penicillamine (Cuprimin
יש לנקוט זהירות בשילוב מגנזיום עם תרופה זו.
Penicillamine יוצר תרכובות כלאט עם מינרלים שונים, מעכב את ספיגתם ומפחית את זמינותם הביולוגית. נטילה של מגנזיום בשילוב עם תרופה זו למידע השלם למנויים
הורמונים סינתטיים לבלוטת התריס (Levothyroxine (Eltroxin, Euthyrox, Synthroid
יש להימנע משילוב מגנזיום עם תרופה זו.
על פי מחקרי מעבדה, נטילה של תרופות מקבוצה זו בשילוב עם תוסף מגנזיום למידע השלם למנויים
צמחי מרפא נוגדי קרישה
קיים חשש תיאורטי בנוגע לשילוב מגנזיום יחד עם צמחי מרפא נוגדי קרישה המשפיעים על היצמדות הטסיות. במספר מחקרים נצפתה השפעה מעכבת צימות טסיות של מגנזיום(88,134-135). שילובו עם צמחי מרפא בעלי פעילות דומה יכול באופן תיאורטי להגביר את היעילות הטיפולית של השניים ועלול להגביר את הסיכון לדימומים. לרשימת צמחי מרפא שנמצאו במחקרים כבעלי השפעה נוגדת קרישה והיצמדות טסיות – לחץ כאן.
ויִטמין Bִ6
ניתן ואף רצוי לשלב מגנזיום עם ויטמין B6.
לויטמין B6 תפקיד בהעברת יוני המגנזיום מזרם הדם לתוך התאים ובשינוע יוני המגנזיום על גבי קרומי התא. בנוסף נמצא כי הויטמין משפר ספיגה של מגנזיום ועשוי להגדיל את ריכוז המגנזיום בתאי הדם האדומים. כמו כן, מגנזיום חיוני להפיכת הויטמין לנגזרתו הפעילה ונטילה משולבת משפרת את היעילות הטיפולית שלהם(136-137).
וִיטמין D
ניתן ואף רצוי לשלב מגנזיום עם ויטמין D.
ויטמין D מסייע לספיגה של מגנזיום במעי הדק ומשפר את זמינותו הביולוגית(138). במחקרים רבים נמצא כי נגזרות שונות של ויטמין D כגון: ergocalciferol, 25-hydroxyergocalciferol, 25-hydroxycholecalciferol (calcifediol), and 1,25-dihydroxycholecalciferol (calcitriol), מסייעות לספיגת המגנזיום, בפרט כאשר הן ניטלות במינונים גבוהים. כמו כן, נטילה משולבת עשויה לסייע בטיפול בהיפומגנזמיה בקרב הנוטים להפרעות ספיגה(139-142).
במחקר כפול-סמיות מבוקר פלסבו(542) נבדקה ההשערה לפיה ההשפעה של תוספי מגנזיום על המטבוליזם של ויטמין D תלויה ברמת ויטמין D בגוף [25(OH)(D)]. במחקר נכללו 180 משתתפים בגילאי 40-85, המהווים חלק ממחקר גדול יותר העוסק במניעת סרטן קולורקטלי. המשתתפים חולקו אקראית לנטילת תוסף מגנזיום או פלסבו, כאשר המינון הותאם אישית בהתאם לצריכה התזונתית.
כמשוער, נמצא כי הקשר בין מגנזיום ורמת ויטמין D בגוף היה תלוי ברמת הבסיס של ויטמין D. באופן ספציפי, נטילת תוספי מגנזיום הייתה מלווה בעלייה ברמת ויטמין [D [25(OH)D3 כאשר רמת הבסיס הייתה כ-30 ננוגרם/מ"ל, ובירידה ברמת ויטמין D כאשר רמת הבסיס הייתה 30-50 ננוגרם/מ"ל. כמו כן, למגנזיום הייתה השפעה גם על השינוי ברמת ויטמין D בצורת [24,25(OH(D3] ו-[25(OH(D2]. החוקרים מסכמים כי לשמירה על רמת מגנזיום אופטימאלית חשיבות לשמירה על רמת ויטמין D תקינה.
אשְלגן
ניתן ואף רצוי לשלב תוסף מגנזיום עם אשלגן.
מחסור באשלגן ומחסור במגנזיום קשורים זה בזה. במחקר שנערך בקרב בעלי חיים נמצא כי תזונה דלה במגנזיום מפחיתה את רמות האשלגן בשרירים ובתאים, גם לאחר מתן אשלגן כתוסף(143). בקרב חולי אי ספיקת לב אשר טופלו במשתנים תיאזידים, נצפתה ירידה של 50% ברמות האשלגן ו-42% ברמות המגנזיום. ירידה זו מגבירה סיכון להפרעות קצב לב ולתמותה. מתן מגנזיום בעירוי הגביר את רמות האשלגן והמגנזיום בשרירים והפחית תדירות של טכיקרדיה פרוזדורית(144). נטילת תוסף פומי של מגנזיום למשך 6 חודשים, נחוצה ויעילה לטיפול ברמות נמוכות של אשלגן(145) ובנוסף נטילה משולבת של התוספים נמצאה בטוחה לשימוש(146).
סִידן
יוני מגנזיום וסידן מתחרים זה עם זה על אתרי ספיגה במעי(141). עם זאת, לתוספי מגנזיום אין כל השפעה על ספיגת תוספי הסידן. מנגד, תוספי סידן עלולים להפחית את הספיגה של תוספי מגנזיום במעי ולהוביל להפרשת מגנזיום בשתן כשנלקחים במינון גבוה של כ-2,600 מ"ג ליום. בקרב אנשים עם רמות נאותות של מגנזיום, תוספי הסידן לא ישפיעו במידה משמעותית על ספיגת המגנזיום(147-149). היחס הכולל המומלץ של 2:1 בין סידן למגנזיום (לטובת הסידן), הוצע בעבר על מנת להזהיר מפני רמות גבוהות של סידן ביחס לרמות נמוכות של מגנזיום והקשר בין יחס זה למחלות לב וכלי דם(150). כיום בעקבות העובדה שרוב האנשים אינם צורכים את הדרישה היומית הממוצעת של מגנזיום, קיימת הנחה כי היחס של 2:1 בין סידן למגנזיום עלול לייצר יחס מעוות של 4-5:1 לטובת הסידן, המגביר את הסיכון למחלות לב ועלול לפגוע בבריאות העצם. בהתאם לכך, יש הממליצים על יחס של 1:1 בין מגנזיום לסידן, אך עדיין אין מספיק מידע מבוסס על מנת להסיק מסקנות חד משמעיות.
ברְזל
יש להימנע מנטילת תוספי מגנזיום אנאורגניים בשל פגיעה אפשרית בספיגת הברזל, או להפריד שעתיים-שלוש בין נטילת שני התוספים. יש להעדיף נטילת תוסף מגנזיום אורגני, בפרט כאשר יש צורך בנטילת תוסף ברזל ממושכת, אשר עלולה לפגוע ברמות המגנזיום בגוף.
על פי מחקרי מעבדה תוספי מגנזיום אנאורגניים כגון מגנזיום Oxide ו-Trisilicate, אשר רמת מסיסותם נמוכה, מעלים את רמת ה-PH בקיבה ויוצרים סביבה בסיסית המפריעה לספיגת הברזל. מנגד, תוספי מגנזיום אורגניים כגון מגנזיום Aspartate, אשר רמת מסיסותם גבוהה, אינם מפריעים לספיגת הברזל(151). במחקר קליני שנערך בקרב נשים הרות עם רמות המוגלובין נמוכות, נמצא כי נטילה משולבת של ברזל ומגנזיום Aspartate העלתה את רמות ההמוגלובין בסרום ואף הובילה לריכוך הצואה, דבר הנצפה כתגובה רצויה בהתחשב בנטייה לעצירויות בתקופת הריון ובנטילת ברזל. מסקנת החוקרים היא כי בנטילת מגנזיום Aspartate אין צורך להפריד את הנטילה מברזל, בשעתיים-שלוש כפי שמומלץ(152).
נטילת תוסף ברזל לאורך זמן עלולה לגרום להפחתה ברמת המגנזיום בגוף(153).
אָבץ
יש להפריד כשעתיים בין נטילת תוסף מגנזיום ותוסף אבץ.
בשני מחקרים קלינים נמצא כי אבץ מתחרה עם מגנזיום על אתרי ספיגה וכתוצאה מכך על מעבר של יונים במעי. צריכה גבוהה של אבץ מובילה להפרשה מוגברת של מגנזיום בצואה ובשתן באופן שעלול לפגוע בבריאות העצם(154-155).
בוֹרון
יש לנקוט זהירות בשילוב מגנזיום עם תוסף בורון.
בשני מחקרים קליניים, נטילה של תוסף בורון עיכבה את הפרשת המגנזיום בשתן והגבירה את רמתו וריכוזו בסרום(156-157).
זרְחן
יש להפריד כשעתיים בין נטילת תוסף מגנזיום ותוסף זרחן.
בסקירה של מחקרים, הודגם כי כמויות גבוהות של זרחן עלולות להפחית את רמות המגנזיום בגוף ולהיפך. יוני מגנזיום ויוני זרחן עלולים להיקשר זה לזה בקיבה ובאופן זה להפחית את זמינותם הביולוגית(158).
מחקרים על מגנזיום:
הקדמה
בהמשך נסקור את מרבית המחקרים הקליניים והפרה-קליניים לפרוטרוט אולם על מנת להקל על הקוראים, ריכזנו תחילה את עיקרי הממצאים:
עצִירות - צריכה נמוכה של נוזלים ומגנזיום במזון קשורה לשכיחות גבוהה יותר של עצירויות(159). בשני מחקרים קליניים(160-161) נמצא כי למידע השלם למנויים
מנגנוני הפעולה המיוחסים למגנזיום לטיפול בעצירות כוללים: שימור אוסמוטי של נוזלי המעי הדק והגס; עידוד הפרשה של למידע השלם למנויים
יתר לחָץ דם - מחקרים אפידמיולוגיים רבים מצביעים על קשר הפוך בין תזונה עשירה במגנזיום לבין יתר לחץ דם(166). כמו כן, מטה אנליזות ומחקרים קליניים אקראיים מבוקרים שונים, מדגימים כי למידע השלם למנויים
מנגנוני הפעולה המיוחסים למגנזיום לטיפול ביתר לחץ דם כוללים: השפעה נוגדת קרישה, הרחבת כלי הדם(175-178), השפעה על למידע השלם למנויים
מחלוֹת לב וכלי דם - מחקרים רבים מעידים על קשר בין חוסר מגנזיום והיפומגנזמיה לבין מחלות לב וכלי דם כגון: תעוקת חזה(188-189), הפרעות קצב לב (פעימה מוקדמת – PVC, טכיקרדיה, צניחת המסתם המיטראלי, torsade de pointes, פרפור פרוזדורים והפרעות קצב שונות לאחר ניתוח)(190-194), אי ספיקת לב משנית למחלת לב כלילית(195-199), אוטם שריר הלב(200-207), טרשת עורקים(208-209) וסיכון מוגבר לשבץ(210-211).
בנוסף, מחקרים קלינים רבים בחנו את יעילות הטיפול עם מגנזיום במחלות אלו ומצאו כי לנטילת מגנזיום באופן פומי השפעות חיוביות מגוונות:
תעוּקת חזה - הפחתת למידע השלם למנויים
הפרעוֹת קצב לב - ירידה של 23% בתדירות למידע השלם למנויים
אִי ספיקת לב - שיפור שיעורי ההישרדות בקרב למידע השלם למנויים
מחלת לב כלִילית - הפחתת שיעורי התמותה בקרב למידע השלם למנויים
טרשת עוֹרקים – מגנזיום עשוי להגן מפני למידע השלם למנויים
שָבץ – מגנזיום עשוי להפחית את הסיכון ל למידע השלם למנויים
מנגנוני הפעולה המיוחסים למגנזיום בטיפול במחלות לב וכלי דם כוללים: השפעה נוגדת עווית, משפרת טונוס ומרחיבת כלי דם(220), לרבות עורקים כליליים(212,220-223); הורדת למידע השלם למנויים
כמו כן, מתן מגנזיום בעירוי תוך ורידי נמצא במחקרים קלינים כיעיל בטיפול ב למידע השלם למנויים
סוּכרת - במטא אנליזות ובמחקרי עוקבה נמצא כי רמות נמוכות של מגנזיום והיפומגנזמיה מגבירות את הסיכון ל למידע השלם למנויים
ממחקרים קליניים, מחקרי מעבדה ובעלי חיים, עולה כי המנגנונים המעורבים בהשפעות אלו, כוללים הגברת שרידות תאים בלבלב(258); ויסות ייצור והפרשה של אינסולין באמצעות למידע השלם למנויים
אוֹסטאופורוזיס - מחקרים אפידמיולוגיים מעידים על קשר הדוק בין צריכת מגנזיום לבין צפיפות העצם. נמצא כי חוסר תזונתי במגנזיום עלול ל למידע השלם למנויים
התכווצוּיות שרירים - מחקר קליני ומחקר עוקבה אשר כללו 220 נבדקים מדגימים כי היפומגנזמיה וחוסר מגנזיום בתאים קשורים לתדירות גבוהה של למידע השלם למנויים
כמו כן, על אף ראיות סותרות(284-287), מתן תוסף מגנזיום עשוי להיות יעיל לטיפול בתסמונת למידע השלם למנויים
שיפור ביצועים ספורטיביים - נטילת מגנזיום נמצאה כמשפרת ביצועים ספורטיביים באימוני למידע השלם למנויים
כאבי וסת - שלושה מחקרים קליניים אקראים ומבוקרים(295-297), אשר בחנו את ההשפעה של תוסף מגנזיום פומי על נשים הסובלות מכאבי וסת, הדגימו הפחתה ב למידע השלם למנויים
מנגנוני הפעולה המיוחסים להשפעות אלו כוללים למידע השלם למנויים
תִסמונת קדם וסתית PִMS - במחקר מקרה-בקרה(298) ובסקירת מחקרים(299) נמצא כי נשים עם תסמונת קדם וסתית נוטות ל למידע השלם למנויים
מנגנוני הפעולה כוללים(296) למידע השלם למנויים
פִיברומיאלגיה - במחקרים קליניים ובמחקרי מעבדה(303-307), רמות נמוכות של מגנזיום תוך תאי, בשרירים, בפלזמה ובתאי אריתרוציטים, נקשרו עם למידע השלם למנויים
מִיגרנות - מחקרים רבים מדגימים את הקשר בין רמות נמוכות של מגנזיום לבין מיגרנות וכאב ראש על רקע מתח(312-315). שלושה מחקרים קליניים אקראיים מבוקרים וכפולי סמיות העוסקים בשילוב תוסף מגנזיום לטיפול במיגרנה, הדגימו למידע השלם למנויים
הפרעוֹת קשב ורִיכוז עם הִיפראקטיביות - חוסר מגנזיום מקושר עם הפרעות קשב וריכוז היפראקטיביות(11,333-334). במחקרים קליניים, תוסף מגנזיום אספרטאט(335), מגנזיום פירידוקסין או לקטאט בתוספת ויטמין B6 י(Uvimag, Magne-B6) הפחית למידע השלם למנויים
מנגנוני הפעולה המיוחסים להשפּעת המגנזיום על הפרעות קשב וריכוז עם היפראקטיביות ADHD כוללים שיפור למידע השלם למנויים
דִכאון וחָרדה - במחקרי עוקבה ובסקירות שיטתיות נמצא כי חוסר במגנזיום מקושר עם למידע השלם למנויים
מנגנוני הפעולה המיוחסים לפעילות של מגנזיום על דיכאון כוללים: פעילות הדדית של מגנזיום עם קולטנים למידע השלם למנויים
המנגנונים המיוחסים לפעילות של מגנזיום בטיפול בחרדה כוללים: דיכוי ציר היפותלמוס- למידע השלם למנויים
כאב - במספר מחקרים, רמות נמוכות של מגנזיום נקשרו עם הפרעות כאב כגון תסמונת קדם וסתית(299-298), מיגרנות(312-315) ופיברומיאלגיה(303-307). בשלושה מחקרים קליניים אקראיים ומבוקרים(295-297) שנערכו בקרב נשים עם כאבי וסת, נטילה של תוסף מגנזיום למשך 6 מחזורים חודשיים רציפים הובילה ל למידע השלם למנויים
זאת ועוד, במחקרים קליניים ובמחקרי מעבדה(303-307), רמות נמוכות של מגנזיום תוך תאי, בשרירים, בפלזמה ובתאי אריתרוציטים, נקשרו עם למידע השלם למנויים
המנגנונים העומדים מאחורי הפעילות של מגנזיום על כאב, כוללים השפעה נוגדת עווית שרירים ומרחיבת כלי דם, וכן השפעה למידע השלם למנויים
אבנִים בכליוֹת - במספר מחקרים קליניים ובמחקרי בעלי חיים, חוסר במגנזיום נקשר להסתיידויות בכליות (nephrocalcinosis) והיווצרות אבני סידן אוקסלט(348-354). כמו כן, מחקרים קליניים אקראיים ומבוקרים(355-358) הדגימו למידע השלם למנויים
צִיסטיק פיברוזיס - בסקירה שיטתית(360) אשר בחנה את הקשר בין מגנזיום לבין סיסטיק פיברוזיס, נמצא כי למידע השלם למנויים
אלצְהיימר ודמנְציה - במחקר מקרה בקרה(363) ובמחקר מעבדה(364), ריכוזים נמוכים של מגנזיום נקשרו ל למידע השלם למנויים
עצִירות
מחקרים קליניים | מנגנוני פעולה
מחקרים קליניים
במחקר קליני(162) אקראי מבוקר (2017), נבחנה השפּעת נטילת תוסף מגנזיום אוקסיד על סיבוכים שכיחים במערכת העיכול כגון בחילות, הקאות ועצירות הנוצרים לאחר ניתוח בעורקי הלב. במחקר השתתפו 102 מטופלים טרום ניתוח השתלת עורקים כליליים. המשתתפים חולקו לשתי קבוצות, כאשר בקבוצת ההתערבות קיבלו 800 מ"ג ביום מגנזיום אוקסיד בשתי מנות נפרדות ואילו המשתתפים בקבוצה השנייה שימשו כביקורת. ההתערבות החלה ביום אשפוז והסתיימה ביום שחרורם. עצירות נצפתה בקרב 21.6% מהמטופלים בקבוצת ההתערבות לעומת 40.4% מהמטופלים בביקורת. כמו כן, 47 מטופלים בקבוצת הביקורת דיווחו על בחילות לאחר ניתוח ו-40 על הקאות, לעומת 13 מטופלים בקבוצת ההתערבות שדיווחו על בחילות ו-12 על הקאות (P<0.001 לכל הנתונים). יחד עם זאת, היפומגנזמיה נצפתה בשתי הקבוצות והחוקרים הסיקו כי יש צורך במינון גבוה יותר של תוסף מגנזיום.
מחקר(159) אוכלוסיה רוחבי (2007), למידע השלם למנויים
מנגנוני פעולה
ההשפעה המשלשלת של מלחי מגנזיום שונים נגרמת עקב למידע השלם למנויים
יתר לחָץ דם
מחקרים קליניים | מנגנוני פעולה
מחקרים קליניים
סקירת מחקרים אפידמיולוגיים רבים מצביעה על קשר הפוך בין תזונה עשירה במגנזיום לבין יתר לחץ דם(166). בסקירה נוספת שכללה מחקרים אפידמיולוגיים, תצפיתיים וקליניים, נמצא כי נטילת מגנזיום במינון יומי של 500-1,000 מ"ג בתזונה או כתוסף, למידע השלם למנויים
מנגנוני פעולה
פעילות הרחבת כלי דם ונוגדת קרישה - מגנזיום פועל כקו-פקטור חיוני לאנזים למידע השלם למנויים
השפעה על מאזן הורמונים בכליות - חוסר מגנזיום מגביר פעילות של אנגיוטנסין 2, אשר מעודד הפרשה של ההורמון למידע השלם למנויים
פעילות נוגדת עווית ושיפור גמישות כלי הדם - לזרימה ולהצטברות ריכוזי סידן על פני קרום התא החיצוני יש השפעה למידע השלם למנויים
פעילות נוגדת חמצון - מחקרים שנערכו בקרב בעלי חיים מצאו כי תזונה דלה במגנזיום העלתה משמעותית את למידע השלם למנויים
מחלוֹת לב וכלי דם
מחקרים קליניים | מנגנוני פעולה
מחקרים קליניים
תעוּקת חזה | הפרעוֹת קצב לב | אִי ספיקת לב | מחלת לב כלִילית | אוטם שריר הלב | טרשת עוֹרקים | שָׁבץ
תעוּקת חזה
במחקר קליני(189) (2004), שנערך בקרב 12 נשים בגילאי 48-69 הסובלות מתעוקת חזה, נמצא קשר הדוק בין חוסר מגנזיום לבין תדירות גבוהה של כאבים בחזה.
במחקר קליני(212) אקראי ומבוקר פלסבו (2003), שנערך בקרב 187 חולים במחלת לב כלילית, נטילת מינון של 365 מ"ג מגנזיום ציטראט פעמיים ביום למשך 6 חודשים, הפחיתה למידע השלם למנויים
הפרעוֹת קצב לב
במחקר קליני(192) אקראי ומבוקר (2015), נמצא כי 86% מתוך 70 המשתתפים עם טכיקרדיה חדרית המטופלים עם מכשיר החייאה חשמלי (דפיברילטור), סובלים ממחסור במגנזיום. מתן מגנזיום לקטאט במינון יומי של 504 מ"ג מחולק ל-3 מנות למשך 12 חודשים, הפחית באופן משמעותי את למידע השלם למנויים
אִי ספיקת לב
בסקירה ומטה אנליזה (2013) של מחקרי עוקבה (סה"כ 313,041 משתתפים), נמצא כי רמות גבוהות של מגנזיום בסרום קשורות באופן משמעותי לסיכון נמוך למחלות לב וכלי דם(372). עוד נמצא שצריכת מגנזיום במינון של למידע השלם למנויים
מחלת לב כלילית
מחקרים אפידמיולוגיים שנערכו בין השנים 1973-1989, מדגימים את הקשר בין חוסר מגנזיום לבין מחלת לב כלילית(196-199).
במחקר קליני(212) (2003), נמצא כי נטילת מגנזיום ציטראט במינון יומי של 365 מ"ג למשך 6 חודשים, למידע השלם למנויים
אוֹטם שריר הלב
במחקרים קליניים אקראיים מבוקרים, מתן מגנזיום בעירוי תוך ורידי לחולים עם אוטם שריר הלב, הפחית את למידע השלם למנויים
טרשת עוֹרקים
מחקר עוקבה (1998) אשר בחן את הקשר בין רמות נמוכות של מגנזיום לבין שיעורי ההיארעות של מחלת לב כלילית בקרב 96 נשים ו-223 גברים בגיל העמידה בארה"ב במשך 4-7 שנים, הדגים כי למידע השלם למנויים
שָׁבץ
במטה אנליזה (2012) שכללה 7 מחקרים פרוספקטיביים עם סך של 241,378 משתתפים(210) ובמחקר עוקבה(211) נוסף (2015) נמצא כי תוספת תזונתית יומית של למידע השלם למנויים
מנגנוני פעולה
פעילות נוגדת עווית ושיפור טונוס כלי הדם – במחקר יעילות מבוקר(220) שנערך בקרב 22 מטופלים בתעוקת חזה (2000), עווית כלילית הושרתה באמצעות מתן עירוי של אצטילכוֹלין. לאחר הפוגה ספונטנית מעווית זה, מגנזיום סולפאט למידע השלם למנויים
עוד נמצא שעירוי מגנזיום הביא לשיפעול האנזים למידע השלם למנויים
בנוסף, נמצא כי העלאת רמות המגנזיום בנוזל החוץ תאי, משפעלת את למידע השלם למנויים
הפחתת רמות שומנים/כולסטרול בדם –בסקירת מחקרים נרחבת(94) אשר בחנה את ההשפעות של מגנזיום על מחלות לב וכלי דם, נמצא כי למידע השלם למנויים
פעילות נוגדת קרישה – היארעות פקקת תלויית טסיות (תרומבוזיס) היתה גבוהה באופן משמעותי בקרב חולי מחלת לב כלילית שאובחנו עם רמות נמוכות של מגנזיום תוך תאי, זאת על אף טיפול באספירין כנוגד צימות טסיות(374).
רמות גבוהות של מגנזיום בסרום למידע השלם למנויים
שיפור תפקודי אנדותל – התפקוד המבני של האנדותל נחוץ לשמירה על טונוס כלי הדם ועל זרימת הדם, לויסות חדירות כלי הדם, לויסות התגובות חיסוניות והדלקתיות והכרחי למניעה של טרשת עורקים. תפקוד לקוי של תאי האנדותל עלול להוביל לחמצון שומנים (LDL), לחדירות מוגברת של כלי הדם למולקולות שומן שונות, לאגירה ולהיצמדות טסיות והיווצרות פקקת (תרומבוזיס), לשגשוג יתר של תאי אנדותל ולעלייה ברמות דלקת, ציטוקינים וכימוקינים שונים(234). ממחקרים אפידמיולוגיים נמצא כי למידע השלם למנויים
פעילות נוגדת דלקת – אחת ההשפעות המיוחסות למגנזיום במניעה של מחלות לב וכלי דם קשורה בתגובה דלקתית מופחתת. במחקרים שנערכו בקרב בעלי חיים נמצא כי חוסר מגנזיום הוביל לעלייה ב למידע השלם למנויים
איזון הפרעות קצב לב – מנגנונים שונים של מגנזיום במניעת הפרעות קצב לב קשורים בוויסות ריכוזי מלחים בתאי שריר הלב ובקרום הלב, בפעילות אנטגוניסטית לתעלות וקולטני סידן בתאים ובשיפור ניצולת החמצן(11). בנוסף, מגנזיום מאריך ומווסת את זמן ההתאוששות של למידע השלם למנויים
סוּכרת
מחקרים קליניים | מנגנוני פעולה
מחקרים קליניים
סוכרת סוג 1 ו-2, כמו גם רמות גבוהות של אינסולין, מגבירות את הפרשת המגנזיום בשתן ומובילות לרמות נמוכות שלו בסרום ובתאים(246-247). כ-13.5-47.7% מחולי סוכרת סוג 2 סובלים מהיפומגנזמיה(248).
במחקר עוקבה(252) (2013) שנערך בקרב 2,582 נבדקים, צריכה גבוהה של מגנזיום למידע השלם למנויים
מנגנוני פעולה
הגברת שרידות תאים בלבלב וויסות ייצור והפרשה של אינסולין – במחקר קליני אקראי ומבוקר ובמחקר מעבדה, מגנזיום שיפר את למידע השלם למנויים
פעילות נוגדת חמצון והפחתת חמצון שומני הדם – במודל סוכרת סוג 2 שהושרה בעכברים נצפתה עלייה ברמות למידע השלם למנויים
הפחתת עמידות לאינסולין בתאים – במספר מחקרים קליניים(29,254,257) נמצא כי נטילת מגנזיום כתוסף פומי משפרת באופן משמעותי את למידע השלם למנויים
שיפור ניצול גלוקוז לצורכי אנרגיה וחילוף חומרים של פחמימות - מגנזיום תוך תאי נקשר למולקולות ATP ויוצר תרכובת Mg-ATP, הנחוצה לשפעול אנזימים המעורבים בתהליך הגליקוליזה בתא, ניצול גלוקוז לצורכי אנרגיה ואף מעורבת בחילוף החומרים של פחמימות(266).
בנוסף, במאמר סקירה אשר בחן את ההשפעות הביוכימיות של מגנזיום על גלוקוז ואינסולין(264), למידע השלם למנויים
הגברת קליטת גלוקוז בתאי השריר ובלבלב - במודל סוכרת סוג 2 שהושרה בחולדות באמצעות הזרקת Streptozotocin, הוספה של 10 גרם/ליטר מגנזיום סולפאט למי השתייה למשך 8 שבועות, הובילה(268) ל למידע השלם למנויים
דילוּל עצם - אוֹסטאופורוזיס
מחקרים קליניים | מנגנוני פעולה
מחקרים קליניים
במחקר עוקבה(273) פרוספקטיבי נרחב (2014) שנערך בקרב 73,684 נשים בגיל המעבר, ריכוזים נמוכים של מגנזיום נקשרו עם רמת צפיפות נמוכה בעצמות הגוף ובפרט בעצמות הירכיים (BMD). עם זאת, התוצאות לא ניבאו סיכון מוגבר לשברים.
מחקר קליני(276) אקראי מבוקר (2010) בחן השפּעת נטילת תוסף מגנזיום ציטראט במינון 290 מ"ג ביום למשך חודש, על רמות סמנים ביוכימיים הקשורים בתהליך שיחלוף העצם, בקרב 20 נשים בגיל המעבר עם אוסטאופורוזיס. בתום ההתערבות, רמת הורמון למידע השלם למנויים
מנגנוני פעולה
תמיכה בבניית עצם - כ-60% מסה"כ המגנזיום בגוף מאוחסן בעצמות ומשמש כמאגר על מנת לשמור על ריכוזים תקינים של המגנזיום בתאים. נטילת תוספי מגנזיום עשויה לתרום לבריאות העצם ולהגן מפני אוסטאופורוזיס באמצעות שיפור ספיגת המינרלים בעצמות, מניעה של ירידה בצפיפות העצם ועידוד תהליך הבנייה וחיזוק העצמות כפי שנמצא במחקרים שנערכו בקרב בעלי חיים ובמספר מחקרים קליניים(277-278).
בסקירה שכללה מחקרים קליניים ומחקרים שנערכו בקרב בעלי חיים ובמעבדה, נמצא כי למידע השלם למנויים
התכווצוּיות שרירים
התכווצויות שרירי הרגליים בהריון | תסמונת "הרגל חסרת המנוחה"
התכווצויות שרירי הרגליים בהריון
מחקרים קליניים | מנגנוני פעולה
מחקרים קליניים
בסקירת מחקרים (2015) שכללה 6 מחקרים קלינים וסך הכל 390 נשים(380), נבחנה היעילות הטיפולית של תוסף סידן, ויטמין C, ויטמיני B ומגנזיום בהתכווצויות שרירי הרגליים בהריון בהשוואה לקבוצות ביקורת או פלסבו. למידע השלם למנויים
מנגנוני פעולה
גורמי הסיכון והמנגנונים הקשורים בהתכווצויות שרירי הרגליים בהריון אינם ידועים עדיין, אך עשויים להיות קשורים ב למידע השלם למנויים
תסמונת "הרגל חסרת המנוחה"
מחקרים קליניים | מנגנוני פעולה
מחקרים קליניים
הן חוסר במגנזיום והן רמות גבוהות של מגנזיום נצפו(284-285) בסרום דמם של הסובלים מתסמונת הרגל חסרת המנוחה (RLS).
עם זאת, במחקר קליני (1998) נמצא כי מגנזיום למידע השלם למנויים
מנגנוני פעולה
מנגנוני הפעולה של מגנזיום בתסמונת "הרגל חסרת המנוחה" למידע השלם למנויים
שיפור ביצועים ספורטיביים
מחקרים קליניים | מנגנוני פעולה
מחקרים קליניים
במחקר קליני(292) אקראי כפול סמיות ומבוקר (2015) שנערך בקרב 13 נבדקים הצורכים כמות נאותה של מגנזיום בתזונתם היומית, נבחנה ההשפעה של תוסף מגנזיום ציטראט הניתן במינון יומי של 300 מ"ג למשך שבוע בהשוואה לנטילת מינון זהה למשך 4 שבועות, על ביצוע תרגיל הרמת מוט בשכיבה על ספסל שטוח (bench press) במסגרת שני ימי אימון. בתום ההתערבות, נצפה שיפור של למידע השלם למנויים
מנגנוני פעולה
פעילות גופנית מאומצת גורמת להפרשה מוגברת של מגנזיום בשתן ובזיעה ועלולה להוביל לריכוזים נמוכים של מגנזיום בתאי אריתרוציטים ובפלזמה(386-388). במאמר סקירה נרחב המתבסס על נתונים ממחקרים קליניים רבים, נמצא כי למידע השלם למנויים
כאבי וסת (דיסמנאוריה)
מחקרים קליניים | מנגנוני פעולה
מחקרים קליניים
הערת מערכת: למרות שחלק מסוגי המגנזיום המופיעים להלן אינם קיימים כתוסף בישראל, בחרנו להביא את המידע אודותיהם, שכן הניסיון הקליני של כותבי המונוגרף מצא כי למגנזיום על סוגיו השונים השפעה מטיבה על כאבי וסת.
במחקר קליני(295) (1992) שנערך בקרב 30 נשים צעירות, נטילת תוסף מגנזיום פידולאט במינון של 4.5 מ"ג, 3 פעמים ביום, 7 ימים לפני הוסת ועד היום השלישי לוסת למשך 6 מחזורים חודשיים רציפים, תסמיני הכאב ביום הראשון של הוסת למידע השלם למנויים
מנגנוני פעולה
נראה כי מגנזיום משפיע על עוצמת הכאב באמצעות עיכוב סינתזה למידע השלם למנויים
תִסמונת קדם וסתית PִMS
מחקרים קליניים | מנגנוני פעולה
מחקרים קליניים
במחקר מקרה-בקרה(298) (2015) שנערך בקרב 62 נבדקות נמצא כי נשים עם תסמונת קדם וסתית נוטות לרמות נמוכות של מגנזיום בסרום.
במחקר קליני אקראי(301) מבוקר פלסבו וכפול סמיות (2000), 44 נשים בגיל ממוצע 32 הסובלות מתסמונת קדם וסתית, חולקו ל-4 קבוצות: (1) מינון יומי של 200 מ"ג מגנזיום אוקסיד, (2) מינון יומי של 50 מ"ג ויטמין B6י, (3) מינון יומי של 200 מ"ג מגנזיום אוקסיד + 50 מ"ג ויטמין B6 ליום, (4) פלסבו. בתום תקופת ההתערבות שנמשכה מחזור חודשי אחד, נצפתה למידע השלם למנויים
מנגנוני פעולה
מנגנוני הפעולה של תוספי מגנזיום בתסמונת קדם וסתית למידע השלם למנויים
פיברוֹמיאלגיה
מחקרים קליניים | מנגנוני פעולה
מחקרים קליניים
במחקר קליני(308) אקראי ומבוקר (2013) אשר בחן השפּעת נטילת תוסף מגנזיום על כאב, השתתפו 60 נשים בטרום גיל המעבר המאובחנות בפיברומיאלגיה. המשתתפות חולקו באופן אקראי לשלוש קבוצות של 20 נשים, אשר קיבלו בכל יום: קבוצה א: 300 מ"ג מגנזיום ציטראט, קבוצה ב: 10 מ"ג Amitriptyline (נוגד דכאון), וקבוצה ג: 300 מ"ג מגנזיום ציטראט + 10 מ"ג Amitriptyline. בתום 8 שבועות, בקרב נשים שנטלו מגנזיום ציטראט הודגמה למידע השלם למנויים
מנגנוני פעולה
במחקרים קליניים ובמחקרי מעבדה, למידע השלם למנויים
מִיגרנות
מחקרים קליניים | מנגנוני פעולה
מחקרים קליניים
שלושה מחקרים קליניים אקראיים מבוקרים וכפולי סמיות עוסקים בשילוב תוסף מגנזיום לטיפול במיגרנה.
המחקר הראשון למידע השלם למנויים
מנגנוני פעולה
אנטגוניסט לקולטני N-Methyl-D-Aspartate) NMDA) ועיכוב גלוטמט - במחקרים שנערכו בקרב בעלי חיים, רמות נמוכות של מגנזיום הגבירו למידע השלם למנויים
עיכוב שחרור נוירופפטיד (CGRP (Calcitonin gene-related peptide – ל-CGRP תפקיד משמעותי בפתופיזיולוגיה של מיגרנה, כאשר הוא משוחרר מן העצב המשולש וגורם להרחבה של כלי דם תוך גולגלתיים. למידע השלם למנויים
עיכוב היצרות כלי דם בעקבות שחרור מוגבר של סרוטונין – במחקרים שנערכו בקרב בעלי חיים, רמות נמוכות של מגנזיום עודדו למידע השלם למנויים
שיפור זרימת דם מוחית – במחקר קליני אקראי מבוקר פלסבו וכפול סמיות(316), נטילת תוסף מגנזיום ציטראט במינון של 600 מ"ג ליום למשך 3 חודשים, הובילה ל למידע השלם למנויים
עיכוב שחרור Substance P והיסטמין - רמות נמוכות של מגנזיום העלו רמות של Substance P אשר גרמו לשחרור היסטמין מתאי מאסט(186).
הפרעוֹת קשב ורִיכוז עם הִיפראקטיביות
מחקרים קליניים | מנגנוני פעולה
מחקרים קליניים
במחקר מקרה בקרה(334) (1997) שנערך בקרב 116 ילדים הסובלים מהפרעות קשב וריכוז היפראקטיביות (ADHD), חוסר מגנזיום נצפה בקרב 95% מהילדים.
עם זאת, חשוב להדגיש כי עדיין לא נמצאו מחקרים קליניים אקראיים ומבוקרים הבוחנים את יעילות נטילת מגנזיום בהשוואה לפלסבו.
במחקר קליני(336) (2006) נמצא כי מתן תוסף של מגנזיום בשילוב ויטמין B6 (במינון של 6 מ"ג מגנזיום, 0.6 מ"ג ויטמין B6 עבור כל 1 ק"ג משקל גוף ליום) לתקופה של 8 שבועות, הפחית למידע השלם למנויים
מנגנוני פעולה
שיפור יכולות למידה, זיכרון ותפקוד קוגניטיבי - מנגנוני הפעולה המיוחסים לפעילות של מגנזיום בהפרעות קשב וריכוז כדוגמת ADHD, עשויים להיות קשורים בפעילות הדדית של מגנזיום עם קולטנים למידע השלם למנויים
דִכאון וחָרדה
מחקרים קליניים | מנגנוני פעולה
מחקרים קליניים
במחקר עוקבה (2009) שנערך בקרב 5,708 משתתפים בגילאי 46-49 או 70-74, נמצא כי אנשים הסובלים מדיכאון נוטים לצרוך תזונה דלה במגנזיום וכי קיים קשר הפוך בין צריכת מגנזיום לבין תסמינים דיכאוניים(340).
סקירה שיטתית (2017) שכללה 18 מחקרים קליניים(343), הציגה את היעילות הטיפולית של תוספי מגנזיום מסוג ציטראט, לקטאט ואוקסיד על למידע השלם למנויים
מנגנוני פעולה
נוגד דִיכאון - אחד המנגנונים העיקריים המיוחסים להשפעה נוגדת הדיכאון של מגנזיום(341) הוא חסימה של קולטני גלוטמט N-methyl-D-aspartate) NMDA). במחקר שנערך בקרב בעלי חיים, למידע השלם למנויים
נוגד חָרדה – תזונה דלה במגנזיום (10% פחות מהדרישה היומית המינימלית), הובילה ל למידע השלם למנויים
כמו כן, תזונה דלה במגנזיום הובילה לרמות גבוהות של למידע השלם למנויים
כאב
מחקרים קליניים | מנגנוני פעולה
מחקרים קליניים
לקריאה מורחבת של המחקרים ראו סעיפים פרטניים: תִסמונת קְדם וסתית, מִיגרנוֹת ופִיבְרומיאלגיה.
עוד בהקשר של כאב, נמצא במחקרים קליניים נוספים כי מתן מגנזיום בעירוי הפחית כאבים לאחר ניתוח, כאבי גב תחתון וכאבים נוירופתיים:
כאבִים נוירופתים - במחקר קליני(399) שנערך בקרב 12 חולי סרטן הסובלים מכאבים נוירופתים, מינון של למידע השלם למנויים
כאבִים לאחר ניתוח - מחקר קליני(400) שנערך בקרב 42 נשים שעברו ניתוח לכריתת רחם תחת הרדמה כללית, בחן את ההשפעה של מתן למידע השלם למנויים
אריתרומללגיה - מתן 1116 מ"ג מגנזיום סולפאט ליום במשך 12 חודשים, הפחית למידע השלם למנויים
כאבי גב תחתון - במחקר קליני(402) אקראי מבוקר פלסבו וכפול סמיות (2013) שנערך בקרב 80 נבדקים (40 נבדקים בקבוצת ההתערבות ו-40 נבדקים בפלסבו) אשר סבלו מכאבי גב תחתון כרוניים על רקע עצבי וקיבלו טיפול תרופתי נוגד כאב (גאבּאפנטין במינון של 300 מ"ג 3 פעמים ביום, אמיטריפטילין הידרוכלוריד במינון של 25 מ"ג ליום לפני השינה, סלקוקסיב 200 מ"ג פעמיים ביום), נמצא כי למידע השלם למנויים
מנגנוני פעולה
מנגנוני הפעולה העומדים מאחורי ההשפעה של מגנזיום על תסמונת קדם וסתית וכאבי וסת, כוללים(296) פעילות למידע השלם למנויים
המנגנונים המיוחסים לפעילות של מגנזיום על מיגרנות כוללים: פעילות אנטגוניסטית לקולטני למידע השלם למנויים
ההשפעה של מגנזיום על פיברומיאלגיה כנוגד כאבי שרירים, יוחסה לעיכוב(311) קולטני למידע השלם למנויים
אבנִים בכליוֹת
מחקרים קליניים | מנגנוני פעולה
מחקרים קליניים
במחקר קליני(358) אקראי ומבוקר פלסבו (2017) שלב IV, תוסף מגנזיום לקטאט במינון יומי של 510 מ"ג העלה את למידע השלם למנויים
מנגנוני פעולה
במספר מחקרים קליניים ובמחקרי בעלי חיים, חוסר במגנזיום נקשר ל למידע השלם למנויים
צִיסטיק פיברוזיס
מחקרים קליניים | מנגנוני פעולה
מחקרים קליניים
במחקר קליני(361) אקראי מבוקר פלסבו וכפול סמיות (2012), אשר בחן את ההשפעה של מגנזיום על כוח שרירי הנשימה בקרב 44 חולי סיסטיק פיברוזיס בגילאי 7-19, נמצא כי בקרב 22 נבדקים בקבוצת ההתערבות נטילת תוסף מגנזיום גליצין במינון יומי של 300 מ"ג למשך 8 שבועות, הובילה ל למידע השלם למנויים
מנגנוני פעולה
ריכוזים נמוכים של מגנזיום עשויים להימצא בקרב חולי סיסטיק פיברוזיס ויש לשקול מתן תוסף בכדי למנוע היפומגנזמיה(360). המנגנונים העומדים בבסיס ההמלצה:
חיזוק שרירי נשימה –תוסף מגנזיום גליצין הוביל לעלייה של למידע השלם למנויים
הפחתת ליחה - במחקר קליני ובמעבדה (2006) נמצא כי למגנזיום השפעה מעכבת על למידע השלם למנויים
אלצְהיימר ודמנְציה
מחקרים | מנגנוני פעולה
מחקרים
במחקר מקרה בקרה(363) (2011) שנערך בקרב 101 קשישים, למידע השלם למנויים
מנגנוני פעולה
במחקר מעבדה במודל אלצהיימר שהושרה בעכברים(368), טיפול במגנזיום טראונט, הפחית למידע השלם למנויים
כמו כן, במודל אלצהיימר שהושרה בחולדות(365), טיפול במגנזיום סולפאט עיכב את האנזים למידע השלם למנויים
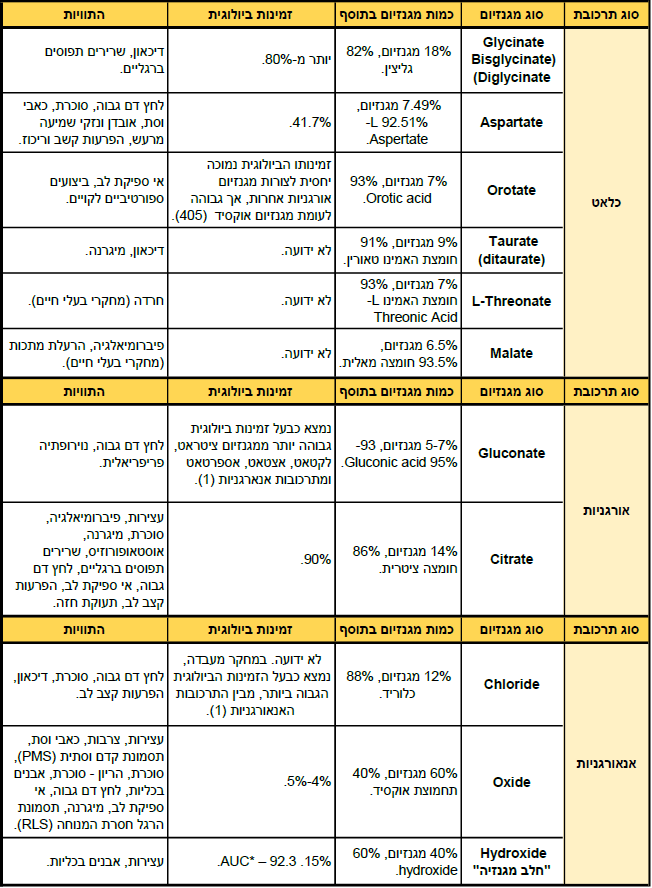
נספח 1 – טבלת תרכובות מגנזים שונות
להלן סקירת תרכובות מגנזיום הקיימות בשוק כתוספי מזון.
ההתוויות בטבלה מבוססות על מחקרים קליניים בלבד, אלא אם צוין אחרת.
* AUC – מתייחס לריכוז החומר בסרום ביחס לזמן.
לצפייה בסלולר
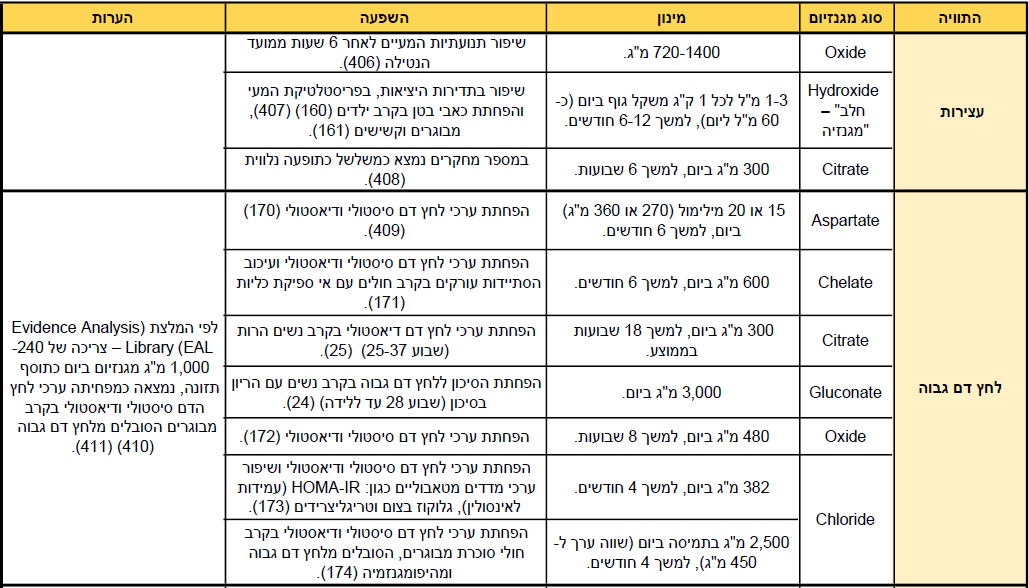
נספח 2 – מינונים פרטניים על פי התוויות
הטבלה המלאה, כמו גם אפשרות לצפות בה דרך מכשירים סלולריים, זמינה למנויי האתר בלבד. למידע השלם למנויים
מקורות
- Coudray C, et al. Study of magnesium bioavailability from ten organic and inorganic Mg salts in Mg-depleted rats using a stable isotope approach. Magnes Res. Dec 2005. https://www.ncbi.nlm.nih.gov/pubmed/16548135.
- Lindberg JS, et al. Magnesium bioavailability from magnesium citrate and magnesium oxide. J Am Coll Nutr. Feb 1990. https://www.ncbi.nlm.nih.gov/pubmed/2407766.
- Firoz M, Graber M. Bioavailability of US commercial magnesium preparations. Magnes Res. Dec 2001. https://www.ncbi.nlm.nih.gov/pubmed/11794633.
- ר. צפריר. עקב השימוש במים מותפלים בחקלאות: ירידה של 30% בשיעור המגנזיום בפירות ובירקות. הארץ. Mar 29, 2018. https://www.haaretz.co.il/news/science/.premium-1.5957882.
- Institute of Medicine (IOM. Dietary Reference Intakes for Calcium, Phosphorus, Magnesium, Vitamin D, and Fluoride (1997). Food and Nutrition Board. 1997. https://www.nap.edu/read/5776/chapter/8.
- Office of Dietary Supplements. NIH - National Institutes of Health. Feb 11, 2016. https://ods.od.nih.gov/factsheets/Magnesium-HealthProfessional/#en1.
- Costello RB, et al. Perspective: The Case for an Evidence-Based Reference Interval for Serum Magnesium: The Time Has Come. Adv Nutr. Nov 15, 2016. https://www.ncbi.nlm.nih.gov/pubmed/28140318/.
- Elin RJ. Assessment of magnesium status for diagnosis and therapy. Magnes Res. Aug 24, 2010. https://www.ncbi.nlm.nih.gov/pubmed/20736141/.
- W. D, M. K. Magnesium basics. Clin Kidney J. Feb 2012. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4455825/.
- Blaine J, Chonchol M, Levi M. Renal Control of Calcium, Phosphate, and Magnesium Homeostasis. Clin J Am Soc Nephrol. Jul 7, 2015. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4491294/.
- Gröber u, Schmidt J, Klaus K. Magnesium in Prevention and Therapy. Nutrients. Sep 23, 2015. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4586582/.
- H. F. de Baaij, G. J. Hoenderop, J. M. Bindels. Regulation of magnesium balance: lessons learned from human genetic disease. Clin Kidney J. Feb 2012. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4455826/.
- De Baaij JH, Hoenderop JG, Bindels RJ. Magnesium in man: implications for health and disease. Physiol Rev. Jan 2015. https://www.ncbi.nlm.nih.gov/pubmed/25540137.
- Agus ZS. Mechanisms and causes of hypomagnesemia. Curr Opin Nephrol Hypertens. Jul 2016. https://www.ncbi.nlm.nih.gov/pubmed/27219040.
- Chandra AK, Goswami H, Sengupta P. Effects of magnesium on cytomorphology and enzyme activities in thyroid of rats. Indian J Exp Biol. Aug 2014. https://www.ncbi.nlm.nih.gov/pubmed/25141541.
- Musso CG. Magnesium metabolism in health and disease. Int Urol Nephrol. Mar 10, 2009. https://www.ncbi.nlm.nih.gov/pubmed/19274487?dopt=Abstract.
- Cunningham J, Rodríguez M, Messa P. Magnesium in chronic kidney disease Stages 3 and 4 and in dialysis patients. Clin Kidney J. Feb 2012. https://www.ncbi.nlm.nih.gov/pubmed/26069820/.
- Xing JH, Soffer EE. Adverse effects of laxatives. Dis Colon Rectum. Aug 2001. https://www.ncbi.nlm.nih.gov/pubmed/11535863/.
- Vissers R, Purssell R. Iatrogenic magnesium overdose: two case reports. J Emerg Med. Mar-Apr 1996. https://www.ncbi.nlm.nih.gov/pubmed/8740750/.
- Hashizume N, Mori M. An analysis of hypermagnesemia and hypomagnesemia. Jpn J Med. 1990. https://www.ncbi.nlm.nih.gov/pubmed/2273620/.
- Cao Z, et al. Acute hypermagnesemia and respiratory arrest following infusion of MgSO4 for tocolysis. Clin Chim Acta. Jul 1999. https://www.ncbi.nlm.nih.gov/pubmed/10481936/.
- Weng YM, et al. Hypermagnesemia in a constipated female. J Emerg Med. Jan 2013. https://www.ncbi.nlm.nih.gov/pubmed/22244603.
- Kovács L. [Magnesium substitution in pregnancy. A prospective, randomized double-blind study]. Geburtshilfe Frauenheilkd. Aug 1988. https://www.ncbi.nlm.nih.gov/pubmed/3063587.
- Li S, Tian H. [Oral low-dose magnesium gluconate preventing pregnancy induced hypertension]. Zhonghua Fu Chan Ke Za Zhi. Oct 1997. https://www.ncbi.nlm.nih.gov/pubmed/?term=magnesium+gluconate+hypertension.
- Bullarbo M. Magnesium supplementation to prevent high blood pressure in pregnancy: a randomised placebo control trial. Arch Gynecol Obstet. Dec 2013. https://www.ncbi.nlm.nih.gov/pubmed/23715924.
- Sharma A, et al. 1884 pregnant women were treated with 348 mg magnesium daily from 4th to 9th week of pregnancy (group 1) or from 10th to 24th week of pregnancy (group 2) or did not receive any magnesium substitution (control group). The influence of magnesium supplementa. Indian Journal of Clinical Biochemistry. Jul 1999. https://link.springer.com/article/10.1007%2FBF02867874.
- Zarcone R, Cardone G, Bellini P. Role of magnesium in pregnancy. Panminerva Med. Dec 1994. https://www.ncbi.nlm.nih.gov/pubmed/7603732.
- Dahle LO, et al. The effect of oral magnesium substitution on pregnancy-induced leg cramps. Am J Obstet Gynecol. Jul 1995. https://www.ncbi.nlm.nih.gov/pubmed/7631676.
- Asemi Z, et al. Magnesium supplementation affects metabolic status and pregnancy outcomes in gestational diabetes: a randomized, double-blind, placebo-controlled trial. Am J Clin Nutr. JUL 2015. https://www.ncbi.nlm.nih.gov/pubmed/26016859.
- Spätling L, et al. Supplementation of Magnesium in Pregnancy. Journal of Pregnancy and Child Health. Feb 28, 2017. https://www.omicsonline.org/open-access/supplementation-of-magnesium-in-pregnancy-2376-127X-1000302.php?aid=85899#40.
- Meier B, et al. Does continuing oral magnesium supplementation until delivery affect labor and puerperium outcome? Eur J Obstet Gynecol Reprod Biol. Dec 1, 2005. https://www.ncbi.nlm.nih.gov/pubmed/15899543.
- Kang HS, et al. Aminoglycosides inhibit hormone-stimulated Mg2+ uptake in mouse distal convoluted tubule cells. Aug 2000. https://www.ncbi.nlm.nih.gov/pubmed/10958159.
- Nix DE, et al. Effects of aluminum and magnesium antacids and ranitidine on the absorption of ciprofloxacin. Clin Pharmacol Ther. Dec 1989. https://www.ncbi.nlm.nih.gov/pubmed/2598571.
- Mallet L, Huang A. Coadministration of gatifloxacin and multivitamin preparation containing minerals: potential treatment failure in an elderly patient. Ann Pharmacother. . Jun 2005. https://www.ncbi.nlm.nih.gov/pubmed/15546943.
- Ogawa R, Echizen H. Clinically significant drug interactions with antacids: an update. Drugs. Oct 1, 2011. https://www.ncbi.nlm.nih.gov/pubmed/21942976.
- Naggar VF, Khalil SA, et al. Effect of magnesium trisilicate on nitrofurantoin absorption. Clin Pharmacol Ther. Jun 1979. https://www.ncbi.nlm.nih.gov/pubmed/36251.
- Neuvonen PJ. Interactions with the absorption of tetracyclines. Drugs. 1976. https://www.ncbi.nlm.nih.gov/pubmed/946598.
- Sompolinsky D, Samra Z. Influence of magnesium and manganese on some biological and physical properties of tetracycline. J Bacteriol. May 1972. https://www.ncbi.nlm.nih.gov/pubmed/4553832?dopt=Abstract.
- Barton CH, et al. Renal magnesium wasting associated with amphotericin B therapy. Am J Med. Sep 1984. https://www.ncbi.nlm.nih.gov/pubmed/6475987.
- Lohitnavy M, et al. Reduced oral itraconazole bioavailability by antacid suspension. J Clin Pharm Ther. Jun 2005. https://www.ncbi.nlm.nih.gov/pubmed/15896236.
- Gearhart MO, Sorg TB. Foscarnet-induced severe hypomagnesemia and other electrolyte disorders. Ann Pharmacother. . Mar 1993. https://www.ncbi.nlm.nih.gov/pubmed/8384030.
- Noormohamed FH, et al. Foscarnet-induced changes in plasma concentrations of total and ionized calcium and magnesium in HIV-positive patients. Antivir Ther. Aug 1996. https://www.ncbi.nlm.nih.gov/pubmed/11322251.
- Muller MP, et al. Adverse events associated with high-dose ribavirin: evidence from the Toronto outbreak of severe acute respiratory syndrome. Pharmacotherapy. Apr 2007. https://www.ncbi.nlm.nih.gov/pubmed/17381375.
- Kibirige MS, Morris-Jones PH, Addison GM. Prevention of cisplatin-induced hypomagnesemia. Pediatr Hematol Oncol. 1998. https://www.ncbi.nlm.nih.gov/pubmed/3152946.
- Hodgkinson E, Neville-Webbe HL, Coleman RE. Magnesium depletion in patients receiving cisplatin-based chemotherapy. Clin Oncol (R Coll Radiol). Nov 2006. https://www.ncbi.nlm.nih.gov/pubmed/17100159.
- van de Loosdrecht AA, Gietema JA, van der Graaf WT. Seizures in a patient with disseminated testicular cancer due to cisplatin-induced hypomagnesaemia. Acta Oncol. 2000. https://www.ncbi.nlm.nih.gov/pubmed/10859019.
- Demizu M, et al. [Effect of magnesium supplementation on early-stage hypomagnesemia in patients treated with cetuximab]. Gan To Kagaku Ryoho. Jul 2013. https://www.ncbi.nlm.nih.gov/pubmed/23863731.
- Tsujii T, et al. Correlation between blood magnesium and calcium concentration in patients treated with an anti-EGFR antibody. J Pharm Health Care Sci. Sep 22, 2016. https://www.ncbi.nlm.nih.gov/pubmed/27688901.
- Petrelli F, et al. Risk of anti-EGFR monoclonal antibody-related hypomagnesemia: systematic review and pooled analysis of randomized studies. Expert Opin Drug Saf. May 2012. https://www.ncbi.nlm.nih.gov/pubmed/21843103.
- Thompson CB, et al. Association between cyclosporin neurotoxicity and hypomagnesaemia. Lancet. Nov 17, 1984. https://www.ncbi.nlm.nih.gov/pubmed/6150182.
- Vannini SD, et al. Permanently reduced plasma ionized magnesium among renal transplant recipients on cyclosporine. Transpl Int. 1999. https://www.ncbi.nlm.nih.gov/pubmed/10460868.
- Asai T, et al. Activation of transcription factors AP-1 and NF-kappaB in chronic cyclosporine A nephrotoxicity: role in beneficial effects of magnesium supplementation. Transplantation. Apr 15, 2003. https://www.ncbi.nlm.nih.gov/pubmed/12698095.
- Pere AK, et al. Dietary potassium and magnesium supplementation in cyclosporine-induced hypertension and nephrotoxicity. Kidney Int. Dec 2000. https://www.ncbi.nlm.nih.gov/pubmed/11115079.
- June CH, et al. Correlation of hypomagnesemia with the onset of cyclosporine-associated hypertension in marrow transplant patients. Transplantation. Jan 1986. https://www.ncbi.nlm.nih.gov/pubmed/3510494.
- Meral A, Coker M, Tanaç R. Inhalation therapy with magnesium sulfate and salbutamol sulfate in bronchial asthma. Turk J Pediatr. Apr-Jun 1996. https://www.ncbi.nlm.nih.gov/pubmed/8701480.
- Abreu J, et al. [Effect of intravenous magnesium sulfate on chronic obstructive pulmonary disease exacerbations requiring hospitalization: a randomized placebo-controlled trial]. Arch Bronconeumol. Aug 2006. https://www.ncbi.nlm.nih.gov/pubmed/16948990.
- Okayama H, et al. Bronchodilating effect of intravenous magnesium sulfate in bronchial asthma. JAMA. Feb 1987. https://www.ncbi.nlm.nih.gov/pubmed/3806898.
- Gontijol C, et al. Oral magnesium supplementation in asthmatic children: a double-blind randomized placebo-controlled trial. Eur J Clin Nutr. Jan 2007. https://www.ncbi.nlm.nih.gov/pubmed/16788707.
- Rolla G, Bucca C. Magnesium, beta-agonists, and asthma. Lancet. Apr 30, 1988. https://www.ncbi.nlm.nih.gov/pubmed/2896843?dopt=Abstract.
- Whyte KF, et al. Adrenergic control of plasma magnesium in man. Clin Sci (Lond). Jan 1987 . https://www.ncbi.nlm.nih.gov/pubmed/3542342?dopt=Abstract.
- Tveskov C, et al. Potassium and magnesium distribution, ECG changes, and ventricular ectopic beats during beta 2-adrenergic stimulation with terbutaline in healthy subjects. Chest. Dec 1994. https://www.ncbi.nlm.nih.gov/pubmed/7988180?dopt=Abstract.
- Bos WJ, Postma DS, van JJ. Magnesiuric and calciuric effects of terbutaline in man. Clin Sci (Lond). Jun 1988. https://www.ncbi.nlm.nih.gov/pubmed/2840236?dopt=Abstract.
- Khilnani G, Parchani H, Toshniwal G. Hypomagnesemia due to beta 2-agonist use in bronchial asthma. J Assoc Physicians India. May 1992. https://www.ncbi.nlm.nih.gov/pubmed/1484002?dopt=Abstract.
- Bremme K, et al. Effects of infusion of the beta-adrenoceptor agonist terbutaline on serum magnesium in pregnant women. Magnesium. 1986. https://www.ncbi.nlm.nih.gov/pubmed/3713256?dopt=Abstract.
- Blitz M, et al. Inhaled magnesium sulfate in the treatment of acute asthma. Cochrane Database Syst Rev. Jul 20, 2005. https://www.ncbi.nlm.nih.gov/pubmed/16034914.
- Albertson TE, Sutter ME, Chan AL. The acute management of asthma. Clin Rev Allergy Immunol. Feb 2005. https://www.ncbi.nlm.nih.gov/pubmed/25213370.
- Atkinson SA, et al. Bone and mineral abnormalities in childhood acute lymphoblastic leukemia: influence of disease, drugs and nutrition. Int J Cancer Suppl. 1998. https://www.ncbi.nlm.nih.gov/pubmed/9876475.
- Stargrove M B, Treasure J, McKee D. L. Herb, Nutrient, and Drug Interactions . Elsevier. 2008. pp 556-582..
- Naggar VF, Khalil SA, Gouda MW. Effect of concomitant administration of magnesium trisilicate on GI absorption of dexamethasone in humans. J Pharm Sci. . Jul 1987. https://www.ncbi.nlm.nih.gov/pubmed/207854.
- N Cohen, et al. Serum magnesium aberrations in furosemide (frusemide) treated patients with congestive heart failure: pathophysiological correlates and prognostic evaluation. Heart. . Apr 2003. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1769282/.
- Dørup I, Skajaa K, Thybo NK. Oral magnesium supplementation restores the concentrations of magnesium, potassium and sodium-potassium pumps in skeletal muscle of patients receiving diuretic treatment. J Intern Med. Feb 1993. https://www.ncbi.nlm.nih.gov/pubmed/8381850.
- Heidenreich O. Mode of action of conventional and potassium-sparing diuretics--aspects with relevance to Mg-sparing effects. Review of the present state of the art and recent findings. Magnesium. 1984. https://www.ncbi.nlm.nih.gov/pubmed/6536835?dopt=Abstract.
- Hollifield JW. Magnesium depletion, diuretics, and arrhythmias. Am J Med. Mar 20, 1987. https://www.ncbi.nlm.nih.gov/pubmed/2436474?dopt=Abstract.
- Murray JJ, Healy MD. Drug-mineral interactions: a new responsibility for the hospital dietitian. J Am Diet Assoc. Jan 1991. https://www.ncbi.nlm.nih.gov/pubmed/1869762?dopt=Abstract.
- Lumme JA, Jounela AJ. The effect of potassium and potassium plus magnesium supplementation on ventricular extrasystoles in mild hypertensives treated with hydrochlorothiazide. Int J Cardiol. Oct 1989. https://www.ncbi.nlm.nih.gov/pubmed/2477338.
- Ruml LA, Pak CY. Effect of potassium magnesium citrate on thiazide-induced hypokalemia and magnesium loss. Am J Kidney Dis. Jul 1999. https://www.ncbi.nlm.nih.gov/pubmed/10401023.
- Ryan MP. Magnesium- and potassium-sparing effects of amiloride. Review and recent findings. Magnesium. 1984. https://www.ncbi.nlm.nih.gov/pubmed/6536837.
- Mervaala EM, et al. Influence of dietary salts on the cardiovascular effects of low-dose combination of ramipril and felodipine in spontaneously hypertensive rats. Br J Pharmacol. Jan 1998. https://www.ncbi.nlm.nih.gov/pubmed/9489606.
- Vest AR, Cho LS. Hypertension in pregnancy. Cardiol Clin. Aug 2012. https://www.ncbi.nlm.nih.gov/pubmed/22813366.
- Koontz SL, Friedman SA, Schwartz ML. Symptomatic hypocalcemia after tocolytic therapy with magnesium sulfate and nifedipine. Am J Obstet Gynecol. Jun 2004. https://www.ncbi.nlm.nih.gov/pubmed/15284796?dopt=Abstract.
- Snyder SW, Cardwell MS. Neuromuscular blockade with magnesium sulfate and nifedipine. Am J Obstet Gynecol. Jul 1989. https://www.ncbi.nlm.nih.gov/pubmed/2750819?dopt=Abstract.
- Bunchman TE, et al. Pretreatment of formula with sodium polystyrene sulfonate to reduce dietary potassium intake. Pediatr Nephrol. Jan 1991 . https://www.ncbi.nlm.nih.gov/pubmed/2025533.
- McElnay JC, et al. The interaction of warfarin with antacid constituents in the gut. Experientia. Oct 15, 1979. https://www.ncbi.nlm.nih.gov/pubmed/499421.
- Van der Giesen WF, Wilting J. Analysis of the mechanism of the magnesium effect on the warfarin-albumin interaction. Biochem Pharmacol. May 15, 1984. https://www.ncbi.nlm.nih.gov/pubmed/6732838.
- Pérez Gallardo L. In vitro effect of Cl2Ca and Cl2Mg on warfarin-human serum albumin (HSA) binding. Magnes Res. Mar 1999. https://www.ncbi.nlm.nih.gov/pubmed/10192099.
- Neuvonen PJ, Kivistö KT. Enhancement of drug absorption by antacids. An unrecognised drug interaction. Clin Pharmacokinet. Aug 1994. https://www.ncbi.nlm.nih.gov/pubmed/7955775.
- Shechter M, et al. Oral magnesium supplementation inhibits platelet-dependent thrombosis in patients with coronary artery disease. Am J Cardiol. Jul 15, 1999. https://www.ncbi.nlm.nih.gov/pubmed/10426331.
- Ravn HB. Magnesium inhibits human platelets. Blood Coagul Fibrinolysis. . Mar 1996. https://www.ncbi.nlm.nih.gov/pubmed/8735829.
- Neuvonen PJ, Kivistö KT. The effects of magnesium hydroxide on the absorption and efficacy of two glibenclamide preparations. Br J Clin Pharmacol. Aug 1991. https://www.ncbi.nlm.nih.gov/pubmed/1931470?dopt=Abstract.
- Kivistö KT, Neuvonen PJ. Enhancement of absorption and effect of glipizide by magnesium hydroxide. Clin Pharmacol Ther. Jan 1991. https://www.ncbi.nlm.nih.gov/pubmed/1988239.
- Paolisso G, et al. Improved insulin response and action by chronic magnesium administration in aged NIDDM subjects. Diabetes Care. Apr 1989. https://www.ncbi.nlm.nih.gov/pubmed/2651054.
- Sjögren A, Florén CH, Nilsson A. Oral administration of magnesium hydroxide to subjects with insulin-dependent diabetes mellitus: effects on magnesium and potassium levels and on insulin requirements. Magnesium. 1988. https://www.ncbi.nlm.nih.gov/pubmed/3054347.
- Haenni A O, hrvall M, Lithell H. Serum magnesium status during lipid-lowering drug treatment in non-insulin-dependent diabetic patients. Metabolism. Oct 2001. https://www.ncbi.nlm.nih.gov/pubmed/11586485.
- Kupetsky-Rincon E.A. Magnesium: Novel Applications in Cardiovascular Disease – A Review of the Literature. Ann Nutr Metab. 2012. https://www.karger.com/Article/FullText/339380.
- Martin PD, et al. The effect of a combination antacid preparation containing aluminium hydroxide and magnesium hydroxide on rosuvastatin pharmacokinetics. Curr Med Res Opin. . Apr 2008. https://www.ncbi.nlm.nih.gov/pubmed/18355422.
- Watkins DW, et al. Alterations in calcium, magnesium, iron, and zinc metabolism by dietary cholestyramine. Dig Dis Sci. May 1985. https://www.ncbi.nlm.nih.gov/pubmed/3987479.
- Kupfer SH , Kosovsky J. Effects of Cardiac Glycosides on Renal Tubular Transport of Calcium, Magnesium, Inorganic Phosphate, and Glucose in the Dog*. J Clin Invest. Jul 1965. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC292588/.
- Crippa G, et al. Magnesium and cardiovascular drugs: interactions and therapeutic role. Ann Ital Med Int. Jan-Mar 1999. https://www.ncbi.nlm.nih.gov/pubmed/10528423.
- Young IS, et al. Magnesium status and digoxin toxicity. Br J Clin Pharmacol. Dec 1991. https://www.ncbi.nlm.nih.gov/pubmed/1768564.
- Donald B. Polan. Magnesium sulfate and digitalis-toxic arrhythmias. JAMA. . Jan 25, 1985. https://www.ncbi.nlm.nih.gov/pubmed/3968783.
- Raja Rao MP. Digoxin toxicity with normal digoxin and serum potassium levels: beware of magnesium, the hidden malefactor. J Emerg Med. . Aug 2013. https://www.ncbi.nlm.nih.gov/pubmed/23685098?dopt=Abstract.
- Brown DD, Juhl RP. Decreased bioavailability of digoxin due to antacids and kaolin-pectin. N Engl J Med. . Nov 4, 1976. https://www.ncbi.nlm.nih.gov/pubmed/972657?dopt=Abstract.
- Allen MD, et al. Effect of magnesium--aluminum hydroxide and kaolin--pectin on absorption of digoxin from tablets and capsules. J Clin Pharmacol. Jan 1981. https://www.ncbi.nlm.nih.gov/pubmed/7012189?dopt=Abstract.
- Rodin SM, Johnson BF. Pharmacokinetic interactions with digoxin. Clin Pharmacokinet. Oct 1988. https://www.ncbi.nlm.nih.gov/pubmed/3056649?dopt=Abstract.
- Läer S, Neumann J, Scholz H. Interaction between sotalol and an antacid preparation. Br J Clin Pharmacol. Mar 1997. https://www.ncbi.nlm.nih.gov/pubmed/9088581.
- McBride BF, et al. An evaluation of the impact of oral magnesium lactate on the corrected QT interval of patients receiving sotalol or dofetilide to prevent atrial or ventricular tachyarrhythmia recurrence. Ann Noninvasive Electrocardiol. Apr 11, 2006. https://www.ncbi.nlm.nih.gov/pubmed/16630091.
- Forlani S, et al. Combination of sotalol and magnesium prevents atrial fibrillation after coronary artery bypass grafting. Ann Thorac Surg. Sep 2002. https://www.ncbi.nlm.nih.gov/pubmed/12238830.
- Remon JP, et al. Interaction of antacids with antiarrhythmics. V. Effect of aluminium hydroxide and magnesium oxide on the bioavailability of quinidine, procainamide and propranolol in dogs. Arzneimittelforschung. 1983. https://www.ncbi.nlm.nih.gov/pubmed/6681962.
- Bando S, et al. Effect of magnesium sulfate on ventricular refractoriness and its efficacy for torsade de pointes. Tokushima J Exp Med. Dec 1990. https://www.ncbi.nlm.nih.gov/pubmed/2094063.
- Seelig MS. Increased need for magnesium with the use of combined oestrogen and calcium for osteoporosis treatment. Magnes Res. Sep 1990. https://www.ncbi.nlm.nih.gov/pubmed/2132751?dopt=Abstract.
- Seelig MS. Interrelationship of magnesium and estrogen in cardiovascular and bone disorders, eclampsia, migraine and premenstrual syndrome. J Am Coll Nutr. Aug 1993. https://www.ncbi.nlm.nih.gov/pubmed/8409107?dopt=Abstract.
- Stanton MF, Lowenstein FW. Serum magnesium in women during pregnancy, while taking contraceptives, and after menopause. J Am Coll Nutr. 1987Aug. https://www.ncbi.nlm.nih.gov/pubmed/3611529.
- Blum M, et al. Oral contraceptive lowers serum magnesium. Harefuah. Nov 15, 1991. https://www.ncbi.nlm.nih.gov/pubmed/1752550.
- Itoh A, et al. Interaction between Bisphosphonates and Mineral Water: Study of Oral Risedronate Absorption in Rats. Biol Pharm Bull. 2016. https://www.ncbi.nlm.nih.gov/pubmed/26934925.
- Mackay JD, Bladon PT. Hypomagnesaemia due to proton-pump inhibitor therapy: a clinical case series. QJM. Jun 2010. https://www.ncbi.nlm.nih.gov/pubmed/20378675.
- Bachmann KA, et al. Drug interactions of H2-receptor antagonists. Scand J Gastroenterol Suppl. 1994. https://www.ncbi.nlm.nih.gov/pubmed/7863246.
- Garris RE, Kirkwood CF. Misoprostol: a prostaglandin E1 analogue. Clin Pharm. Sep 1989. https://www.ncbi.nlm.nih.gov/pubmed/2507215.
- Koinig H, et al. Magnesium sulfate reduces intra- and postoperative analgesic requirements. Anesth Analg. Jul 1998. https://www.ncbi.nlm.nih.gov/pubmed/9661575.
- Neuvonen PJ, Kivistö KT. Enhancement of drug absorption by antacids. An unrecognised drug interaction. Clin Pharmacokinet. Aug 1994. https://www.ncbi.nlm.nih.gov/pubmed/7955775?dopt=Abstract.
- Hurwitz a. Antacid Therapy and Drug Kinetics. Clinical Pharmacokinetics. Dec 13, 2012. https://link.springer.com/article/10.2165/00003088-197702040-00003.
- Ramasamy R, de Freitas DM. Competition between Li+ and Mg2+ for ATP in human erythrocytes. A 31P NMR and optical spectroscopy study. FEBS Lett. Feb 13, 1989. https://www.ncbi.nlm.nih.gov/pubmed/2924906.
- Kiełczykowska M, Pasternak K, Musik I. The influence of lithium on calcium and magnesium homeostasis in serum and tissues of rats. Ann Univ Mariae Curie Sklodowska Med. 2003. https://www.ncbi.nlm.nih.gov/pubmed/15323205.
- Yagi T, et al. Impact of concomitant antacid administration on gִabapentin plasma exposure and oral bioavailability in healthy adult subjects. Drug Metab Pharmacokinet. Jan 13, 2012. https://www.ncbi.nlm.nih.gov/pubmed/22240839.
- Kwan WF, Lee C, Chen BJ. A noninvasive method in the differential diagnosis of vecuronium-induced and magnesium-induced protracted neuromuscular block in a severely preeclamptic patient. J Clin Anesth. Aug 1996. https://www.ncbi.nlm.nih.gov/pubmed/8832451.
- Ghoneim MM, Long JP. The interaction between magnesium and other neuromuscular blocking agents. Anesthesiology. Jan 1970. https://www.ncbi.nlm.nih.gov/pubmed/5460601.
- Sinatra RS, et al. Prolonged neuromuscular blockade with vecuronium in a patient treated with magnesium sulfate. Anesth Analg. Dec 1985. https://www.ncbi.nlm.nih.gov/pubmed/2865911.
- Baraka A, Yazigi A. Neuromuscular interaction of magnesium with succinylcholine-vecuronium sequence in the eclamptic parturient. Anesthesiology. Nov 1987. https://www.ncbi.nlm.nih.gov/pubmed/2890318.
- Gaiser RR, Seem EH. Use of rocuronium in a pregnant patient with an open eye injury, receiving magnesium medication, for preterm labour. Br J Anaesth. Nov 1996. https://www.ncbi.nlm.nih.gov/pubmed/8957990.
- Feldman S, Karalliedde L. Drug interactions with neuromuscular blockers. Drug Saf. Oct 1996. https://www.ncbi.nlm.nih.gov/pubmed/8905251.
- Hansten PD, Horn JR. Vancouver, WA: Applied Therapeutics Inc. Drug Interactions Analysis and Management. 1997 and updates.
- Osman MA, et al. Reduction in oral penicillamine absorption by food, antacid, and ferrous sulfate. Clin Pharmacol Ther. Apr 1983. https://www.ncbi.nlm.nih.gov/pubmed/6831825.
- Seelig MS. Auto-immune complications of D-penicillamine--a possible result of zinc and magnesium depletion and of pyridoxine inactivation. J Am Coll Nutr. 1982. https://www.ncbi.nlm.nih.gov/pubmed/7185852?dopt=Abstract.
- Mersebach H, et al. Intestinal adsorption of levothyroxine by antacids and laxatives: case stories and in vitro experiments. Pharmacol Toxicol. MAR 1999. https://www.ncbi.nlm.nih.gov/pubmed/10193669.
- Ravn HB, et al. Magnesium inhibits platelet activity--an infusion study in healthy volunteers. Thromb Haemost. Jun 1996. https://www.ncbi.nlm.nih.gov/pubmed/8822590.
- Raven HB, et al. Magnesium inhibits platelet activity--an in vitro study. Thromb Haemost. Jul 1996. https://www.ncbi.nlm.nih.gov/pubmed/8819258?dopt=Abstract.
- Eisinger J, Dagorn J. Vitamin B6 and magnesium. Magnesium. . 1986. https://www.ncbi.nlm.nih.gov/pubmed/3959594.
- Abraham GE, Schwartz UD, Lubran MM. Effect of vitamin B-6 on plasma and red blood cell magnesium levels in premenopausal women. Ann Clin Lab Sci. . Jul-Aug 1981. https://www.ncbi.nlm.nih.gov/pubmed/7271227.
- Krejs GJ, et al. Effect of 1,25-dihydroxyvitamin D3 on calcium and magnesium absorption in the healthy human jejunum and ileum. Am J Med. Dec 1983. https://www.ncbi.nlm.nih.gov/pubmed/6689108.
- Fukumoto S, et al. Renal magnesium wasting in a patient with short bowel syndrome with magnesium deficiency: effect of 1 alpha-hydroxyvitamin D3 treatment. J Clin Endocrinol Metab. Dec 1987. https://www.ncbi.nlm.nih.gov/pubmed/3680484.
- Charles P, et al. Treatment with high-dose oral vitamin D2 in patients with jejunoileal bypass for morbid obesity. Effects on calcium and magnesium metabolism, vitamin D metabolites, and faecal lag time. Scand J Gastroenterol. Nov 1984. https://www.ncbi.nlm.nih.gov/pubmed/6335925.
- Hardwick LL, et al. Magnesium absorption: mechanisms and the influence of vitamin D, calcium and phosphate. J Nutr. Jan 1991. https://www.ncbi.nlm.nih.gov/pubmed/1992050.
- Selby PL, Peacock M, Bambach CP. Hypomagnesaemia after small bowel resection: treatment with 1 alpha-hydroxylated vitamin D metabolites. Br J Surg. May 1984. https://www.ncbi.nlm.nih.gov/pubmed/6547069.
- Whang R, et. Magnesium depletion as a cause of refractory potassium repletion. Arch Intern Med. Sep 1985. https://www.ncbi.nlm.nih.gov/pubmed/4026498.
- Dyckner T, Wester PO. Potassium/magnesium depletion in patients with cardiovascular disease. Am J Med. Mar 20, 1987. https://www.ncbi.nlm.nih.gov/pubmed/3565422.
- Dørup I. Magnesium and potassium deficiency. Its diagnosis, occurrence and treatment in diuretic therapy and its consequences for growth, protein synthesis and growth factors. Acta Physiol Scand Suppl. 1994. https://www.ncbi.nlm.nih.gov/pubmed/8036903.
- Seelig M. Cardiovascular consequences of magnesium deficiency and loss: pathogenesis, prevalence and manifestations--magnesium and chloride loss in refractory potassium repletion. Am J Cardiol. Apr 18, 1989. https://www.ncbi.nlm.nih.gov/pubmed/2650515.
- Sojka J, et al. Magnesium kinetics in adolescent girls determined using stable isotopes: effects of high and low calcium intake. Am J Physiol. Aug 1997. https://www.ncbi.nlm.nih.gov/pubmed/9277559.
- Spencer H, et al. Effect of magnesium on the intestinal absorption of calcium in man. J Am Coll Nutr. Oct 1994. https://www.ncbi.nlm.nih.gov/pubmed/7836628?dopt=Abstract.
- Fine KD, et al. Intestinal absorption of magnesium from food and supplements. J Clin Invest. Aug 1991. https://www.ncbi.nlm.nih.gov/pubmed/1864954.
- Durlach J. Recommended dietary amounts of magnesium: Mg RDA. Magnes Res. . Sep 1989. https://www.ncbi.nlm.nih.gov/pubmed/2701269.
- Disch G. Interactions between magnesium and iron. In vitro studies. Arzneimittelforschung. May 1994. https://www.ncbi.nlm.nih.gov/pubmed/8024640.
- Disch G, et al. Therapeutic availability of iron administered orally as the ferrous gluconate together with magnesium-L-aspartate hydrochloride. Arzneimittelforschung. . Mar 1996. https://www.ncbi.nlm.nih.gov/pubmed/8901154.
- Newhouse IJ, Clement DB, Lai C. Effects of iron supplementation and discontinuation on serum copper, zinc, calcium, and magnesium levels in women. Med Sci Sports Exerc. May 1993. https://www.ncbi.nlm.nih.gov/pubmed/8492683.
- Nielsen FH, Milne DB. A moderately high intake compared to a low intake of zinc depresses magnesium balance and alters indices of bone turnover in postmenopausal women. Eur J Clin Nutr. May 2004. https://www.ncbi.nlm.nih.gov/pubmed/15116072.
- Spencer H, Norris C, Williams D. Inhibitory effects of zinc on magnesium balance and magnesium absorption in man. J Am Coll Nutr. Oct 1994. https://www.ncbi.nlm.nih.gov/pubmed/7836627.
- Meacham SL, Taper LJ, Volpe SL. Effect of boron supplementation on blood and urinary calcium, magnesium, and phosphorus, and urinary boron in athletic and sedentary women. Am J Clin Nutr. Feb 1995. https://www.ncbi.nlm.nih.gov/pubmed/7840072.
- Nielsen FH, et al. Effect of dietary boron on mineral, estrogen, and testosterone metabolism in postmenopausal women. FASEB J. Nov 1987. https://www.ncbi.nlm.nih.gov/pubmed/3678698.
- Weisinger JR, Bellorín-Font E. Magnesium and phosphorus. Lancet. Aug 1, 1998. https://www.ncbi.nlm.nih.gov/pubmed/9717944.
- Murakami K, et al. Association between dietary fiber, water and magnesium intake and functional constipation among young Japanese women. Eur J Clin Nutr. 2007. https://www.ncbi.nlm.nih.gov/pubmed/17151587.
- Loening V, Pashankar DS. A randomized, prospective, comparison study of polyethylene glycol 3350 without electrolytes and milk of magnesia for children with constipation and fecal incontinence. Pediatrics. Aug 2006. https://www.ncbi.nlm.nih.gov/pubmed/16882804.
- Kinnunen O1, Salokannel J. Constipation in elderly long-stay patients: its treatment by magnesium hydroxide and bulk-laxative. Ann Clin Res. 1987. https://www.ncbi.nlm.nih.gov/pubmed/3126699.
- Moradian ST et al. Oral magnesium supplementation reduces the incidence of gastrointestinal complications following cardiac surgery: a randomized clinical trial. Magnes Res. Feb 1, 2017. https://www.ncbi.nlm.nih.gov/pubmed/28417897.
- Donowitz M1, Rood RP. Magnesium hydroxide: new insights into the mechanism of its laxative effect and the potential involvement of prostaglandin E2. J Clin Gastroenterol. Jan 1992. https://www.ncbi.nlm.nih.gov/pubmed/1556404.
- Izzo AA, Gaginella TS, Capasso F. The osmotic and intrinsic mechanisms of the pharmacological laxative action of oral high doses of magnesium sulphate. Importance of the release of digestive polypeptides and nitric oxide. Magnes Res. Jun 1999. https://www.ncbi.nlm.nih.gov/pubmed/8878010.
- Izzo AA, et al. Nitric oxide as a mediator of the laxative action of magnesium sulphate. Br J Pharmacol. Sep 1994. https://www.ncbi.nlm.nih.gov/pubmed/7529110.
- Mizushima S, et al. Dietary magnesium intake and blood pressure: a qualitative overview of the observational studies. J Hum Hypertens. Jun 1998. https://www.ncbi.nlm.nih.gov/pubmed/9702930?access_num=9702930&link_type=MED&dopt=Abstract.
- Houston M. The role of magnesium in hypertension and cardiovascular disease. J Clin Hypertens (Greenwich). Nov 2011. https://www.ncbi.nlm.nih.gov/pubmed/22051430.
- Jee SH, et al. The effect of magnesium supplementation on blood pressure: a meta-analysis of randomized clinical trials. Am J Hypertens. Aug 2002. https://www.ncbi.nlm.nih.gov/pubmed/12160191/.
- Kass L, Weekes J, Carpenter L. Effect of magnesium supplementation on blood pressure: a meta-analysis. Eur J Clin Nutr. Apr 2012. https://www.ncbi.nlm.nih.gov/pubmed/22318649/.
- Dyckner T, Wester PO. Effect of magnesium on blood pressure. Br Med J (Clin Res Ed). Jun 11, 1983. https://www.ncbi.nlm.nih.gov/pubmed/6407598.
- Cunha AR et al. Oral magnesium supplementation improves endothelial function and attenuates subclinical atherosclerosis in thiazide-treated hypertensive women. J Hypertens. Jan 2017. https://www.ncbi.nlm.nih.gov/pubmed/27759579.
- Kawano Y. Effects of magnesium supplementation in hypertensive patients: assessment by office, home, and ambulatory blood pressures. Hypertension. Aug 1998. https://www.ncbi.nlm.nih.gov/pubmed/9719052.
- Rodríguez M, Guerrero-R. Oral magnesium supplementation improves the metabolic profile of metabolically obese, normal-weight individuals: a randomized double-blind placebo-controlled trial. Arch Med Res. Jul 2014. https://www.ncbi.nlm.nih.gov/pubmed/24830937.
- Guerrero F, Rodríguez M. The effect of lowering blood pressure by magnesium supplementation in diabetic hypertensive adults with low serum magnesium levels: a randomized, double-blind, placebo-controlled clinical trial. J Hum Hypertens. Apr 2009. https://www.ncbi.nlm.nih.gov/pubmed/19020533.
- Das UN. Essential fatty acids: biochemistry, physiology and pathology. Biotechnol J. Apr 2006. https://www.ncbi.nlm.nih.gov/pubmed/16892270.
- Das UN. Nutrients, essential fatty acids and prostaglandins interact to augment immune responses and prevent genetic damage and cancer. Nutrition. Mar-Apr 1989. https://www.ncbi.nlm.nih.gov/pubmed/2520267.
- Das UN. Delta6 desaturase as the target of the beneficial actions of magnesium. Med Sci Monit. Aug 2010. https://www.ncbi.nlm.nih.gov/pubmed/20671618.
- Haga H. Effects of Dietary Magnesium Supplementation on Diurnal Variations of Blood Pressure and Plasma Na+, K+-ATPase Activity in Essential Hypertension. Jpn Heart J. Nov 1992. https://www.ncbi.nlm.nih.gov/pubmed/1338597.
- M Houston. The Role of Magnesium in Hypertension and Cardiovascular Disease. J Clin Hypertens. Sep 26, 2011. https://onlinelibrary.wiley.com/doi/abs/10.1111/j.1751-7176.2011.00538.x.
- Jin K, et al. Additional antihypertensive effect of magnesium supplementation with an angiotensin II receptor blocker in hypomagnesemic rats. Korean J Intern Med. Mar 2013. https://www.ncbi.nlm.nih.gov/pubmed/23526071.
- Atarashi K, et al. Effects of magnesium on changes in blood pressure and plasma aldosterone induced by angiotensin II. Am J Hypertens. Jun 1990. https://www.ncbi.nlm.nih.gov/pubmed/2196065.
- Altura BM, et al. Mg2+-Ca2+ interaction in contractility of vascular smooth muscle: Mg2+ versus organic calcium channel blockers on myogenic tone and agonist-induced responsiveness of blood vessels. Can J Physiol Pharmacol. Apr 1987. https://www.ncbi.nlm.nih.gov/pubmed/3300911/.
- Yogi A, et al. Vascular biology of magnesium and its transporters in hypertension. Magnes Res. Dec 2010. https://www.ncbi.nlm.nih.gov/pubmed/21199786.
- Shechter M. Oral magnesium therapy improves endothelial function in patients with coronary artery disease. Circulation. Nov 7, 2000. https://www.ncbi.nlm.nih.gov/pubmed/11067788.
- Blache D, et al. Long-term moderate magnesium-deficient diet shows relationships between blood pressure, inflammation and oxidant stress defense in aging rats. Free Radic Biol Med. Jul 15, 2006. https://www.ncbi.nlm.nih.gov/pubmed/16814108?access_num=16814108&link_type=MED&dopt=Abstract.
- Weglicki WB, et al. Magnesium-deficiency elevates circulating levels of inflammatory cytokines and endothelin. Mol Cell Biochem. Mar 25, 1992. https://www.ncbi.nlm.nih.gov/pubmed/1584207?access_num=1584207&link_type=MED&dopt=Abstract.
- Xi Zhang, et al. Effects of Magnesium Supplementation on Blood Pressure. Hypertension. Jul 11, 2016. http://hyper.ahajournals.org/content/68/2/324.long.
- Satake K et al. Relation between severity of magnesium deficiency and frequency of anginal attacks in men with variant angina. J Am Coll Cardiol. Oct 1996. https://www.ncbi.nlm.nih.gov/pubmed/8837566.
- Guo H, et al. Relationship between the degree of intracellular magnesium deficiency and the frequency of chest pain in women with variant angina. Herz. May 2004. https://www.ncbi.nlm.nih.gov/pubmed/15167956.
- Lichodziejewska B, et al. Clinical symptoms of mitral valve prolapse are related to hypomagnesemia and attenuated by magnesium supplementation. Am J Cardiol. Mar 15, 1997. https://www.ncbi.nlm.nih.gov/pubmed/9070556.
- Bashir Y et al. Effects of long-term oral magnesium chloride replacement in congestive heart failure secondary to coronary artery disease. Am J Cardiol. Nov 15, 1993. https://www.ncbi.nlm.nih.gov/pubmed/8237806.
- Baker WL, et al. Impact of Magnesium L-Lactate on Occurrence of Ventricular Arrhythmias in Patients with Implantable Cardioverter Defibrillators: A Randomized, Placebo-Controlled Trial. Open Cardiovasc Med J. Oct 2015. https://www.ncbi.nlm.nih.gov/pubmed/27006710.
- Banai S, Tzivoni D. Drug therapy for torsade de pointes. J Cardiovasc Electrophysiol. Apr 1993. https://www.ncbi.nlm.nih.gov/pubmed/8269292.
- Lee HY, Ghimire S, Kim EY. Magnesium supplementation reduces postoperative arrhythmias after cardiopulmonary bypass in pediatrics: a metaanalysis of randomized controlled trials. Pediatr Cardiol. . Aug 2013. https://www.ncbi.nlm.nih.gov/pubmed/23443885.
- Lutsey PL, et al. Serum magnesium, phosphorus, and calcium are associated with risk of incident heart failure: the Atherosclerosis Risk in Communities (ARIC) Study. Am J Clin Nutr. Sep 2014. https://www.ncbi.nlm.nih.gov/pubmed/25030784.
- Chipperfield B, Chipperfield JR. Heart-muscle magnesium, potassium, and zinc concentrations after sudden death from heart-disease. Lancet. Aug 11, 1973. https://www.ncbi.nlm.nih.gov/pubmed/4124777.
- Shaper AG. Soft water, heart attacks, and stroke. JAMA. . Oct 7, 1974. https://www.ncbi.nlm.nih.gov/pubmed/4479283.
- T. W. Anderson, et al. Letter: Ischemic heart disease, water hardness and myocardial magnesium. Can Med Assoc J. Aug 9, 1975. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1956535/.
- Lichton IJ. Dietary intake levels and requirements of Mg and Ca for different segments of the U.S. population. Magnesium. . 1989. https://www.ncbi.nlm.nih.gov/pubmed/2682039.
- Morton BC, et al. Magnesium therapy in acute myocardial infarction--a double-blind study. Magnesium. 1984. https://www.ncbi.nlm.nih.gov/pubmed/6399346?dopt=Abstract.
- Woods KL, et al. Intravenous magnesium sulphate in suspected acute myocardial infarction: results of the second Leicester Intravenous Magnesium Intervention Trial (LIMIT-2). Lancet. Jun 27, 1992. https://www.ncbi.nlm.nih.gov/pubmed/1351547?dopt=Abstract.
- Feldstedt M, et al. Magnesium substitution in acute ischaemic heart syndromes. Eur Heart J. Nov 1991. https://www.ncbi.nlm.nih.gov/pubmed/1782952?dopt=Abstract.
- Shechter M, et al. Beneficial effect of magnesium sulfate in acute myocardial infarction. Am J Cardiol. Aug 1, 1990. https://www.ncbi.nlm.nih.gov/pubmed/2195862?dopt=Abstract.
- Ceremuzyński L, et al. Threatening arrhythmias in acute myocardial infarction are prevented by intravenous magnesium sulfate. Am Heart J. Dec 1989. https://www.ncbi.nlm.nih.gov/pubmed/2589170?dopt=Abstract.
- Abraham AS, et al. Magnesium in the prevention of lethal arrhythmias in acute myocardial infarction. Arch Intern Med. Apr 1987. https://www.ncbi.nlm.nih.gov/pubmed/3548627?dopt=Abstract.
- Smith LF, et al. Intravenous infusion of magnesium sulphate after acute myocardial infarction: effects on arrhythmias and mortality. Int J Cardiol. Aug 1986. https://www.ncbi.nlm.nih.govl/pubmed/2427458?dopt=Abstract.
- Rasmussen HS, et al. One-year death rate in 270 patients with suspected acute myocardial infarction, initially treated with intravenous magnesium or placebo. Clin Cardiol. Jun 1988. https://www.ncbi.nlm.nih.gov/pubmed/3396238?dopt=Abstract.
- Liao F, Folsom AR, Brancati FL. Is low magnesium concentration a risk factor for coronary heart disease? The Atherosclerosis Risk in Communities (ARIC) Study. Am Heart J. Sep 1998. https://www.ncbi.nlm.nih.gov/pubmed/9736141?dopt=Abstract.
- Altura BM, Altura BT. Magnesium and cardiovascular biology: an important link between cardiovascular risk factors and atherogenesis. Cell Mol Biol Res. . 1995. https://www.ncbi.nlm.nih.gov/pubmed/8867781.
- Larsson SC, Orsini N, Wolk A. Dietary magnesium intake and risk of stroke: a meta-analysis of prospective studies. Am J Clin Nutr. Feb 2012. https://www.ncbi.nlm.nih.gov/pubmed/22205313/.
- Adebamowo SN, et el. Association between intakes of magnesium, potassium, and calcium and risk of stroke: 2 cohorts of US women and updated meta-analyses. Am J Clin Nutr. Jun 2015. https://www.ncbi.nlm.nih.gov/pubmed/25948665/-.
- Shechter M, et al. Effects of oral magnesium therapy on exercise tolerance, exercise-induced chest pain, and quality of life in patients with coronary artery disease. Am J Cardiol. Mar 1, 2003. https://www.ncbi.nlm.nih.gov/pubmed/12615252.
- Lewis RV, et al. Oral magnesium reduces ventricular ectopy in digitalised patients with chronic atrial fibrillation. Eur J Clin Pharmacol. 1990. https://www.ncbi.nlm.nih.gov/pubmed/1692533.
- Stepura OB, Martynow AI. Magnesium orotate in severe congestive heart failure (MACH). Int J Cardiol. May 1, 2009. https://www.ncbi.nlm.nih.gov/pubmed/19367681.
- Fuentes JC, Salmon AA, Silver MA. Acute and chronic oral magnesium supplementation: effects on endothelial function, exercise capacity, and quality of life in patients with symptomatic heart failure. Congest Heart Fail. Jan-Feb 2006. https://www.ncbi.nlm.nih.gov/pubmed/16470086.
- Almoznino D, et al. Magnesium and C-reactive protein in heart failure: an anti-inflammatory effect of magnesium administration? Eur J Nutr. Jun 2007. https://www.ncbi.nlm.nih.gov/pubmed/17479208.
- Singh RB. Effect of dietary magnesium supplementation in the prevention of coronary heart disease and sudden cardiac death. Magnes Trace Elem. 1990. https://www.ncbi.nlm.nih.gov/pubmed/2248695.
- Shechter M, et al. Beneficial antithrombotic effects of the association of pharmacological oral magnesium therapy with aspirin in coronary heart disease patients. Magnes Res. Dec 2000. https://www.ncbi.nlm.nih.gov/pubmed/11153897.
- Turgut F, et al. Magnesium supplementation helps to improve carotid intima media thickness in patients on hemodialysis. Int Urol Nephrol. 2008. https://www.ncbi.nlm.nih.gov/pubmed/18568412.
- Teragawa H et al. The Preventive Effect of Magnesium on Coronary Spasm in Patients With Vasospastic Angina. Chest. Dec 2000. https://www.ncbi.nlm.nih.gov/pubmed/11115460.
- Altura BM, Altura BT. New perspectives on the role of magnesium in the pathophysiology of the cardiovascular system. II. Experimental aspects. Magnesium. https://www.ncbi.nlm.nih.gov/pubmed/3914581?dopt=Abstract.
- Altura BM, Altura BT. Magnesium, electrolyte transport and coronary vascular tone. Drugs. Oct 1984. https://www.ncbi.nlm.nih.gov/pubmed/6149922.
- Miyagi H, et el. Effect of magnesium on anginal attack induced by hyperventilation in patients with variant angina. Circulation. Mar 1989. https://www.ncbi.nlm.nih.gov/pubmed/2917390.
- Bo S, Pisu E. Role of dietary magnesium in cardiovascular disease prevention, insulin sensitivity and diabetes. Curr Opin Lipidol. Feb 2008. https://www.ncbi.nlm.nih.gov/pubmed/18196987.
- Rayssiguier Y . Magnesium, lipids and vascular diseases. Experimental evidence in animal models. Magnesium. Jan 1, 1986. http://europepmc.org/abstract/med/3523056.
- Rosanoff A, Seelig MS. Comparison of mechanism and functional effects of magnesium and statin pharmaceuticals. J Am Coll Nutr. Oct 2004. https://www.ncbi.nlm.nih.gov/pubmed/15466951.
- Ouchi Y, et al. Effect of dietary magnesium on development of atherosclerosis in cholesterol-fed rabbits. Arteriosclerosis. Sep-Oct 1990. https://www.ncbi.nlm.nih.gov/pubmed/2403301.
- Gawaz M, et el. Effects of magnesium on platelet aggregation and adhesion. Magnesium modulates surface expression of glycoproteins on platelets in vitro and ex vivo. Thromb Haemost. . Dec 1994. https://www.ncbi.nlm.nih.gov/pubmed/7740463?dopt=Abstract.
- Phillips DR, et al. The platelet membrane glycoprotein IIb-IIIa complex. Blood. Apr 1988. https://www.ncbi.nlm.nih.gov/pubmed/2833328?dopt=Abstract.
- Hwang DL, Yen CF, Nadler JL. Effect of extracellular magnesium on platelet activation and intracellular calcium mobilization. Am J Hypertens. . Oct 1992. https://www.ncbi.nlm.nih.gov/pubmed/1418832?dopt=Abstract.
- King DE. Inflammation and elevation of C-reactive protein: does magnesium play a key role? Magnes Res. Jun 2009. https://www.ncbi.nlm.nih.gov/pubmed/19658273.
- Lin CY, et al. L-type calcium channels are involved in mediating the anti-inflammatory effects of magnesium sulphate. Br J Anaesth. Jan 2010. https://www.ncbi.nlm.nih.gov/pubmed/19933511.
- Chacko SA, et al. Relations of dietary magnesium intake to biomarkers of inflammation and endothelial dysfunction in an ethnically diverse cohort of postmenopausal women. Diabetes Care. . Feb 2010. https://www.ncbi.nlm.nih.gov/pubmed/19903755.
- Lusis AJ. Atherosclerosis. Nature. Sep 14, 2000. https://www.ncbi.nlm.nih.gov/pubmed/11001066.
- Maier JA. Endothelial cells and magnesium: implications in atherosclerosis. Clin Sci (Lond). . May 2012. https://www.ncbi.nlm.nih.gov/pubmed/22248353.
- Pearson PJ, et al. Hypomagnesemia inhibits nitric oxide release from coronary endothelium: protective role of magnesium infusion after cardiac operations. Ann Thorac Surg. Apr 1998. https://www.ncbi.nlm.nih.gov/pubmed/9564911.
- Dickens BF, et al. Magnesium deficiency in vitro enhances free radical-induced intracellular oxidation and cytotoxicity in endothelial cells. FEBS Lett. Oct 1992. https://www.ncbi.nlm.nih.gov/pubmed/1397313.
- Wolf FI, et al. Magnesium deficiency and endothelial dysfunction: is oxidative stress involved? Magnes Res. Mar 2008. https://www.ncbi.nlm.nih.gov/pubmed/18557135/.
- Shechter M. Does magnesium have a role in the treatment of patients with coronary artery disease? Am J Cardiovasc Drugs. 2003. https://www.ncbi.nlm.nih.gov/pubmed/14728075.
- Lloyd T.I et al. Magnesium and potassium therapy in multifocal atrial tachycardia. American Heart Journal. Oct 1985. https://www.ncbi.nlm.nih.gov/pubmed/4050650.
- Sueda S, et al. Limited efficacy of magnesium for the treatment of variant angina. J Cardiol. Sep 1999. https://www.ncbi.nlm.nih.gov/pubmed/10500974.
- Kugiyama K. The effects of intravenous magnesium on exercise-induced angina were examined in 15 patients with variant angina and in 13 patients with stable effort angina and were compared with those of placebo. Symptom-limited bicycle exercise and thallium-201 myocar. J Am Coll Cardiol. Nov 1988. https://www.ncbi.nlm.nih.gov/pubmed/3170960.
- Redwood SR. Effect of magnesium sulphate in patients with unstable angina. A double blind, randomized, placebo-controlled study. Eur Heart J. Aug 1997. https://www.ncbi.nlm.nih.gov/pubmed/9458419.
- Teragawa H, et al. The preventive effect of magnesium on coronary spasm in patients with vasospastic angina. Chest. Dec 2000. https://www.ncbi.nlm.nih.gov/pubmed/11115460.
- Tanabe K, et al. Magnesium content of erythrocytes in patients with vasospastic angina. Cardiovasc Drugs Ther. Aug 1991. https://www.ncbi.nlm.nih.gov/pubmed/1888691.
- Djurhuus MS, et. Insulin increases renal magnesium excretion: a possible cause of magnesium depletion in hyperinsulinaemic states. Diabet Med. Aug 1995. https://www.ncbi.nlm.nih.gov/pubmed/7587003/.
- Ramadass S, Basu S, Srinivasan AR. SERUM magnesium levels as an indicator of status of Diabetes Mellitus type 2. Diabetes Metab Syndr. Jan-Mar 2015. https://www.ncbi.nlm.nih.gov/pubmed/25470649/.
- Palmer BF, Clegg DJ. Electrolyte and Acid-Base Disturbances in Patients with Diabetes Mellitus. N Engl J Med. Aug 6, 2015. https://www.ncbi.nlm.nih.gov/pubmed/26244308/.
- Larsson SC, Wolk A. Magnesium intake and risk of type 2 diabetes: a meta-analysis. J Intern Med. Aug 2007. https://www.ncbi.nlm.nih.gov/pubmed/17645588.
- Schulze MB, et al. Fiber and magnesium intake and incidence of type 2 diabetes: a prospective study and meta-analysis. Arch Intern Med. May 14, 2007. https://www.ncbi.nlm.nih.gov/pubmed/17502538.
- Song Y, et al. Dietary magnesium intake in relation to plasma insulin levels and risk of type 2 diabetes in women. Diabetes Care. Jan 2004. https://www.ncbi.nlm.nih.gov/pubmed/14693967.
- Hruby A, et al. Higher magnesium intake reduces risk of impaired glucose and insulin metabolism, and progression from prediabetes to diabetes in middle-aged Americans. Diabetes Care. Oct 2013. http://care.diabetesjournals.org/content/early/2013/09/23/dc13-1397.short.
- Song Y, et al. Effects of oral magnesium supplementation on glycaemic control in Type 2 diabetes: a meta-analysis of randomized double-blind controlled trials. Diabet Med. Oct 2006. https://www.ncbi.nlm.nih.gov/pubmed/16978367.
- Simental LE, et al. A systematic review and meta-analysis of randomized controlled trials on the effects of magnesium supplementation on insulin sensitivity and glucose control. Pharmacol Res. Sep 2016. https://www.ncbi.nlm.nih.gov/pubmed/27329332.
- De Lordes M, et al. The effect of magnesium supplementation in increasing doses on the control of type 2 diabetes. Diabetes Care. May 1998. https://www.ncbi.nlm.nih.gov/pubmed/9589224?dopt=Abstract.
- Mooren FC, et al. Oral magnesium supplementation reduces insulin resistance in non-diabetic subjects - a double-blind, placebo-controlled, randomized trial. Diabetes Obes Metab. Mar 2011. https://www.ncbi.nlm.nih.gov/pubmed/21205110.
- Morán M, Guerrero F. Oral magnesium supplementation improves insulin sensitivity and metabolic control in type 2 diabetic subjects: a randomized double-blind controlled trial. Diabetes Care. Apr 2003. https://www.ncbi.nlm.nih.gov/pubmed/12663588.
- Guerrero-Romero F, Rodríguez-Morán M. Magnesium improves the beta-cell function to compensate variation of insulin sensitivity: double-blind, randomized clinical trial. Eur J Clin Invest. Apr 2011. https://www.ncbi.nlm.nih.gov/pubmed/21241290.
- Solati M, et al. Oral magnesium supplementation in type II diabetic patients. Med J Islam Repub Iran. Jul 15, 2014. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4219896/.
- De Leeuw I, et al. Long term magnesium supplementation influences favourably the natural evolution of neuropathy in Mg-depleted type 1 diabetic patients (T1dm). Magnes Res. Jun 2004. https://www.ncbi.nlm.nih.gov/pubmed/15319143.
- Dzúrik R, et al. The role of magnesium deficiency in insulin resistance: an in vitro study. J Hypertens Suppl. Dec 1991. https://www.ncbi.nlm.nih.gov/pubmed/1818980.
- Balon TW, et al. Magnesium supplementation reduces development of diabetes in a rat model of spontaneous NIDDM. Am J Physiol. Oct 1995. https://www.ncbi.nlm.nih.gov/pubmed/7485490.
- Morakinyo AO, Samuel TA, Adekunbi DA. Magnesium upregulates insulin receptor and glucose transporter-4 in streptozotocin-nicotinamide-induced type-2 diabetic rats. Endocr Regul. Jan 1, 2018. https://www.ncbi.nlm.nih.gov/pubmed/29453923.
- Günther T. The biochemical function of Mg²+ in insulin secretion, insulin signal transduction and insulin resistance. Magnes Res. Mar 2010. https://www.ncbi.nlm.nih.gov/pubmed/20228013.
- Zhong W, et al. [Influence of magnesium supplementation on insulin receptor affinity in erythrocytes of type 2 diabetes rats]. Wei Sheng Yan Jiu. Mar 2013. https://www.ncbi.nlm.nih.gov/pubmed/23654096.
- Barbagallo M, Dominguez LJ. Magnesium metabolism in type 2 diabetes mellitus, metabolic syndrome and insulin resistance. Arch Biochem Biophys. Feb 1, 2007. https://www.ncbi.nlm.nih.gov/pubmed/16808892.
- Mazur A, et al. Plasma and red blood cell magnesium concentrations in Zucker rats: influence of a high fibre diet. Magnes Res. Sep 1989. https://www.ncbi.nlm.nih.gov/pubmed/2561815.
- Solaimani H, et al. Modulation of GLUT4 expression by oral administration of Mg(2+) to control sugar levels in STZ-induced diabetic rats. Can J Physiol Pharmacol. Jan 2014. https://www.ncbi.nlm.nih.gov/pubmed/24821133.
- Rude RK, Singer FR, Gruber HE. Skeletal and hormonal effects of magnesium deficiency. J Am Coll Nutr. Apr 2009. https://www.ncbi.nlm.nih.gov/pubmed/19828898/.
- Elshal MF, et al. The association of bone mineral density and parathyroid hormone with serum magnesium in adult patients with sickle-cell anaemia. Arch Med Sc. May 9, 2012 . https://www.ncbi.nlm.nih.gov/pubmed/22662000/.
- Saito N, et al. Bone mineral density, serum albumin and serum magnesium. J Am Coll Nutr. Dec 2004. https://www.ncbi.nlm.nih.gov/pubmed/15637218/.
- Brodowski J. [Levels of ionized magnesium in women with various stages of postmenopausal osteoporosis progression evaluated on the basis of densitometric examinations]. Przegl Lek. 2000. https://www.ncbi.nlm.nih.gov/pubmed/11398593.
- Orchard TS, et al. Magnesium intake, bone mineral density, and fractures: results from the Women's Health Initiative Observational Study. Am J Clin Nutr. Apr 2014. https://www.ncbi.nlm.nih.gov/pubmed/24500155.
- Dimai HP, et al. Daily oral magnesium supplementation suppresses bone turnover in young adult males. J Clin Endocrinol Metab. Aug 1998. https://www.ncbi.nlm.nih.gov/pubmed/9709941.
- Stendig-Lindberg G, Tepper R, Leichter I. Trabecular bone density in a two year controlled trial of peroral magnesium in osteoporosis. Magnes Res. Jun 1993. https://www.ncbi.nlm.nih.gov/pubmed/8274361.
- Aydin H, et al. Short-term oral magnesium supplementation suppresses bone turnover in postmenopausal osteoporotic women. Biol Trace Elem Res. Feb 2010. https://www.ncbi.nlm.nih.gov/pubmed/19488681?dopt=Abstract.
- Matsuzaki H. [Prevention of osteoporosis by foods and dietary supplements. Magnesium and bone metabolism]. Clin Calcium. Oct 2006. https://www.ncbi.nlm.nih.gov/pubmed/17012818.
- Castiglioni S, et al. Magnesium and Osteoporosis: Current State of Knowledge and Future Research Directions. Nutrients. Aug 2013. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3775240/.
- Enaruna NO, Ande A, Okpere EE. Clinical significance of low serum magnesium in pregnant women attending the University of Benin Teaching Hospital. Niger J Clin Pract. Oct-Dec 2013. https://www.ncbi.nlm.nih.gov/pubmed/23974737.
- Hammar M, et al. Calcium and magnesium status in pregnant women. A comparison between treatment with calcium and vitamin C in pregnant women with leg cramps. Int J Vitam Nutr Res. 1987. https://www.ncbi.nlm.nih.gov/pubmed/3308737.
- Young GL, Jewell D. Interventions for leg cramps in pregnancy. Cochrane Database Syst Rev. 2002. https://www.ncbi.nlm.nih.gov/pubmed/11869565.
- Dahle LO, et al. The effect of oral magnesium substitution on pregnancy-induced leg cramps. Am J Obstet Gynecol. Jul 1995. https://www.ncbi.nlm.nih.gov/pubmed/7631676.
- Supakatisant C, Phupong V. Oral magnesium for relief in pregnancy-induced leg cramps: a randomised controlled trial. Matern Child Nutr. Aug 22, 2012. https://www.ncbi.nlm.nih.gov/pubmed/22909270.
- Popoviciu L, et al. Clinical, EEG, electromyographic and polysomnographic studies in restless legs syndrome caused by magnesium deficiency. Rom J Neurol Psychiatry. Jan-Mar 1993. https://www.ncbi.nlm.nih.gov/pubmed/8363978.
- Frankel BL, Patten BM, Gillin JC. Restless legs syndrome. Sleep-electroencephalographic and neurologic findings. JAMA. Dec 2, 1974. https://www.ncbi.nlm.nih.gov/pubmed/4371194.
- Bartell S, Zallek S. Intravenous magnesium sulfate may relieve restless legs syndrome in pregnancy. J Clin Sleep Med. Apr 15, 2006. https://www.ncbi.nlm.nih.gov/pubmed/17557494.
- Hornyak M, et al. Magnesium therapy for periodic leg movements-related insomnia and restless legs syndrome: an open pilot study. Sleep. Aug 1, 1998. https://www.ncbi.nlm.nih.gov/pubmed/9703590.
- Golf SW, Bender S, Grüttner J. On the significance of magnesium in extreme physical stress. Cardiovasc Drugs Ther. . Sep 1998. https://www.ncbi.nlm.nih.gov/pubmed/?term=9794094.
- Geiss KR, et al. Effects of magnesium orotate on exercise tolerance in patients with coronary heart disease. Cardiovasc Drugs Ther. Sep 1998. https://www.ncbi.nlm.nih.gov/pubmed/9794089.
- Veronese N, et al. Effect of oral magnesium supplementation on physical performance in healthy elderly women involved in a weekly exercise program: a randomized controlled trial. Am J Clin Nutr. Sep 2014. https://www.ncbi.nlm.nih.gov/pubmed/25008857.
- Setaro L, et al. Magnesium status and the physical performance of volleyball players: effects of magnesium supplementation. J Sports Sci. 2014. https://www.ncbi.nlm.nih.gov/pubmed/24015935.
- Kass l, et al. The effect of acute vs chronic magnesium supplementation on exercise and recovery on resistance exercise, blood pressure and total peripheral resistance on normotensive adults. J Int Soc Sports Nutr. Apr 24, 2015. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4419474/.
- Chen YJ, et al. Effects of magnesium on exercise performance and plasma glucose and lactate concentrations in rats using a novel blood-sampling technique. Appl Physiol Nutr Metab. Dec 2009. https://www.ncbi.nlm.nih.gov/pubmed/20029512/.
- Chen H, et al. Magnesium enhances exercise performance via increasing glucose availability in the blood, muscle, and brain during exercise. PLoS One. . Jan 20, 2014. https://www.ncbi.nlm.nih.gov/pubmed/24465574.
- Benassi L, et al. Effectiveness of magnesium pidolate in the prophylactic treatment of primary dysmenorrhea. Clin Exp Obstet Gynecol. 1992. https://www.ncbi.nlm.nih.gov/pubmed/1451282.
- Seifert B, et al. [Magnesium--a new therapeutic alternative in primary dysmenorrhea]. Zentralbl Gynakol. 1989. https://www.ncbi.nlm.nih.gov/pubmed/2675496.
- Fontana-Klaiber H, Hogg B. Therapeutic effects of magnesium in dysmenorrhea. Schweiz Rundsch Med Prax. Apr 19, 1990. https://www.ncbi.nlm.nih.gov/pubmed/2349410.
- Saeedian Kia A, Amani R, Cheraghian B. The Association between the Risk of Premenstrual Syndrome and Vitamin D, Calcium, and Magnesium Status among University Students: A Case Control Study. Health Promot Perspect. Oct 25, 2015. https://www.ncbi.nlm.nih.gov/pubmed/26634201.
- Bendich A. The potential for dietary supplements to reduce premenstrual syndrome (PMS) symptoms. J Am Coll Nutr. Feb 2000. https://www.ncbi.nlm.nih.gov/pubmed/10682869.
- Walker AF. Magnesium supplementation alleviates premenstrual symptoms of fluid retention. J Womens Health. Nov 1998. https://www.ncbi.nlm.nih.gov/pubmed/9861593.
- De Souza MC, et al. A synergistic effect of a daily supplement for 1 month of 200 mg magnesium plus 50 mg vitamin B6 for the relief of anxiety-related premenstrual symptoms: a randomized, double-blind, crossover study. J Womens Health Gend Based Med. Mar 2000. https://www.ncbi.nlm.nih.gov/pubmed/10746516.
- Facchinetti F, et al . Oral magnesium successfully relieves premenstrual mood changes. Obstet Gynecol. Aug 1991. https://www.ncbi.nlm.nih.gov/pubmed/2067759/.
- Magaldi M, et al. [Changes in intracellular calcium and magnesium ions in the physiopathology of the fybromyalgia syndrome]. Minerva Med. Jul-Aug 2000. https://www.ncbi.nlm.nih.gov/pubmed/11155461.
- Eisinger J, et al. Protein peroxidation, magnesium deficiency and fibromyalgia. Magnes Res. Dec 1996. https://www.ncbi.nlm.nih.gov/pubmed/9247880.
- Clauw DJ, et al. Magnesium deficiency in the eosinophilia—myalgia syndrome. report of clinical and biochemical improvement with repletion. Arthritis Rheum. Sep 1994. https://www.ncbi.nlm.nih.gov/pubmed/7945497.
- Eisinger J, et al. Selenium and magnesium status in fibromyalgia. Magnes Res. Dec 1994. https://www.ncbi.nlm.nih.gov/pubmed/7786692.
- Thomas J. Romano, et al . Magnesium Deficiency in Fibromyalgia Syndrome. Journal of Nutritional Medicine. Jul 13, 2009. https://www.tandfonline.com/doi/abs/10.3109/13590849409034552.
- Bagis S, et al. Is magnesium citrate treatment effective on pain, clinical parameters and functional status in patients with fibromyalgia? Rheumatol Int. Jan 2013. https://www.ncbi.nlm.nih.gov/pubmed/22271372?dopt=Abstract.
- Abraham, G.E. Flechas, J.D. Management of fibromyalgia: rationale for the use of magnesium and malic acid [1992]. AGRIS. 2013. http://agris.fao.org/agris-search/search.do?recordID=US201301762139.
- Russell IJ, et al. Treatment of fibromyalgia syndrome with Super Malic: a randomized, double blind, placebo controlled, crossover pilot study. J Rheumatol. May 1995. https://www.ncbi.nlm.nih.gov/pubmed/8587088.
- Galland L. Magnesium, stress and neuropsychiatric disorders. Magnes Trace Elem. 1991-1992. https://www.ncbi.nlm.nih.gov/pubmed/1844561.
- Trauninger A, et al. Oral magnesium load test in patients with migraine. Headache. 2002. https://www.ncbi.nlm.nih.gov/pubmed/12005285.
- Gallai V, et al. Red blood cell magnesium levels in migraine patients. Cephalalgia. Apr 1993. https://www.ncbi.nlm.nih.gov/pubmed/8495462.
- Boska MD, et al. Contrasts in cortical magnesium, phospholipid and energy metabolism between migraine syndromes. Neurology. Apr 23, 2002. https://www.ncbi.nlm.nih.gov/pubmed/11971091.
- Mauskop A. Intravenous magnesium sulphate relieves migraine attacks in patients with low serum ionized magnesium levels: a pilot study. Clin Sci (Lond). Dec 1995. https://www.ncbi.nlm.nih.gov/pubmed/8549082.
- Köseoglu E, et al. The effects of magnesium prophylaxis in migraine without aura. Magnes Res. Jun 2008. https://www.ncbi.nlm.nih.gov/pubmed/18705538.
- A Peikert, C Wilimzig, R Köhne . Prophylaxis of migraine with oral magnesium: results from a prospective, multi-center, placebo-controlled and double-blind randomized study. Cephalalgia. Jun 1999. https://www.ncbi.nlm.nih.gov/pubmed/8792038.
- Tarighat A, et al. The effects of magnesium, L-carnitine, and concurrent magnesium-L-carnitine supplementation in migraine prophylaxis. Biol Trace Elem Res. Dec 2012. https://www.ncbi.nlm.nih.gov/pubmed/22895810.
- Mody I, Lambert JD, Heinemann U. Low extracellular magnesium induces epileptiform activity and spreading depression in rat hippocampal slices. J Neurophysiol. Mar 1987. https://www.ncbi.nlm.nih.gov/pubmed/3031235.
- Marrannes R, et al. Evidence for a role of the N-methyl-D-aspartate (NMDA) receptor in cortical spreading depression in the rat. Brain Res. Aug 9, 1988. https://www.ncbi.nlm.nih.gov/pubmed/2851364.
- Nowak L, et al. Magnesium gates glutamate-activated channels in mouse central neurones. Nature. Feb 2-8, 1984. https://www.ncbi.nlm.nih.gov/pubmed/6320006.
- Banerjee S, Jones S. Magnesium as an Alternative or Adjunct to Opioids for Migraine and Chronic Pain: A Review of the Clinical Effectiveness and Guidelines [Internet]. CADTH Rapid Response Reports. Apr 2017. https://www.ncbi.nlm.nih.gov/pubmed/29334449.
- Coan EJ, Collingridge GL. Magnesium ions block an N-methyl-D-aspartate receptor-mediated component of synaptic transmission in rat hippocampus. Neurosci Lett. Jan 7, 1985. https://www.ncbi.nlm.nih.gov/pubmed/2859558.
- Coderre TJ, et al. Contribution of central neuroplasticity to pathological pain: review of clinical and experimental evidence. Pain. Mar 1993. https://www.ncbi.nlm.nih.gov/pubmed/7681556.
- Myrdal U, et al. Magnesium sulphate infusion decreases circulating calcitonin gene-related peptide (CGRP) in women with primary Raynaud's phenomenon. Clin Physiol. sep 1994. https://www.ncbi.nlm.nih.gov/pubmed/7820978.
- Altura BT, Altura BM. Withdrawal of magnesium causes vasospasm while elevated magnesium produces relaxation of tone in cerebral arteries. Neurosci Lett. . Dec 1980. https://www.ncbi.nlm.nih.gov/pubmed/7443079.
- Baudouin-Legros M, Dard B, Guicheney P. Hyperreactivity of platelets from spontaneously hypertensive rats. Role of external magnesium. Hypertension. . Aug 1986. https://www.ncbi.nlm.nih.gov/pubmed/3733214.
- Turlapaty PD, Altura BM. Magnesium deficiency produces spasms of coronary arteries: relationship to etiology of sudden death ischemic heart disease. Science. Apr 11, 1980. https://www.ncbi.nlm.nih.gov/pubmed/7361117.
- Swain R, Kaplan-Machlis B. Magnesium for the next millennium. South Med J. Nov 1999. https://www.ncbi.nlm.nih.gov/pubmed/10586828.
- Mauskop A, Altura BM. Role of magnesium in the pathogenesis and treatment of migraines. Clin Neurosci. 1998. https://www.ncbi.nlm.nih.gov/pubmed/9523054.
- Altura BM, Turlapaty PD. Withdrawal of magnesium enhances coronary arterial spasms produced by vasoactive agents. Br J Pharmacol. . 1982. https://www.ncbi.nlm.nih.gov/pubmed/7150872.
- Goldstein S, Zsotér TT., et al. The effect of magnesium on the response of smooth muscle to 5-hydroxytryptamine. Br J Pharmacol. Apr 1978. https://www.ncbi.nlm.nih.gov/pubmed/418838.
- Bloch MH, Mulqueen J. Nutritional supplements for the treatment of ADHD. Child Adolesc Psychiatr Clin N Am. Oct 2014. https://www.ncbi.nlm.nih.gov/pubmed/25220092.
- Kozielec T, Starobrat-Hermelin B. Assessment of magnesium levels in children with attention deficit hyperactivity disorder (ADHD). Magnes Res. Jun 1997. https://www.ncbi.nlm.nih.gov/pubmed/9368235.
- Starobrat B, Kozielec T. The effects of magnesium physiological supplementation on hyperactivity in children with attention deficit hyperactivity disorder (ADHD). Positive response to magnesium oral loading test. Magnes Res. Jun 1997. https://www.ncbi.nlm.nih.gov/pubmed/9368236.
- Mousain-Bosc M, et al. Improvement of neurobehavioral disorders in children supplemented with magnesium-vitamin B6. I. Attention deficit hyperactivity disorders. Magnes Res. Mar 2006. https://www.ncbi.nlm.nih.gov/pubmed/16846100/.
- Nogovitsina OR, Levitina EV. [Effect of MAGNE-B6 on the clinical and biochemical manifestations of the syndrome of attention deficit and hyperactivity in children]. Eksp Klin Farmakol. Jan-Feb 2006. https://www.ncbi.nlm.nih.gov/pubmed/16579066/.
- Mousain-Bosc M, et al. Magnesium VitB6 intake reduces central nervous system hyperexcitability in children. J Am Coll Nutr. Oct 2004. https://www.ncbi.nlm.nih.gov/pubmed/15466962/.
- Cardoso CC, et al. Evidence for the involvement of the monoaminergic system in the antidepressant-like effect of magnesium. Prog Neuropsychopharmacol Biol Psychiatry. Mar 17, 2009. https://www.ncbi.nlm.nih.gov/pubmed/19059299/.
- Jacka FN, et al . Association between magnesium intake and depression and anxiety in community-dwelling adults: the Hordaland Health Study. Aust N Z J Psychiatry. Jan 2009. https://www.ncbi.nlm.nih.gov/pubmed/19085527.
- Serefko A, et al. Magnesium in depression. Pharmacol Rep. 2013. https://www.ncbi.nlm.nih.gov/pubmed/23950577.
- Barragán L, Rodríguez M, Guerrero F. Efficacy and safety of oral magnesium supplementation in the treatment of depression in the elderly with type 2 diabetes: a randomized, equivalent trial. Magnes Res. Dec 2008. https://www.ncbi.nlm.nih.gov/pubmed/19271419.
- Boyle NB, Lawton C, Dye L. The Effects of Magnesium Supplementation on Subjective Anxiety and Stress-A Systematic Review. Nutrients. Apr 26, 2017. https://www.ncbi.nlm.nih.gov/pubmed/28445426.
- Pochwat B, et al. Antidepressant-like activity of magnesium in the chronic mild stress model in rats: alterations in the NMDA receptor subunits. Int J Neuropsychopharmacol. Mar 2014. https://www.ncbi.nlm.nih.gov/pubmed/24067405.
- Pochwat B, et al. Antidepressant-like activity of magnesium in the olfactory bulbectomy model is associated with the AMPA/BDNF pathway. Psychopharmacology (Berl). Jan 2015. https://www.ncbi.nlm.nih.gov/pubmed/25027582.
- Sartori SB, et al. Magnesium deficiency induces anxiety and HPA axis dysregulation: modulation by therapeutic drug treatment. Neuropharmacology. Jan 2012. https://www.ncbi.nlm.nih.gov/pubmed/21835188.
- Abumaria N, et al. Effects of elevation of brain magnesium on fear conditioning, fear extinction, and synaptic plasticity in the infralimbic prefrontal cortex and lateral amygdala. J Neurosci. Oct 19, 2011. https://www.ncbi.nlm.nih.gov/pubmed/22016520.
- Charles Y.C. Pak, et al. Defining hypercalciuria in nephrolithiasis. Kidney Int. Mar 10, 2015. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4354881/.
- Schwille PO, et al. Fasting urine excretion of magnesium, calcium, and sodium in patients with renal calcium stones. Urol Res. Apr 21, 1976. https://www.ncbi.nlm.nih.gov/pubmed/181886.
- Schmiedl A, Schwille PO. Is magnesium a marker of disordered mineral metabolism in males with idiopathic recurrent calcium urolithiasis? Observations focussing on fasting magnesiuria and magnesiemia, protein and other substances in urine and plasma. Magnes Res. Sep 2003. https://www.ncbi.nlm.nih.gov/pubmed/14596324.
- F. Faragalla, S. Gershoff. Interrelations among Magnesium, Vitamin B6, Sulfur and Phosphorus in the Formation of Kidney Stones in the Rat. The Journal of Nutrition. Sep 1, 1963. https://academic.oup.com/jn/article-abstract/81/1/60/4775669?redirectedFrom=fulltext.
- Rattan V, et al. Oxalate metabolism in magnesium-deficient rats. Rattan V. Jun 1993. https://www.ncbi.nlm.nih.gov/pubmed/8274358.
- Rushton HG, Spector M. Effects of magnesium deficiency on intratubular calcium oxalate formation and crystalluria in hyperoxaluric rats. J Urol. Mar 1982. https://www.ncbi.nlm.nih.gov/pubmed/7062446.
- T. J. Hahn, L. R. Chase, L. V. Avioli. Effect of Magnesium Depletion on Responsiveness to Parathyroid Hormone in Parathyroidectomized Rats. J Clin Invest. Apr 1972. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC302202/.
- Johnson Biochemical and clinical effects of the prophylacticJohansson G, et al. Biochemical and clinical effects of the prophylactic treatment of renal calcium stones with magnesium hydroxide. J Urol. Dec 19, 1980. https://www.ncbi.nlm.nih.gov/pubmed/7441826.
- Rattan V, et al. Effect of combined supplementation of magnesium oxide and pyridoxine in calcium-oxalate stone formers. Urol Res. 1994. https://www.ncbi.nlm.nih.gov/pubmed/7992461.
- Melnick I, et al. Magnesium therapy for recurring calcium oxalate urinary calculi. J Urol. Jan 1971. https://www.ncbi.nlm.nih.gov/pubmed/5543051.
- Ferrè S, et al. Effect of urine pH and magnesium on calcium oxalate saturation. Magnes Res. Nov 1, 2017. https://www.ncbi.nlm.nih.gov/pubmed/29637896.
- Massey L. Magnesium therapy for nephrolithiasis. Magnes Res. Jan 2005. https://www.ncbi.nlm.nih.gov/pubmed/16100850.
- Santi M, et al. Magnesium in cystic fibrosis—Systematic review of the literature. Pediatr Pulmonol. Feb 2016. https://www.ncbi.nlm.nih.gov/pubmed/26663706.
- Gontijo-Amaral C, Guimarães EV, Camargos P. Oral magnesium supplementation in children with cystic fibrosis improves clinical and functional variables: a double-blind, randomized, placebo-controlled crossover trial. Am J Clin Nutr. Jul 2012. https://www.ncbi.nlm.nih.gov/pubmed/22648717.
- Sanders NN, et al. Role of magnesium in the failure of rhDNase therapy in patients with cystic fibrosis. Thorax. Nov 2006. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2121161/.
- Barbagallo M. Altered ionized magnesium levels in mild-to-moderate Alzheimer's disease. Magnes Res. Sep 2011. https://www.ncbi.nlm.nih.gov/pubmed/21951617/.
- Andrási E, et al. Disturbances of magnesium concentrations in various brain areas in Alzheimer's disease. Magnes Res. Sep 2000. https://www.ncbi.nlm.nih.gov/pubmed/11008926/.
- Xu ZP, et al. Magnesium protects cognitive functions and synaptic plasticity in streptozotocin-induced sporadic Alzheimer's model. PLoS One. Sep 30, 2014. https://www.ncbi.nlm.nih.gov/pubmed/25268773/.
- Slutsky I, et al. Enhancement of learning and memory by elevating brain magnesium. Neuron. Jan 28, 2010. https://www.ncbi.nlm.nih.gov/pubmed/20152124.
- Wang J, et al. Magnesium L-threonate prevents and restores memory deficits associated with neuropathic pain by inhibition of TNF-α. Pain Physician. Sep-Oct 2013. https://www.ncbi.nlm.nih.gov/pubmed/24077207.
- Li W, et al. Elevation of brain magnesium prevents and reverses cognitive deficits and synaptic loss in Alzheimer's disease mouse model. J Neurosci. May 8, 2013. https://www.ncbi.nlm.nih.gov/pubmed/23658180/.
- Zehender M, et al. Antiarrhythmic effects of increasing the daily intake of magnesium and potassium in patients with frequent ventricular arrhythmias. Magnesium in Cardiac Arrhythmias (MAGICA) Investigators. J Am Coll Cardiol. Apr 1997. https://www.ncbi.nlm.nih.gov/pubmed/9120155.
- Tsuji A, et al. Effectiveness of oral magnesium in a patient with ventricular tachycardia due to hypomagnesemia. J Cardiovasc Pharmacol Ther. Sep 2005. https://www.ncbi.nlm.nih.gov/pubmed/16211210.
- Onalan O, et al. Meta-analysis of magnesium therapy for the acute management of rapid atrial fibrillation. Am J Cardiol. Jan 15, 2007. https://www.ncbi.nlm.nih.gov/pubmed/17560883.
- Del Gobbo LC, et al. Circulating and dietary magnesium and risk of cardiovascular disease: a systematic review and meta-analysis of prospective studies. Am J Clin Nutr. Jul 2013. https://www.ncbi.nlm.nih.gov/pubmed/23719551/.
- Altura BT, et al. Magnesium dietary intake modulates blood lipid levels and atherogenesis. Proc Natl Acad Sci U S A. Mar 1990. https://www.ncbi.nlm.nih.gov/pubmed/2308944?dopt=Abstract.
- Shechter M. Low intracellular magnesium levels promote platelet-dependent thrombosis in patients with coronary artery disease. Am Heart J. Aug 2000. https://www.ncbi.nlm.nih.gov/pubmed/10925332?dopt=Abstract.
- Hans CP, Chaudhary DP, Bansal DD. Effect of magnesium supplementation on oxidative stress in alloxanic diabetic rats. Magnes Res. Mar 2003. https://www.ncbi.nlm.nih.gov/pubmed/12735478.
- Barbagallo M, et al. Role of magnesium in insulin action, diabetes and cardio-metabolic syndrome X. Mol Aspects Med. Feb-Jun 2003. https://www.ncbi.nlm.nih.gov/pubmed/12537988.
- Rude RK, et al. Magnesium deficiency-induced osteoporosis in the rat: uncoupling of bone formation and bone resorption. Magnes Res. Dec 1999. https://www.ncbi.nlm.nih.gov/pubmed/10612083/.
- Rude RK, et al. Magnesium deficiency: effect on bone and mineral metabolism in the mouse. Calcif Tissue Int. Jan 2003. https://www.ncbi.nlm.nih.gov/pubmed/12370796/.
- Toba Y, et al. Dietary magnesium supplementation affects bone metabolism and dynamic strength of bone in ovariectomized rats. J Nutr. Feb 2000. https://www.ncbi.nlm.nih.gov/pubmed/10720172.
- Zhou K, et al. Interventions for leg cramps in pregnancy. Cochrane Database Syst Rev. Aug 11, 2015. https://www.ncbi.nlm.nih.gov/pubmed/26262909.
- Nygaard IH et al. Does oral magnesium substitution relieve pregnancy-induced leg cramps? Eur J Obstet Gynecol Reprod Biol. Nov 2008. https://www.ncbi.nlm.nih.gov/pubmed/18768245?dopt=Abstract.
- Roguin Maor N, et al. Effect of Magnesium Oxide Supplementation on Nocturnal Leg Cramps: A Randomized Clinical Trial. JAMA Intern Med. May 1, 2017. https://www.ncbi.nlm.nih.gov/pubmed/28241153.
- P Sebo, et al. Effect of magnesium therapy on nocturnal leg cramps: a systematic review of randomized controlled trials with meta-analysis using simulations . Family Practice. Nov 26, 2013. https://academic.oup.com/fampra/article/31/1/7/438649.
- G Young, et al. Leg cramps. Dr Gavin Young. May 13, 2015. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4429847/.
- Schindler R, Thöni H, Classen HG. The role of magnesium in the generation and therapy of benign muscle cramps. Combined in-vivo/in-vitro studies on rat phrenic nerve-diaphragm preparations. Arzneimittelforschung. . Feb 1998. https://www.ncbi.nlm.nih.gov/pubmed/9541727.
- Consolazio CF, et al. Excretion of sodium, potassium, magnesium and iron in human sweat and the relation of each to balance and requirements. J Nutr. Apr 1963. https://www.ncbi.nlm.nih.gov/pubmed/14022653/.
- Lijnen P, et al. Erythrocyte, plasma and urinary magnesium in men before and after a marathon. Eur J Appl Physiol Occup Physiol. 1988. https://www.ncbi.nlm.nih.gov/pubmed/3220063.
- Rayssiguier Y, Guezennec CY, Durlach J. New experimental and clinical data on the relationship between magnesium and sport. Magnes Res. Jun 1990. https://www.ncbi.nlm.nih.gov/pubmed/2133629.
- Nielsen FH, Lukaski HC. Update on the relationship between magnesium and exercise. Magnes Res. Sep 2006. https://www.ncbi.nlm.nih.gov/pubmed/17172008.
- Cheng SM, et al. Magnesium sulfate enhances exercise performance and manipulates dynamic changes in peripheral glucose utilization. Eur J Appl Physiol. Jan 2010. https://www.ncbi.nlm.nih.gov/pubmed/19816708/.
- Littlejohn G, Guymer E. Modulation of NMDA Receptor Activity in Fibromyalgia. Biomedicines. Apr 11, 2017. https://www.ncbi.nlm.nih.gov/pubmed/28536358.
- Tarleton EK, et al. Role of magnesium supplementation in the treatment of depression: A randomized clinical trial. PLoS One. Jan 27, 2017. https://www.ncbi.nlm.nih.gov/pubmed/28654669.
- Eby GA, Eby KL. Rapid recovery from major depression using magnesium treatment. Med Hypotheses. 2006. https://www.ncbi.nlm.nih.gov/pubmed/16542786.
- Facchinetti F, et al. Oral magnesium successfully relieves premenstrual mood changes. Obstet Gynecol. . Aug 1991. https://www.ncbi.nlm.nih.gov/pubmed/2067759.
- Bourgeois M. Rôle du Magne-B6 dans les manifestations anxieuses en pratique médicale courante. Psychiatr Pract Med . 1987; 39: 18-22.
- Scharbach H. . Anxiété et Magné B6. La Vie Médicale. . 1988;17:867.
- Singewald N, et al. Magnesium-deficient diet alters depression- and anxiety-related behavior in mice--influence of desipramine and Hypericum perforatum extract. Neuropharmacology. Dec 2004. https://www.ncbi.nlm.nih.gov/pubmed/15567428.
- Pyndt Jørgensen B, et al. Dietary magnesium deficiency affects gut microbiota and anxiety-like behaviour in C57BL/6N mice. Acta Neuropsychiatrica. Mar 16, 2015. https://europepmc.org/abstract/med/25773775.
- Crosby V, Wilcock A, Corcoran R. The safety and efficacy of a single dose (500 mg or 1 g) of intravenous magnesium sulfate in neuropathic pain poorly responsive to strong opioid analgesics in patients with cancer. J Pain Symptom Manage. Jan 2000. https://www.ncbi.nlm.nih.gov/pubmed/10687324 .
- Tramer MR, et al. Role of magnesium sulfate in postoperative analgesia. Anesthesiology. Feb 1996. https://www.ncbi.nlm.nih.gov/pubmed/8602664.
- Cohen JS. High-dose oral magnesium treatment of chronic, intractable erythromelalgia. Ann Pharmacother. Feb 2002. https://www.ncbi.nlm.nih.gov/pubmed/11847944.
- Yousef AA, Al-deeb AE. A double-blinded randomised controlled study of the value of sequential intravenous and oral magnesium therapy in patients with chronic low back pain with a neuropathic component. Anaesthesia. Mar 2013. https://www.ncbi.nlm.nih.gov/pubmed/23384256.
- Schwille PO, et al. Magnesium, citrate, magnesium citrate and magnesium-alkali citrate as modulators of calcium oxalate crystallization in urine: observations in patients with recurrent idiopathic calcium urolithiasis. Urol Res. Apr 1999. https://www.ncbi.nlm.nih.gov/pubmed/10424393.
- Cherbuin N, et al. Dietary Mineral Intake and Risk of Mild Cognitive Impairment: The PATH through Life Project. Front Aging Neurosci. Feb 4, 2014. https://www.ncbi.nlm.nih.gov/pubmed/24550825/.
- Classen HG. Magnesium orotate--experimental and clinical evidence. Rom J Intern Med. 2004. https://www.ncbi.nlm.nih.gov/pubmed/16366126.
- Portalatin M, Winstead N. Medical Management of Constipation. Clin Colon Rectal Surg. Mar 2012. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3348737/.
- Gomes PB, Duarte MA, Melo C. Comparison of the effectiveness of polyethylene glycol 4000 without electrolytes and magnesium hydroxide in the treatment of chronic functional constipation in children. J Pediatr (Rio J). Jan-Feb 2011. https://www.ncbi.nlm.nih.gov/pubmed/21116598.
- Roffe C, et al. Randomised, cross-over, placebo controlled trial of magnesium citrate in the treatment of chronic persistent leg cramps. Med Sci Monit. May 2002. https://www-ncbi-nlm-nih-gov.beilinson-ez.medlcp.tau.ac.il/pubmed/12011773.
- Witteman JC, et al. Reduction of blood pressure with oral magnesium supplementation in women with mild to moderate hypertension. Am J Clin Nutr. Jul 1994. https://www.ncbi.nlm.nih.gov/pubmed/8017327.
- Lennon SL, et al. 2015 Evidence Analysis Library Evidence-Based Nutrition Practice Guideline for the Management of Hypertension in Adults. J Acad Nutr Diet. Sep 2017. https://www.ncbi.nlm.nih.gov/pubmed/28578899.
- Dickinson HO. Magnesium supplementation for the management of essential hypertension in adults. Cochrane Database Syst Rev. Jul 19, 2006. https://www.ncbi.nlm.nih.gov/pubmed/16856052.
- Eibl NL, et al. Hypomagnesemia in type II diabetes: effect of a 3-month replacement therapy. Diabetes Care. Feb 1995. https://www.ncbi.nlm.nih.gov/pubmed/7729296.
- Supakatisant C, Phupong V. Oral magnesium for relief in pregnancy-induced leg cramps: a randomised controlled trial. Matern Child Nutr. Apr 2015. https://www.ncbi.nlm.nih.gov/pubmed/22909270.
- Pokan R, et al. Oral magnesium therapy, exercise heart rate, exercise tolerance, and myocardial function in coronary artery disease patients. Br J Sports Med. Sep 2006. https://www.ncbi.nlm.nih.gov/pubmed/16825271.
- Holzgartner H, Maier E, Vierling W. High-dosage oral magnesium therapy in arrhythmias. Results of an observational study in 1.160 patients with arrhythmia. Fortschr Med. . Sep 30, 1990. https://www.ncbi.nlm.nih.gov/pubmed/2242840.
- Proctor ML, Farquhar CM. Dysmenorrhoea. BMJ Clin Evid. Mar 1, 2007. https://www.ncbi.nlm.nih.gov/pubmed/19454059.
- Attias J, et al. Oral magnesium intake reduces permanent hearing loss induced by noise exposure. m J Otolaryngol. Jan-Feb 1994. https://www.ncbi.nlm.nih.gov/pubmed/8135325.
- Taubert K. Magnesium in migraine. Results of a multicenter pilot study. Fortschr Med. Aug 30, 1944. https://www.ncbi.nlm.nih.gov/pubmed/7959501.
- Bigal ME, et al. Intravenous magnesium sulphate in the acute treatment of migraine without aura and migraine with aura. A randomized, double-blind, placebo-controlled study. Cephalalgia. Jun 2002. https://www.ncbi.nlm.nih.gov/pubmed/12110110.
- Demirkaya S, et al. Efficacy of intravenous magnesium sulfate in the treatment of acute migraine attacks. Headache. Feb 2001. https://www.ncbi.nlm.nih.gov/pubmed/11251702.
- Shahrami A. Comparison of therapeutic effects of magnesium sulfate vs. dexamethasone/metoclopramide on alleviating acute migraine headache. J Emerg Med. Jun 2015. https://www.ncbi.nlm.nih.gov/pubmed/25278139.
- Cosaro E, et al. Effects of magnesium supplements on blood pressure, endothelial function and metabolic parameters in healthy young men with a family history of metabolic syndrome. Nutr Metab Cardiovasc Dis. Nov 2014. https://www.ncbi.nlm.nih.gov/pubmed/24984823.
- Dibaba DT, et al. The effect of magnesium supplementation on blood pressure in individuals with insulin resistance, prediabetes, or noncommunicable chronic diseases: a meta-analysis of randomized controlled trials. Am J Clin Nutr. Sep 2017. https://www.ncbi.nlm.nih.gov/pubmed/28724644.
- Rodríguez M. Oral magnesium supplementation improves the metabolic profile of metabolically obese, normal-weight individuals: a randomized double-blind placebo-controlled trial. Arch Med Res. Jul 2014. https://www.ncbi.nlm.nih.gov/pubmed/24830937.
- Guerrero F, et al. Oral magnesium supplementation improves glycaemic status in subjects with prediabetes and hypomagnesaemia: A double-blind placebo-controlled randomized trial. Diabetes Metab. Jun 2015. https://www.ncbi.nlm.nih.gov/pubmed/25937055.
- Rodríguez M, Guerrero F. Oral magnesium supplementation improves insulin sensitivity and metabolic control in type 2 diabetic subjects: a randomized double-blind controlled trial. Diabetes Care. Apr 2003. https://www.ncbi.nlm.nih.gov/pubmed/12663588.
- G Peres, M Mariana, E Cairrão. Pre-Eclampsia and Eclampsia: An Update on the Pharmacological Treatment Applied in Portugal . Journal of Cardiovascular Development and Disease. Jan 17, 2018. http://www.mdpi.com/2308-3425/5/1/3/htm#B12-jcdd-05-00003.
- Duley L, et al. Magnesium sulphate and other anticonvulsants for women with pre-eclampsia. Cochrane Database Syst Rev. Nov 10, 2010. https://www.ncbi.nlm.nih.gov/pubmed/21069663.
- Vierling W, et al. Magnesium deficiency and therapy in cardiac arrhythmias: recommendations of the German Society for Magnesium Research]. Dtsch Med Wochenschr. . May 2013. https://www.ncbi.nlm.nih.gov/pubmed/23700303/.
- Skobeloff EM, et al. Intravenous magnesium sulfate for the treatment of acute asthma in the emergency department. JAMA. Sep 1, 1989. https://www.ncbi.nlm.nih.gov/pubmed/2761061/.
- Golzarian J, Scott HW Jr, Richards WO. Hypermagnesemia-induced paralytic ileus. Dig Dis Sci. May 1994. https://www.ncbi.nlm.nih.gov/pubmed/8174429.
- Berns AS, Kollmeyer KR. Magnesium-induced bradycardia. Ann Intern Med. Dec 1976. https://www.ncbi.nlm.nih.gov/pubmed/999111.
- Clark BA, Brown RS. Unsuspected morbid hypermagnesemia in elderly patients. Am J Nephrol. 1992. https://www.ncbi.nlm.nih.gov/pubmed/1489003.
- Turner JA. Diagnosis and management of pre-eclampsia: an update. Int J Womens Health. Sep 30, 2010. https://www.ncbi.nlm.nih.gov/pubmed/21151680.
- McLaughlin SA, McKinney PE. Antacid-induced hypermagnesemia in a patient with normal renal function and bowel obstruction. Ann Pharmacother. Mar 1998. https://www.ncbi.nlm.nih.gov/pubmed/9533062.
- Somjen G, Hilmy M, Stephen CR. Failure to anesthetize human subjects by intravenous administration of magnesium sulfate. J Pharmacol Exp Ther. Dec 1966. https://www.ncbi.nlm.nih.gov/pubmed/5928261.
- Qureshi T, Melonakos TK. Acute hypermagnesemia after laxative use. Ann Emerg Med. Nov 1996. https://www.ncbi.nlm.nih.gov/pubmed/8909278.
- Gerard SK, Hernandez C, Khayam-Bashi H. Extreme hypermagnesemia caused by an overdose of magnesium-containing cathartics. Ann Emerg Med. Jul 1988. https://www.ncbi.nlm.nih.gov/pubmed/3382076.
- Smilkstein MJ, et al. Severe hypermagnesemia due to multiple-dose cathartic therapy. West J Med. Feb 1988. https://www.ncbi.nlm.nih.gov/pubmed/3348031.
- Ali A, et al. Iatrogenic acute hypermagnesemia after total parenteral nutrition infusion mimicking septic shock syndrome: two case reports. Pediatrics. Jul 2003. https://www.ncbi.nlm.nih.gov/pubmed/12837909.
- Huey CG, et al. Los Angeles County-University of Southern California Medical Center clinical pathology case conference: extreme hypermagnesemia in a neonate. Clin Chem. Apr 1995. https://www.ncbi.nlm.nih.gov/pubmed/7720255.
- Tofil NM, Benner KW, Winkler MK. Fatal hypermagnesemia caused by an Epsom salt enema: a case illustration. South Med J. Feb 2005. https://www.ncbi.nlm.nih.gov/pubmed/15759964.
- Table - Hypermagnesemia. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4455825/table/tbl7/.
- Zeng x, et al. Effects and Safety of Magnesium Sulfate on Neuroprotection. Medicine (Baltimore). Jan 8, 2016. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4706271/.
- Euser A, Cipolla M. Magnesium sulfate treatment for the prevention of eclampsia: A brief review. Stroke. Apr 2009. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2663594/.
- Falco CN, et al . Successful improvement of frequency and symptoms of premature complexes after oral magnesium administration. Arq Bras Cardiol. Jun 2012. https://www.ncbi.nlm.nih.gov/pubmed/22584491.
- De Franceschi L, et al. Oral magnesium supplements reduce erythrocyte dehydration in patients with sickle cell disease. J Clin Invest. Oct 1, 1997. https://www.ncbi.nlm.nih.gov/pubmed/9312186.
- Schuette SA, Lashner BA, Janghorbani M. Bioavailability of magnesium diglycinate vs magnesium oxide in patients with ileal resection. JPEN J Parenter Enteral Nutr. Sep-Oct 1994. https://www.ncbi.nlm.nih.gov/pubmed/?term=magnesium+diglycinate.
- Supakatisant Ch, Phupong v. Oral magnesium for relief in pregnancy-induced leg cramps: a randomised controlled trial. Maternal & Child Nutrition. Aug 22, 2012. http://onlinelibrary.wiley.com/doi/10.1111/j.1740-8709.2012.00440.x/abstract.
- Torshin IY, et al. [Meta-analysis of clinical trials of cardiovascular effects of magnesium orotate]. Ter Arkh. 2015. https://www.ncbi.nlm.nih.gov/pubmed/26281202.
- Domingo JL, et al. Influence of some dietary constituents on aluminum absorption and retention in rats. Kidney Int. Apr 1991. https://www.ncbi.nlm.nih.gov/pubmed/2051716.
- Llobet JM, et al. Acute toxicity studies of aluminium compounds: antidotal efficacy of several chelating agents. Pharmacol Toxicol. Apr 1987. https://www.ncbi.nlm.nih.gov/pubmed/3588526.
- McCarty MF. Magnesium taurate for the prevention and treatment of pre-eclampsia/eclampsia. Med Hypotheses. Oct 1996. https://www.ncbi.nlm.nih.gov/pubmed/8910874.
- —. Complementary vascular-protective actions of magnesium and taurine: a rationale for magnesium taurate. Med Hypotheses. Feb 1996. https://www.ncbi.nlm.nih.gov/pubmed/8692051.
- Coudray C, et al. Study of magnesium bioavailability from ten organic and inorganic Mg salts in Mg-depleted rats using a stable isotope approach. Magnes Res. Dec 2005. https://www.ncbi.nlm.nih.gov/pubmed/16548135.
- Ranade VV1, Somberg JC. Bioavailability and Pharmacokinetics of Magnesium After Administration of Magnesium Salts to Humans. American Journal of Therapeutics. Sep 1, 2001. https://www.ncbi.nlm.nih.gov/pubmed/11550076.
- Walker AF, et al. Mg citrate found more bioavailable than other Mg preparations in a randomised, double‐blind study. Magnes Res. Sep 2003. https://www.ncbi.nlm.nih.gov/pubmed/14596323.
- L'Hommedieu CS, et al. Potentiation of magnesium sulfate--induced neuromuscular weakness by gentamicin, tobramycin, and amikacin. J Pediatr. Apr 1983. https://www.ncbi.nlm.nih.gov/pubmed/6834204?dopt=Abstract.
- P P Parsons, H O Garland, and E S Harpur. Localization of the nephron site of gentamicin-induced hypercalciuria in the rat: a micropuncture study. Br J Pharmacol. May 2000. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1572084/.
- Naggar VF, Khalil SA. Effect of magnesium trisilicate on nitrofurantoin absorption. Clin Pharmacol Ther. Jun 1979. https://www.ncbi.nlm.nih.gov/pubmed/36251.
- Lambs L, Brion M, Berthon G. Metal ion–tetracycline interactions in biological fluids. Part 3. Formation of mixed-metal ternary complexes of tetracycline, oxytetracycline, doxycycline and minocycline with calcium and magnesium, and their involvement in the bioavailability of these an. Agents Actions. Jun 1984. https://www.ncbi.nlm.nih.gov/pubmed/6475671.
- Peloquin CA, et al. Pharmacokinetics of isoniazid under fasting conditions, with food, and with antacids. Int J Tuberc Lung Dis. Aug 1993. https://www.ncbi.nlm.nih.gov/pubmed/10460103.
- Mayer J, et al. Reduced nephrotoxicity of conventional amphotericin B therapy after minimal nephroprotective measures: animal experiments and clinical study. J Infect Dis. Aug 1, 2002. https://www.ncbi.nlm.nih.gov/pubmed/12134234.
- Stark G, et al. Magnesium abolishes inadequate kinetics of frequency adaptation of the Q-aT interval in the presence of sotalol. Cardiovasc Res. Jul 1997. https://www.ncbi.nlm.nih.gov/pubmed/9302346.
- Tolevamer. DrugBank. https://www.drugbank.ca/drugs/DB01344.
- Drug-Drug Interaction Checker. DrugBank. https://www.drugbank.ca/interax/multi_search.
- Sotalol. DrugBamk. https://www.drugbank.ca/drugs/DB00489.
- Tveskov C, et al. Potassium and magnesium distribution, ECG changes, and ventricular ectopic beats during beta 2-adrenergic stimulation with terbutaline in healthy subjects. Chest. Dec 1994. https://www.ncbi.nlm.nih.gov/pubmed/7988180?dopt=Abstract.
- Stanton MF, Lowenstein FW. Serum magnesium in women during pregnancy, while taking contraceptives, and after menopause. J Am Coll Nutr. Aug 1987. https://www.ncbi.nlm.nih.gov/pubmed/3611529.
- Warfarin. DrugBank. https://www.drugbank.ca/drugs/DB00682.
- P J Neuvonen, K T Kivistö. The effects of magnesium hydroxide on the absorption and efficacy of two glibenclamide preparations. Br J Clin Pharmacol. Aug 1991. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1368446/.
- Digoxine. DrugBank. https://www.drugbank.ca/drugs/DB00390.
- Gottlieb SS. Importance of magnesium in congestive heart failure. Am J Cardiol. Apr 18, 1989. https://www.ncbi.nlm.nih.gov/pubmed/2650514?dopt=Abstract.
- Quinidine. DrugBank. https://www.drugbank.ca/drugs/DB00908.
- Ryan MP, et al. Effects of diuretics on the renal handling of magnesium. Drugs. Oct 1984. https://www.ncbi.nlm.nih.gov/pubmed/6389077.
- Stanton MF, Lowenstein FW. Serum magnesium in women during pregnancy, while taking contraceptives, and after menopause. J Am Coll Nutr. Aug 1987. https://www.ncbi.nlm.nih.gov/pubmed/3611529?dopt=Abstract.
- Dunn CJ1, Goa KL. Risedronate: a review of its pharmacological properties and clinical use in resorptive bone disease. Drugs. 2001. https://www.ncbi.nlm.nih.gov/pubmed/11368289?dopt=Abstract.
- Methylphenidate. DrugBank. https://www.drugbank.ca/drugs/DB00422.
- Croner R, et al. Effects of partial and total colectomy on mineral and acid-base homoeostasis in the rat: magnesium deficiency, hyperphosphaturia and osteopathy, in the presence of high serum 1,25-dihydroxyvitamin D but normal parathyroid hormone. Clin Sci (Lond). Jun 2000. https://www.ncbi.nlm.nih.gov/pubmed/10814601.
- Lithium. DrugBank. https://www.drugbank.ca/drugs/DB01356.
- Cantilena LR Jr, Klaassen CD. The effect of chelating agents on the excretion of endogenous metals. Toxicol Appl Pharmacol. May 1982. https://www.ncbi.nlm.nih.gov/pubmed/6285552?dopt=Abstract.
- Heck AM, DeWitt BA, Lukes AL. Potential interactions between alternative therapies and warfarin. Am J Health Syst Pharm. Jul 1, 2000. https://www.ncbi.nlm.nih.gov/pubmed/10902065.
- Hoult JR, Payá M. Pharmacological and biochemical actions of simple coumarins: natural products with therapeutic potential. Gen Pharmacol. Jan 1996. https://www.ncbi.nlm.nih.gov/pubmed/8853310.
- Srivastava KC. Antiplatelet principles from a food spice clove (Syzygium aromaticum L) [corrected]. Prostaglandins Leukot Essent Fatty Acids. . May 1993. https://www.ncbi.nlm.nih.gov/pubmed/8321872?dopt=Abstract.
- Saeed SA, Gilani AH. Antithrombotic activity of clove oil. J Pak Med Assoc. May 1994. https://www.ncbi.nlm.nih.gov/pubmed/8078176.
- Srivastava KC, Malhotra N. Acetyl eugenol, a component of oil of cloves (Syzygium aromaticum L.) inhibits aggregation and alters arachidonic acid metabolism in human blood platelets. Prostaglandins Leukot Essent Fatty Acids. Jan 1991. https://www.ncbi.nlm.nih.gov/pubmed/2011614.
- Chen SJ, Wang MH, Chen IJ. Antiplatelet and calcium inhibitory properties of eugenol and sodium eugenol acetate. Gen Pharmacol. Jun 1996. https://www.ncbi.nlm.nih.gov/pubmed/8853295.
- Anja G Teschemacher, et al. Inhibition of the current of heterologously expressed HERG potassium channels by imipramine and amitriptyline. Br J Pharmacol. Sep 1999. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1571643/.
- Nielsen FH. Biochemical and physiologic consequences of boron deprivation in humans. Environ Health Perspect. Noc 1994. https://www.ncbi.nlm.nih.gov/pubmed/7889883.
- Purvis JR, et al. Effect of oral magnesium supplementation on selected cardiovascular risk factors in non-insulin-dependent diabetics. Arch Fam Med. . Jun 1994. https://www.ncbi.nlm.nih.gov/pubmed/8081529.
- Hruby A, et al. Higher magnesium intake is associated with lower fasting glucose and insulin, with no evidence of interaction with select genetic loci, in a meta-analysis of 15 CHARGE Consortium Studies. J Nutr. . Mar 2013. https://www.ncbi.nlm.nih.gov/pubmed/23343670?dopt=Abstract.
- He K, et al. Magnesium intake and incidence of metabolic syndrome among young adults. Circulation. Apr 4, 2006. https://www.ncbi.nlm.nih.gov/pubmed/16567569.
- Scheen AJ, et al. Perspective in the treatment of insulin resistance. Hum Reprod. Oct 1997. https://www.ncbi.nlm.nih.gov/pubmed/9403322.
- El-Khayat W, et al. A novel protocol for postpartum magnesium sulphate in severe pre-eclampsia: a randomized controlled pilot trial. J Matern Fetal Neonatal Med. Dec 23, 2014. https://www.ncbi.nlm.nih.gov/pubmed/25483417.
- Chien PF, Khan KS, Arnott N. Magnesium sulphate in the treatment of eclampsia and pre-eclampsia: an overview of the evidence from randomised trials. Br J Obstet Gynaecol. Nov 1996. https://www.ncbi.nlm.nih.gov/pubmed/8916993.
- Azria E, et al. Magnesium sulfate in obstetrics: current data. J Gynecol Obstet Biol Reprod (Paris). Oct 2004. https://www.ncbi.nlm.nih.gov/pubmed/15567967.
- Duley L, Gülmezoglu AM, Chou D. Magnesium sulphate versus lytic cocktail for eclampsia. Cochrane Database Syst Rev. Sep 8, 2010. https://www.ncbi.nlm.nih.gov/pubmed/20824833.
- Duley L, et al. Magnesium sulphate versus diazepam for eclampsia. Cochrane Database Syst Rev. Dec 8, 2010. https://www.ncbi.nlm.nih.gov/pubmed/21154341.
- Ariza AC, et al. Effects of magnesium sulfate on lipid peroxidation and blood pressure regulators in preeclampsia. Clin Biochem. . Feb 2005. https://www.ncbi.nlm.nih.gov/pubmed/15642274.
- Guerrera MP, Volpe SL, Mao JJ. Therapeutic uses of magnesium. Am Fam Physician. Jul 15, 2009. https://www.ncbi.nlm.nih.gov/pubmed/19621856.
- Duley L, Gülmezoglu AM, Henderson-Smart DJ. Magnesium sulphate and other anticonvulsants for women with pre-eclampsia. Cochrane Database Syst Rev. 2003. https://www.ncbi.nlm.nih.gov/pubmed/12804383.
- Abad C, et al. Magnesium sulfate affords protection against oxidative damage during severe preeclampsia. Placenta. Feb 2015. https://www.ncbi.nlm.nih.gov/pubmed/25486968.
- Spinnato JA, Livingston JC. Prevention of Preeclampsia With Antioxidants: Evidence From Randomized Trials. Clin Obstet Gynecol. . Jun 2005. https://www.ncbi.nlm.nih.gov/pubmed/15805799.
- Ariza AC, et al. Effects of magnesium sulfate on lipid peroxidation and blood pressure regulators in preeclampsia. Clin Biochem. feb 2005. https://www.ncbi.nlm.nih.gov/pubmed/15642274.
- Nelson KB, Grether JK. Can magnesium sulfate reduce the risk of cerebral palsy in very low birthweight infants? Pediatrics. feb 1995. https://www.ncbi.nlm.nih.gov/pubmed/7838646.
- J Grether, et al. Magnesium sulfate tocolysis and risk of neonatal death. PlumX Metrics1998. Jan. http://www.ajog.org/article/S0002-9378(98)70617-9/fulltext.
- Abad c, et al. Effect of magnesium sulfate on the calcium-stimulated adenosine triphosphatase activity and lipid peroxidation of red blood cell membranes from preeclamptic women. Biochem Pharmacol. Nov 25, 2005. https://www.ncbi.nlm.nih.gov/pubmed/16226223.
- Abad c, et al. Effect of Magnesium Sulfate on the Osmotic Fragility and Lipid Peroxidation of Intact Red Blood Cells from Pregnant Women with Severe Preeclampsia. Hypertens Pregnancy. Jan 2011. https://www.ncbi.nlm.nih.gov/pubmed/19412839.
- Carrera F, et al. Preeclampsia and Calcium‐ATPase Activity of Plasma Membranes from Human Myometrium and Placental Trophoblast. Hypertens Pregnancy. 2003. https://www.ncbi.nlm.nih.gov/pubmed/14572366.
- Korish AA. Magnesium sulfate therapy of preeclampsia: an old tool with new mechanism of action and prospect in management and prophylaxis. Hypertens Res. Oct 2012. https://www.ncbi.nlm.nih.gov/pubmed/22763474.
- Chen Q, et al. The reduction of circulating levels of IL-6 in pregnant women with preeclampsia by magnesium sulphate and nifedipine: In vitro evidence for potential mechanisms. Placenta. Jun 2015. https://www.ncbi.nlm.nih.gov/pubmed/25907222.
- Amash A, et al. Magnesium sulfate normalizes placental interleukin-6 secretion in preeclampsia. J Interferon Cytokine Res. Sep 2010. https://www.ncbi.nlm.nih.gov/pubmed/20715974.
- Roguin Maor N, et al. Effect of Magnesium Oxide Supplementation on Nocturnal Leg Cramps: A Randomized Clinical Trial. JAMA Intern Med. May 1, 2017. https://www.ncbi.nlm.nih.gov/pubmed/28241153.
- Hatzistavri LS, et al. Oral magnesium supplementation reduces ambulatory blood pressure in patients with mild hypertension. Am J Hypertens. Oct 2009. https://www.ncbi.nlm.nih.gov/pubmed/19617879.
- Rosenbaum, et al. Beneficial Effects of Magnesium Supplementation On Idiopathic Muscle Cramps. ClinicalTrials.gov. Feb 7, 2012. https://clinicaltrials.gov/ct2/show/NCT00963638.
- Corica F, et al. Effects of oral magnesium supplementation on plasma lipid concentrations in patients with non-insulin-dependent diabetes mellitus. Magnes Res. Mar 1994. https://www.ncbi.nlm.nih.gov/pubmed/8054260.
- Starobrat B, Kozielec T. The effects of magnesium physiological supplementation on hyperactivity in children with attention deficit hyperactivity disorder (ADHD). Positive response to magnesium oral loading test. Magnes Res. Jun 1997. https://www.ncbi.nlm.nih.gov/pubmed/9368236.
- Johansson G, et al. Biochemical and clinical effects of the prophylactic treatment of renal calcium stones with magnesium hydroxide. J Urol. Dec 1980. https://www.ncbi.nlm.nih.gov/pubmed/7441826.
- Stepura OB, Martynow AI. Magnesium orotate in severe congestive heart failure (MACH). Int J Cardiol. May 1, 2009. https://www.ncbi.nlm.nih.gov/pubmed/19367681/.
- Baker WL, et al. Effect of magnesium L-lactate on blood pressure in patients with an implantable cardioverter defibrillator. Ann Pharmacother. Apr 2009. https://www.ncbi.nlm.nih.gov/pubmed/19336644.
- Centers for Disease Control and Prevention (CDC) National Health and Nutrition Examination Survey. Jan 8, 2015. http://www.ars.usda.gov/SP2UserFiles/Place/80400530/pdf/0506/usual_nutrient_intake_vitD_ca_phos_mg_2005-06.pdf.
- Berthon G, Brion M, Lambs L. Metal ion-tetracycline interactions in biological fluids. 2. Potentiometric study of magnesium complexes with tetracycline, oxytetracycline, doxycycline, and minocycline, and discussion of their possible influence on the bioavailability of these antibioti. J Inorg Biochem. Aug 1983. https://www.ncbi.nlm.nih.gov/pubmed/6619838.
- Barton CH. Renal magnesium wasting associated with amphotericin B therapy. Am J Med. Sep 1984. https://www.ncbi.nlm.nih.gov/pubmed/6475987.
- Läer S, Neumann J, Scholz H. Interaction between sotalol and an antacid preparation. Br J Clin Pharmacol. Mar 1997. https://www.ncbi.nlm.nih.gov/pubmed/9088581.
- Blitz M, et al. Inhaled magnesium sulfate in the treatment of acute asthma. Cochrane Database Syst Rev. Jul 20, 2005. https://www.ncbi.nlm.nih.gov/pubmed/16034914.
- Ravn HB, et al. Magnesium inhibits human platelets. Blood Coagul Fibrinolysis. mar 1996. https://www.ncbi.nlm.nih.gov/pubmed/8735829?dopt=Abstract.
- Koinig H, et al. Magnesium sulfate reduces intra- and postoperative analgesic requirements. Anesth Analg. Jul 1998. https://www.ncbi.nlm.nih.gov/pubmed/9661575.
- McCarty MF. Magnesium taurate and fish oil for prevention of migraine. Med Hypotheses. Dec 1996. https://www.ncbi.nlm.nih.gov/pubmed/8961243.
- Holford P. Supplements – Optimum Daily Allowances. Patric Holford. Jan 6, 2009. https://www.patrickholford.com/advice/supplements-optimum-daily-allowances.
- Sojka J, et al. Magnesium kinetics in adolescent girls determined using stable isotopes: effects of high and low calcium intake. Am J Physiol. Aug 1997. https://www.ncbi.nlm.nih.gov/pubmed/9277559.
- Spencer H, et al. Effect of magnesium on the intestinal absorption of calcium in man. J Am Coll Nutr. Oct 1994. https://www.ncbi.nlm.nih.gov/pubmed/7836628.
- Fine KD, et al. Intestinal absorption of magnesium from food and supplements. J Clin Invest. Aug 1991. https://www.ncbi.nlm.nih.gov/pubmed/1864954.
- Hardwick LL, et al. Magnesium absorption: mechanisms and the influence of vitamin D, calcium and phosphate. J Nutr. Jan 1991. https://www.ncbi.nlm.nih.gov/pubmed/1992050/.
- Rasmussen HS, et al. Influence of magnesium substitution therapy on blood lipid composition in patients with ischemic heart disease. A double-blind, placebo controlled study. Arch Intern Med. . May 1989. https://www.ncbi.nlm.nih.gov/pubmed/2719498.
- Bardgett ME, et al. Magnesium deficiency impairs fear conditioning in mice. Brain Res. Mar 15, 2005. https://www.ncbi.nlm.nih.gov/pubmed/15748878/.
- Boyle NB, Lawton CL, Dye L. The effects of magnesium supplementation on subjective anxiety. Magnes Res. . Mar 1, 2016. https://www.ncbi.nlm.nih.gov/pubmed/27869100.
- Red. Nocturnal Leg Cramps. MMW Fortschr Med. Aug 20, 2015.
- S Castiglioni, et al. Magnesium and Osteoporosis: Current State of Knowledge and Future Research Directions. Nutrients. Aug 2013. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3775240/.
- Lindberg J, Harvey J, Pak CY. Effect of magnesium citrate and magnesium oxide on the crystallization of calcium salts in urine: changes produced by food-magnesium interaction. J Urol. Feb 1990. https://www.ncbi.nlm.nih.gov/pubmed/2299712.
- Weglicki WB, Phillips TM. Pathobiology of magnesium deficiency: a cytokine/neurogenic inflammation hypothesis. Am J Physiol. Sep 1992. https://www.ncbi.nlm.nih.gov/pubmed/1384353.
- Tahara H, Nishizawa Y. Hypomagnesemia and hypoparathyroidism. Clin Calcium. Aug 2007. https://www.ncbi.nlm.nih.gov/pubmed/17660616.
-
Dai Q, et al. Magnesium status and supplementation influence vitamin D status and metabolism: results from a randomized trial. Am J Clin Nutr. 2018 Dec 1;108(6):1249-1258.
https://www.ncbi.nlm.nih.gov/pubmed/30541089
דוגמא לדף מידע מלא
לרכישת מנוי |
כניסת מנויים




